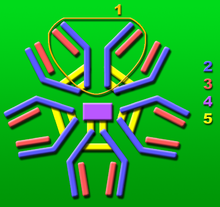
Łańcuch J
| Identyfikacja | |
| OMIM | |
|---|---|
| Genetyka i fizjologia | |
| Locus |
4q13.3 |
| Funkcje |
łańcuch łączący polimeryczne |
Łańcuch J (ang. J Chain, J od joining - łączący) – białko stanowiące element struktury polimerycznych form immunoglobulin IgM i IgA. Zbudowany jest z 137 aminokwasów i kodowany przez gen JCHAIN.
Budowa
Masa cząsteczkowa łańcucha J wynosi ok. 15,6 kDa.
Wykazuje typową dla immunoglobulin budowę dwóch harmonijek beta złożonych z czterech nici beta. Posiada 8 reszt cysteinowych. Dwie z tych reszt łączą łańcuchy α IgA (Cys495) lub łańcuchy μ IgM (Cys575) przez mostki dwusiarczkowe, stanowiąc połączenie pomiędzy dwoma regionami Fc cząsteczek tych przeciwciał. Łańcuch J wykazuje wysoki stopień homologii między immunoglobulinami ptaków i ludzkimi, sugerując, że spełnia ważną rolę w odporności humoralnej.
Funkcja
Zasadniczą rolą łańcucha J jest umożliwianie tworzenia form polimerycznych przez IgA i IgM i ich translokacji przez komórki nabłonka błon śluzowych. Występuje ścisła współzależność pomiędzy cząsteczką polimerycznej immunoglobuliny IgM lub IgA (pIg), a receptorem dla tych polimerycznych form immunoglobulin (pIgR).
Głównym miejscem syntezy tego polipeptydu jest tkanka limfoidalna związana z błonami śluzowymi (MALT).
Ponieważ IgM i IgA są jedynymi dwoma klasami przeciwciał, które polimeryzują, początkowo zakładano, że łańcuch J jest konieczny do polimeryzacji. Jednak później odkryto, że IgM może polimeryzować w nieobecności łańcucha J zarówno w formie pentameru, jak i heksameru. Jednakże obie formy bez łańcucha J występują mniej licznie niż z łańcuchem J. Dotyczy to też dimerów IgA.
Łańcuch J również odgrywa rolę w aktywacji dopełniacza. Heksamery IgM bez łańcucha J są 15-20 razy silniej aktywują dopełniacz niż pentameryczne IgM z łańcuchem J. W efekcie IgM z łańcuchem J jest "bezpieczniejsza", bo może wiązać antygeny bez powodowania nadmiernego uszkodzenia błon nabłonków poprzez aktywację dopełniacza.