Hemofilia
| Haemophilia | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
{{Choroba infobox}}
|
Hemofilie (łac. haemophilia, z gr. αἷμα = "krew" + φιλíα = "kochać") – grupa trzech uwarunkowanych genetycznie skaz krwotocznych, których objawy wynikają z niedoborów czynników krzepnięcia: VIII (hemofilia A), IX (hemofilia B) lub XI (hemofilia C). Hemofilia typu A i B głównie dotyczy mężczyzn, typ C - zarówno kobiet i mężczyzn.
Etiologia
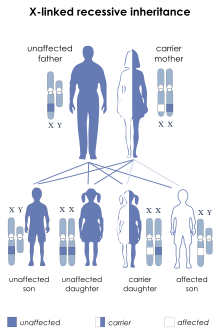
Hemofilia A i B są chorobami sprzężonymi z płcią. Geny, których mutacje wywołują choroby, znajdują się na chromosomie X. Hemofilie dziedziczone są w sposób recesywny, co oznacza, że chorują jedynie osoby z pełną ekspresją recesywnego genu:
- mężczyźni hemizygotyczni względem zmutowanego genu
- kobiety homozygotyczne względem zmutowanego genu.
Kobieta nosicielka zmutowanego allela genu posiada drugi chromosom X z prawidłowym allelem i nie choruje. Syn, który urodzi się ze związku z nosicielką wadliwego genu, może odziedziczyć od matki mutację i wtedy będzie chorował na hemofilię, natomiast córka z takiego związku może być tylko nosicielką zmutowanego allelu (prawdopodobieństwo odziedziczenia wadliwego allelu wynosi 50%).
Możliwe jest zachorowanie na hemofilię córki kobiety-nosicielki wadliwego genu, w przypadku, kiedy ojciec takiej dziewczynki będzie chory na hemofilię: wówczas obydwie kopie genu będą miały mutacje.
Dziecko mężczyzny chorującego na hemofilię będzie zdrowe(chłopiec) lub będzie nosicielem(dziewczynka) – (przy założeniu, że drugi rodzic nie jest nosicielem uszkodzonego genu).
Dziecko kobiety będącej nosicielką może być nosicielem (dziewczynka) lub może być chore (chłopiec), ale może też być zdrowe – (przy założeniu, że ojciec nie jest chory na hemofilię, czyli nie jest nosicielem uszkodzonego genu).
Choroba w 1/3 przypadków jest wynikiem mutacji de novo i wywiad rodzinny jest ujemny.
Typy
- Hemofilia A (OMIM: 306700) – spowodowana mutacją w locus Xq28 powodującą niedobór VIII czynnika krzepnięcia krwi (czynnika antyhemolitycznego); klasyczna hemofilia.
- Hemofilia B (OMIM: 306900) – mutacja w locus Xq27.1-q27.2, niedobór IX czynnika krzepnięcia krwi (czynnika Christmasa).
- Hemofilia C (OMIM: 264900) – mutacja w locus 4q35, niedobór XI czynnika krzepnięcia krwi (czynnika Rosenthala), najczęściej w populacji Żydów Aszkenazyjskich, dziedziczenie autosomalne recesywne.
- Nabyta hemofilia – bardzo rzadka choroba, występująca zarówno u mężczyzn jak i kobiet. W około połowie przypadków hemofilii nabytej, przyczyny nigdy nie udaje się ustalić. Niekiedy jest ona związana z chorobami autoimmunologicznymi, nowotworami, może być wywołana ciążą lub reakcją na leki. Bezpośrednią przyczyną są autoprzeciwciała skierowane przeciwko czynnikowi VIII.
- Postacie kliniczne hemofilii
Postać mówi nam o tym, jak poważne mogą być objawy hemofilii. Normalny poziom u zdrowego człowieka wynosi od 50% do 150% aktywności czynnika VIII lub IX. Postać choroby zależy od poziomu czynnika krzepnięcia we krwi i kształtuje się następująco:
- ciężka, stężenie czynnika VIII/IX w osoczu <1% normalnej aktywności czynnika krzepnięcia
- częste krwawienia do stawów (głównie kolanowych skokowych i łokciowych) oraz mięśni
- do krwawień może dochodzić nawet raz lub dwa razy w ciągu tygodnia
- do krwawień może dochodzić bez zauważalnej przyczyny tzw. wylewy samoistne
- umiarkowana, stężenie czynnika VIII/IX w osoczu 1-5% normalnej aktywności czynnika krzepnięcia
- możliwe długotrwałe krwawienia po operacji, po poważnym zranieniu lub podczas zabiegów stomatologicznych
- krwawienia najczęściej zdarzają się raz w miesiącu
- krwawienia rzadko pojawiają się bez przyczyny
- łagodna, stężenie czynnika VIII/IX w osoczu 5-30% normalnej aktywności czynnika krzepnięcia
- możliwe długotrwałe krwawienia po operacji lub w wyniku bardzo poważnego zranienia
- nigdy może nie pojawić się poważne krwawienie
- krwawienia nie występują często i dochodzi do nich tylko w wyniku urazów
- utajona, stężenie czynnika VIII/IX w osoczu 30-50% normalnej aktywności czynnika krzepnięcia
Osoby z ciężką hemofilią odznaczają się niższym poziomem jakości życia związanego ze zdrowiem.
Śmiertelność wśród chorych na hemofilię jest o 20% wyższa niż w populacji ogólnej, a w hemofilii ciężkiej o 40%.
Epidemiologia
Wrodzona hemofilia A występuje z częstotliwością 1:5000 urodzeń u mężczyzn, hemofilia B jest rzadsza i częstość jej występowania wynosi 1:25,000-30,000 urodzeń u mężczyzn. Nabyta hemofilia A rozwija się częściej u osób powyżej 60 r. ż.. Częstość zachorowań to 1:1,000,000 na rok. W Polsce na hemofilię choruje ok. 3000 osób
Objawy i przebieg
- Objawy
Objawy hemofilii A i B są takie same.
Krwawienia wewnętrzne (niektóre powodują krwiaki):
- krwawienia podskórne,
- krwawienia do stawów, szczególnie kolanowych, skokowych i łokciowych,
- krwawienia do mięśni np. mięśnia biodrowo-lędźwiowego, łydki,
- krwiomocz,
- krwawienia samoistne (nagłe krwawienia wewnątrz ciała bez konkretnej przyczyny),
Krwawienia zewnętrzne (rzadziej):
- krwawienia z błony śluzowej jamy ustnej i nosa
Krwawienia które mogą zagrażać życiu:
- krwawienie pozaotrzewnowe,
- krwawienie do ośrodkowego układu nerwowego,
- krwawienie w okolicach szyi
Jeśli krwawienia powtarzają się wielokrotnie do tego samego stawu, powodują one trwałe w nim uszkodzenia oraz bóle stawowe. Dodatkowo powodują poważne zwyrodnienia stawów. Utrudnia to poruszanie się oraz wykonywanie codziennych czynności. Co ciekawe stawy dłoni u chorych na hemofilię zwykle pozostają w dobrym stanie.
Rozpoznanie
- wydłużony czas kaolinowo-kefalinowy (APTT)
- obniżenie aktywności VIII lub IX
- czas protrombinowy jest prawidłowy
- czas krwawienia jest prawidłowy
- ilość płytek krwi jest prawidłowa.
Prosty test różnicujący hemofilię A i B polega na dodaniu osocza pacjenta z hemofilią B, jeśli badane osocze pochodzi od pacjenta z hemofilią A, dojdzie do korekcji czasu kaolinowo-kefalinowego.
Diagnostyka preimplantacyjna (PGD)
Diagnostyka preimplantacyjna (PGD) w kierunku hemofilii A polega na badaniu amplifikacji znajdującego się na ramieniu długim chromosomu X (Xq28) genu F8 (najczęstsza mutacja dotyczy intronu 22), a w kierunku hemofilii B na badaniu amplifikacji genu F9. Materiał jest analizowany metodą fluorescencyjnej hybrydyzacji in situ (FISH) albo łańcuchowej reakcji polimerazy (PCR). Diagnostyka taka jest możliwe w przypadku procedury zapłodnienia in vitro (IVF). Do badania pobierana jest jedna lub dwie komórki zarodka (blastomery) lub ciałko kierunkowe z komórki jajowej (w tym przypadku badany jest tylko materiał genetycznych pochodzący od matki).
Hemofilia a zakażenie chorobami wirusowymi
HIV
Dawniej hemofilicy należeli do grup podwyższonego ryzyka jeśli chodzi o zakażenie wirusem HIV (z uwagi na częste przetaczanie preparatów krwiopochodnych). Mimo to, odsetek zakażeń był bardzo niewielki (dotyczyło to także i Polski, gdzie stosowano preparat Krioprecypitat, o wiele mniej narażony na zakażenie - produkowany z donacji osocza małej grupy dawców). Obecnie krew jest badana pod kątem obecności wirusa HIV, a leki są poddawane metodzie inaktywacji wirusów otoczkowych (do tej właśnie grupy wirusów należą wirusy HIV, HBV i HCV). Leczenie chorych na hemofilię coraz częściej opiera się na lekach nie produkowanych z krwi tzw. lekach rekombinowanych produkowanych dzięki biotechnologii.
Wirusowe zapalenie wątroby
W Polsce większość dorosłych chorych na hemofilię jest zakażonych wirusowym zapaleniem wątroby typu C. Obecnie ryzyko przeniesienia wirusów HCV i HBV za pomocą osoczopochodnych koncentratów czynników krzepnięcia jest znikome.
Profilaktyka i leczenie
Podstawowym celami w postępowaniu z chorymi na ciężką postać hemofilii powinny być:
- zapobieganie samoistnym krwawieniom do stawów i mięśni,
- profilaktyka krwawień w okresie okołooperacyjnym,
- skuteczne leczenie wszystkich ostrych epizodów krwotocznych.
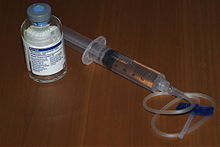
Leczenie polega na wstrzykiwaniu dożylnie koncentratów czynników VIII lub IX. Preparaty są rekombinowane (uzyskane metodami inżynierii genetycznej) lub wysokooczyszczone (osoczopochodne), i na ogół są słabo immunogenne. Czynnik VIII ma czas biologicznego półtrwania 10-15 godzin, czynnik IX około 24 godzin, stąd w dawkowaniu czynnika IX podaje się go raz na dobę, a w celu utrzymania prawidłowego stężenia czynnika VIII połowę dawki początkowej podaje się co 12 godzin.
- Profilaktyka krwawień dostawowych
- leczenie profilaktyczne po 3-4 krwawieniach do tego samego stawu w odstępach 1-4 tygodni lub przy braku powrotu stawu do stanu prawidłowego po wylewie
- VIII podaje się 3 razy w tygodniu w dawce 15-20 j./kg m.c., IX 2 razy w tygodniu w dawce 20 j./kg m.c., przez co najmniej 3 miesiące
- Postępowanie przy ostrym krwawieniu do stawu
- Krwawienie do stawu definiuje się jako epizod charakteryzujący się nagłą utratą zakresu ruchu i objawów: ból lub nieprzyjemne uczucie w stawie, wyczuwalny obrzęk i wzrost ciepłoty skóry nad stawem. Celem leczenia ostrego krwawienia do stawów jest jak najszybsze zatrzymanie krwawienia. Powinno to nastąpić, gdy tylko chory na hemofilię rozpozna pierwsze symptomy, a nie dopiero po wystąpieniu jawnego obrzęku i bólu. Chorego należy ocenić klinicznie. Zazwyczaj nie ma wskazań do RTG i USG.
- podanie stosownej dawki koncentratu VIII lub IX aby odpowiednio podnieść poziom czynnika
- unikanie obciążenia stawu i utrzymywanie go na lekkim podwyższeniu
- ewentualne unieruchomienie
- zimne okład z lodu (nie bezpośrednio na skórę) przez 15-20 minut co 4-6 godzin
- środki przeciwbólowe
- jeżeli krwawienie nie ustępuje może być potrzebne kolejne przetoczenie koncentratu
- rehabilitacja (po ustąpieniu bólu i obrzęku), a w przypadku fizjoterapeutów, którzy nie mają doświadczenia w pracy z pacjentami z hemofilią, wskazane jest prowadzenie ćwiczeń po uprzednim podaniu koncentratu czynnika
Postępowanie przy krwawieniu domięśniowym
Krwawienia do mięśni mogą wystąpić w każdym mięśniu. Zazwyczaj dzieje się to w wyniku urazu lub gwałtownego rozciągnięcia.
Objawami krwawienia do mięśnia są ból mięśnia, dyskomfort uniemożliwiający normalne utrzymanie kończyny, silny ból przy rozciąganiu mięśnia, ból przy aktywnym skurczu, napięcie, bolesność w badaniu palpacyjnym i możliwy obrzęk. Leczenie powinno to nastąpić, gdy chory na hemofilię rozpozna pierwsze symptomy, a nie dopiero gdy wystąpi obrzęk i ból.
Rozpoznaje się je klinicznie i/lub za pomocą badań obrazowych. Na ogół jest związany z bólem i/lub obrzękiem oraz z upośledzeniem funkcji (np. utykaniem). W przypadku krwawienia do mięśni biodrowo-lędźwiowych istnieje ryzyko porażenia nerwu skórnego bocznego uda, podudzia oraz nerwu udowego. W przypadku krwawienia do przednio-tylnego i głębokiej tylnej partii podudzia może wystąpić ryzyko urazu nerwu piszczelowego tylnego i głębokiego nerwu strzałkowego. W przypadku wylewu krwi do zginaczy mięśnia przedramienia - ryzyko niedokrwiennego przykurczu Volkmanna.
- podanie stosownej dawki koncentratu VIII lub IX aby odpowiednio podnieść poziom czynnika
- unikanie obciążenia i utrzymywanie kończyny na lekkim podwyższeniu
- ewentualne unieruchomienie
- zimne okład z lodu (nie bezpośrednio na skórę) przez 15-20 minut co 4-6 godzin
- środki przeciwbólowe
- wskazane są często wielokrotne podania czynnika krzepnięcia, przez 2–3 dni lub nawet dłużej (w przypadku krwawień mogących powodować zespół ciasnoty międzypowięziowej oraz jeżeli jest wymagana intensywna rehabilitacja).
- należy skontrolować poziom hemoglobiny ponieważ krwawienie do mięśnia może powodować znaczną utratę krwi
- rehabilitacja (po ustąpieniu bólu i obrzęku), a w przypadku fizjoterapeutów, którzy nie mają doświadczenia w pracy z pacjentami z hemofilią, wskazane jest prowadzenie ćwiczeń po uprzednim podaniu koncentratu czynnika
Krwawienia do centralnego układu nerwowego/ urazy głowy
- jest to stan zagrożenia życia i leczenie powinno być wdrożone przed przeprowadzeniem diagnostyki
- wszystkie urazy i obrażenia głowy lub podejrzane silne bóle głowy muszą być traktowane i leczone jako krwawienia wewnątrzczaszkowe
- nagły silny ból pleców może być związany z krwawieniem wokół rdzenia kręgowego
- nie wolno czekać na rozwój objawów lub wyniki badań laboratoryjnych i/lub radiologicznych
- natychmiast należy podać stosowną dawkę koncentratu czyniika VIII lub IX (50-80 j.m./dl)
- kolejne dawki zależą od wyników obrazowania (dawka podtrzymująca 20-40 j.m./dl)
- należy utrzymać poziom czynnika aż do ustalenia etiologii objawów
- jeśli krwawienie zostanie potwierdzone, należy utrzymać odpowiedni poziom czynnika przez 10–14 dni
- wymagana jest natychmiastowa ocena lekarza i hospitalizacja, gdzie należy wykonać tomografię komputerową lub rezonans magnetyczny oraz szybką konsultację neurologiczną
- Postępowanie przy przewlekłym zapaleniu błony maziowej stawu
- podawanie koncentratu VIII lub IX
- leki przeciwzapalne: Inhibitory cyklooksygenazy 2 (COX 2) – Celebrex, Aulin, Nimesil, Minesulin, Meloksikam, Aglan,Meloksam, Melobeks. Movalis, Opokan, Nabuton
- krótkotrwałe unieruchomienie
- rehabilitacja
- ewentualnie synowektomia
- Wskazania do synowektomii izotopowej
- dziecko z ciężka postacią hemofilii i nawracającymi kilkakrotnie w okresie 6 miesięcy wylewami krwi do tego samego stawu, mimo profilaktyki
- wiek > 8 roku życia
- Metoda
- używa się izotopu itru-90
- przed zabiegiem podaż koncentratu czynnika VIII/IX w dawce 40-50 j./kg m.c., potem dwie dawki po 30-40 j./kg m.c. co 8-12 godzin, czwarta dawka po 24 godzinach od ostatniego przetoczenia
- rehabilitacja w oddziale przez tydzień pod osłoną czynnika podawanego profilaktycznie co 48 h
- w razie nieskuteczności ponownie można wykonać po 12 miesiącach
- alternatywnie synowektomia chirurgiczna.
- Postępowanie przy leczeniu stomatologicznym
- leczenie ambulatoryjne
- ustalenie postępowania przez lekarza poradni skaz krwotocznych
- ekstrakcja po dożylnym podaniu koncentratu VIII/IX w dawce 20 j./kg m.c. i doustnym podaniu Exacylu w dawce 20 mg/kg m.c.
- ewentualnie zamiast czynnika podać desmopresynę (DDAVP) w dawce 0,3-0,4 μg/kg masy ciała
- zębodół po ekstrakcji zaopatrzyć spongostanem nasączonym trombiną
- Exacyl podawać przez 7 dni 4 razy dziennie
- u chorych z łagodnymi postaciami hemofilii można na zębodół po ekstrakcji zastosować klej tkankowy (Tachocomb, Beriplast, Tissucol) zamiast czynnika krzepnięcia albo desmopresyny.
- Postępowanie przy krwawieniu z nosa
- ucisnąć przegrodę nosa po stronie krwawienia na 5-10 minut
- jeśli krwawienie się utrzymuje, założyć spongostan nasączony trombiną lub solą fizjologiczną
- Exacyl w dawce 20 mg/kg m.c., 4 razy dziennie przez 5-7 dni
- jeśli krwawienie się utrzymuje, podać koncentrat VIII/IX.
- Postępowanie przy krwiomoczu
- zalecenie leżenia wraz z podażą zwiększonej ilości płynów doustnie
- diureza forsowana – podaż płynów w kroplówce 20-50 ml/kg m.c. z furosemidem w dawce 1 mg/kg m.c. i lekami rozkurczowymi
- VIII/IX w dawce 15-25 j./kg m.c., ewentualnie powtórzyć dawkę po kolejnych 24 godzinach
- w przypadkach opornych na leczenie encorton w dawce 1 mg/kg m.c./dobę przez 5-7 dni.
- Zasady szczepień dzieci chorych na hemofilię
- zgodnie z kalendarzem szczepień
- szczepionki podawane domięśniowo należy podawać podskórnie (np. Engerix B)
- każde dziecko chore na hemofilię niezaszczepione na WZW B, u którego nie stwierdza się antygenu HBs ani przeciwciał anty-HBs, powinno otrzymać szczepionkę Engerix B w trzech dawkach według schematu 0-1-6 miesięcy
- dawki przypominające co 5 lat
- zalecane jest szczepienie przeciw HAV szczepionką Havrix junior (720 j.) dzieci powyżej 1 roku życia
- Hemofilia nie jest przeciwwskazaniem do szczepienia przeciwko COVID-19
| Wymagana aktywność czynnika VIII | Dawkowanie | Wymagana aktywność czynnika IX | Dawkowanie | |
| Wylew do stawu | 20-30% | 10-15 j. | 15-20% | 15-20 j.×1 lub co 24 h |
| Wylew do mięśni | ||||
| Krwotok z nosa | ||||
| Krwiomocz | ||||
| Krwotok do dna jamy ustnej | 40-50% | 20-25 j. | 30-40% | 30-40 j. co 12-24 h |
| Krwiaki uciskające nerwy i tętnice | ||||
| Krwawienie z przewodu pokarmowego | ||||
| Rozległe urazy | ||||
| Złamania | ||||
| Drobne zabiegi diagnostyczne i lecznicze | ||||
| Ekstrakcje zębów | 40-50% | 40-50 j.×1 | ||
| Krwawienie śródczaszkowe | 80-100% | 40-50 j. | 50-80% | 50-80 j. co 12-24 h |
| Krwiak zaotrzewnowy | ||||
| Zabiegi operacyjne |
W zależności od postaci hemofilii leczenie może przebiegać profilaktycznie bądź objawowo. Leczenie profilaktyczne (zapobiegawcze) polega na okresowym, powtarzanym uzupełnieniu brakującego czynnika krzepnięcia (dożylnie). Leczenie objawowe polega na podawaniu dawek czynnika jedynie w przypadku wystąpienia krwawienia i ma na celu jego zatrzymanie.
Niektóre leki takie jak kwas acetylosalicylowy i sulfonamidy nasilają krwawienia i są przeciwwskazane. Z oczywistych względów nie wolno też podawać żadnych leków przeciwzakrzepowych (heparyna).
Najczęściej występującymi powikłaniami są postępujące zmiany zwyrodnieniowe (artropatia hemofilowa) na skutek długotrwałych, nawracających wylewów dostawowych.
Leczenie profilaktyczne prowadzone jest dwa razy w tygodniu w przypadku hemofilii B lub trzy razy w tygodniu w przypadku hemofilii A. Podawanie leku chroni stawy dzieci przed uszkodzeniami i późniejszym inwalidztwem.
W łagodnych postaciach hemofilii A lekiem z wyboru jest pochodna wazopresyny (DDAVP), uwalniająca czynnik VIII z rezerwy tkankowej jaką są komórki śródbłonka. Po podaniu DDAVP stężenie czynnika VIII wzrasta w osoczu 2-4 razy w ciągu 2-4 godzin. PO 3-4 dniach leczenia DDAVP należy się spodziewać zjawiska tachyfilaksji.
Krążący inhibitor czynnika VIII
Powikłaniem leczenia koncentratem czynnika VIII (rzadziej IX) jest wytworzenie przeciwciał skierowanych przeciwko temu białku. Dotyczy to 15-20% leczonych pacjentów. Leczenie wymaga wtedy odpowiedniej korekty,po określeniu poziomu inhibitora (w jednostkach Bethesda, j.B.).
| Poziom inhibitora (j.B.) | Leczenie |
|---|---|
| <5 | 2-3 razy wyższe dawki koncentratu VIII/IX |
| 5-50 | Koncentrat świńskiego czynnika VIII w dawce 50 j./kg masy ciała Nieaktywowane koncentraty zespołu protrombiny 50-75 j./kg Aktywowane koncentraty zespołu protrombiny (FEIBA) Rekombinowany aktywowany czynnik VII (rFVIIa) |
| >50 | Aktywowane koncentraty zespołu protrombiny 50-75 j./kg co 8-24 godziny Nieaktywowane koncentraty zespołu protrombiny 50-75 j./kg co 8-24 godziny Rekombinowany aktywowany czynnik VII (rFVIIa) |
Historia
Najstarsze wzmianki o hemofilii znajdują się w księgach Starego Testamentu i na papirusach pochodzących ze starożytnego Egiptu. Pisemne opisy chorych z objawami skazy krwotocznej, prawdopodobnie hemofilii, zawarte są w Talmudzie, w którym przedstawiono przypadki śmiertelnego wykrwawienia obrzezanych chłopców. Te relacje pochodzą mniej więcej z roku 140 n.e. Najstarszy opis hemofilii na obszarze europejskim wyszedł spod pióra arabskiego lekarza i autora podręcznika chirurgii Khalaf ibn Abbasa, znanego także jako Albucasis z Kordoby, już w XI wieku.
Królowa Wiktoria przekazała mutację swojemu synowi Leopoldowi oraz swoim córkom: Alicji i Beatrycze (nosicielki genu hemofilii), co zapoczątkowało "epidemię" hemofilii wśród członków rodów królewskich w całej Europie: w Hiszpanii, Niemczech i Rosji. Stąd też hemofilię nazywa się często "chorobą królów".
Uważa się, że Wiktoria posiadała mutację de novo, ponieważ sama nie chorowała (nosicielka), podobnie jak jej matka. Ojciec Wiktorii, Edward, książę Kentu, nie miał hemofilii, co niemal jednoznacznie wskazuje na mutację od linii królowej Wiktorii prawdopodobnie od roku 1818.
Hemofilia wywarła także wielki wpływ na losy carskiej Rosji – a przez to na losy całej Europy. Syn ostatniego cara, a jednocześnie prawnuk królowej Wiktorii (carewicz Aleksiej), był hemofilikiem – a wówczas nie istniały skuteczne leki na tę dolegliwość. Jedną z przyczyn pojawienia się Rasputina na dworze carskim była jego obietnica, że będzie w stanie uzdrowić Aleksego.
W decydującej chwili car Mikołaj zdecydował się (wbrew woli parlamentu) abdykować na rzecz swojego brata (a nie syna) – ponieważ obawiał się, że Aleksy nie będzie w stanie znieść ciężaru władzy. Brat cara z kolei nie był zainteresowany przejęciem władzy, co doprowadziło do pogłębienia kryzysu i w konsekwencji przyspieszyło wybuch rewolucji.
Choroba natomiast przeniosła się dalej poprzez:
-
księżniczkę Alicję, która jako nosicielka przekazała gen swoim dzieciom:
- księżnej Irenie, która przekazała go dalej swoim synom: Waldemarowi i Henrykowi
- księciu Fryderykowi (1870-1873)
- carycy Aleksandrze Fiodorownej, która przekazała chorobę tylko jednemu synowi: Aleksejowi. Jego hemofilia była jednym z czynników przyczyniających się do upadku Imperium Rosyjskiego w trakcie Rewolucji w 1917 roku. Jedną z córek Aleksandry, Marię, uważa się za nosicielkę hemofilii, gdyż w trakcie usunięcia migdałków obficie krwawiła
- być może wielkiej księżnej Elżbiecie Fiodorownej (starszej siostrze Aleksandry oraz żonie stryja cara Mikołaja II), była bezdzietna
- być może księżniczce Marii zw. May (1874-1878), lecz nie wiadomo czy była nosicielką, gdyż zmarła w dzieciństwie na błonicę
- księcia Leopolda (1853-1884) – cierpiącego na hemofilię (jeden z nielicznych chorujących na hemofilię w tamtych czasach, którzy sami mieli dzieci), który przekazał chorobę swojej córce, Alicji, która to z kolei przekazała ją swojemu najstarszemu synowi, Rupertowi. Młodszy syn, Maurice, zmarł w szóstym miesiącu życia, przy czym okoliczności śmierci każą podejrzewać hemofilię.
-
księżniczkę Beatrycze, która przekazała chorobę synom: Leopoldowi (1889-1922) i Mauricemu, a jej córka Wiktoria Eugenia była nosicielką hemofilii.
- książę Leopold zmarł 22 kwietnia 1922 roku w wieku 31 lat. Wykrwawił się po operacji odbarczającej pęknięty wyrostek robaczkowy.
- książę Maurice hemofilię przechodził stosunkowo lekko, dlatego służył w wojsku. Został raniony 27 października 1914 roku w Ypern i zmarł z upływu krwi, zanim przewieziono go do szpitala.
- królowa Wiktoria Eugenia, która przekazała hemofilię synom: Alfonsowi, księciu Asturii oraz Gonzalowi. Jej dwie córki, Beatrycze i Maria Cristina mogły być nosicielkami, jednak żaden z ich potomków nie choruje (aż do 2004).
Hemofilia w literaturze pięknej
Trudności życia z hemofilią w Polsce przedstawione są w książce Anny Łaciny Czynnik miłości. Autorka przedstawia ponadto krytycznie wybrane stereotypy dotyczące hemofilii.
Stowarzyszenia chorych
Stowarzyszenia chorych na hemofilię w Polsce:
- Polskie Stowarzyszenie Chorych na Hemofilię
Polskie Stowarzyszenie Chorych na Hemofilię powstało w 1988 roku. Koła terenowe Polskiego Stowarzyszenia Chorych na Hemofilię istnieją w takich miastach jak: Gdynia, Kalisz, Katowice, Kraków, Lublin, Łódź, Olsztyn, Wysokie Mazowieckie (woj. Podlaskie), Bydgoszcz, Poznań, Rzeszów, Szczecin, Warszawa, Wrocław.
Polskie Stowarzyszenie Chorych na Hemofilię zrzesza większość chorych na hemofilię w Polsce. PSCH jest członkiem europejskiej organizacji chorych na hemofilię - European Haemophilia Consortium i agendy WHO ds. hemofilii i pokrewnych skaz krwotocznych World Federation Hemophilia (WFH). Celem Stowarzyszenia jest pomoc chorym na hemofilię i inne wrodzone skazy krwotoczne, bez względu na przynależność tych osób do stowarzyszenia, w szczególności w zakresie opieki medycznej, rehabilitacji, pomocy socjalnej i pomocy prawnej. PSCH otrzymało Honorową Nagrodę Zaufania "Złoty Otis" dla organizacji Pacjentów, Nagrodę Advocacy Recognition Award, Order św. Stanisława I Klasy, a jego niektórzy członkowie zostali odznaczeni między innymi: Krzyżem Komandorskim Orderu Św. Stanisława, Nagrodą Prezydenta Światowego Kongresu World Federation of Hemophilia, czy zostali Kawalerami Orderu Uśmiechu.
Bibliografia
- Pediatria. Podręcznik do Państwowego Egzaminu Lekarskiego i egzaminu specjalizacyjnego. Anna Dobrzańska, Józef Ryżko (red.). Wrocław: Urban&Partner, 2005, s. 601-602. ISBN 83-89581-25-6.
- Andrzej Szczeklik (red.): Choroby wewnętrzne, tom II. Wydawnictwo Medycyna Praktyczna, 2005, s. 1571-1575. ISBN 83-7430-069-8.
- Podstawy hematologii. Anna Dmoszyńska, Tadeusz Robak. Lublin: Wydawnictwo Czelej, 2003, s. 374-382. ISBN 83-88063-94-4.
- Wytyczne leczenia Hemofilii (WFH Guidelines for the Management of Hemophilia) ISBN 978-83-911231-9-5