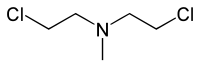
Iperyty azotowe
Iperyty azotowe (HN) – organiczne związki chemiczne, chlorowcopochodne amin alifatycznych o budowie i toksyczności zbliżonej do iperytu siarkowego. Są zaliczane do parzących bojowych środków trujących, jednak nie zostały one nigdy użyte w walce, a obecnie prawdopodobieństwo ich użycia przez wojsko lub terrorystów jest znikome.
Iperytami azotowymi są nazywane przeważnie trzy związki, znajdujące się w wykazie 1. Konwencji o zakazie broni chemicznej:
- bis(2-chloroetylo)etyloamina (HN-1)
- bis(2-chloroetylo)metyloamina (HN-2; chlorometyna, mechloroetamina)
- tris(2-chloroetylo)amina (HN-3; trichlorometyna)
Czwartym iperytem azotowym jest tris(2-chlorobutylo)amina (HN-4), która, jak i wiele pozostałych związków z tej grupy, jest mało znana i rzadko wymieniana w literaturze.
Dawniej w polskiej literaturze specjalistycznej iperyty azotowe były czasem nazywane „azotoiperytami”.
Historia
W latach 20. i 30. XX wieku iperyty azotowe stosowano w czeskich i niemieckich zakładach farmaceutycznych do otrzymywania czwartorzędowych związków amoniowych. W 1922 Laboratorium Toksykologiczne Uniwersytetu Chicagowskiego przebadało ponad 1500 nowych związków, z których 15 wybrano do dalszych badań – były wśród nich iperyty azotowe. W 1935 Kyle Ward opublikował pracę, w której opisał parzące działanie tych związków. Chemical Warfare Service przeprowadziło przed II wojną światową badania iperytów azotowych, z których wynikało jednak, że odznaczają się słabszym działaniem parzącym od iperytu siarkowego.
Z początkiem wojny o zainteresowaniu III Rzeszy iperytami azotowymi dowiedział się wywiad aliancki. Chemical Warfare Service, National Defense Research Committee i brytyjskie laboratoria rozpoczęły szersze badania nad tymi związkami i wybrały trzy z nich (HN-1, HN-2, HN-3) jako najbardziej odpowiednie do użycia bojowego. Wielka Brytania skoncentrowała się na HN-2 i HN-3, natomiast Stany Zjednoczone na HN-1. W 1942 w Edgewood Arsenal zbudowano niewielką instalację pilotażową, a uzyskane dzięki niej dane pozwoliły na otwarcie w 1943 w Pine Bluff Arsenal zakładu zdolnego do produkcji 1 tony HN-1 dziennie. Przez cztery następne miesiące zakład ten wyprodukował około 100 ton iperytu, głównie w celu zmylenia wywiadu niemieckiego, po czym został zamknięty. Badania nad iperytami azotowymi prowadzono także w ZSRR.
Jednocześnie, od 1942, Louis Goodman i Alfred Gilman (z Wydziału Farmakologicznego Uniwersytetu Yale) badali iperyty azotowe pod względem możliwości ich wykorzystania w leczeniu nowotworów. Z końcem roku chlorometyna została podana pierwszemu pacjentowi z mięsakiem limfatycznym, u którego po miesiącu leczenia zaobserwowano całkowite ustąpienie choroby. Pomimo późniejszego nawrotu nowotworu chlorometyna stała się pierwszym lekiem cytostatycznym stosowanym w chemioterapii i dała początek serii leków stosowanych do czasów obecnych.
W III Rzeszy wyprodukowano łącznie, przez całą II wojnę światową, około 2000 ton HN-3, który służył do wypełniania artyleryjskich pocisków chemicznych 105 i 150 mm oraz pocisków odrzutowych 150 mm. Po klęsce nazistów wyprodukowany przez nich iperyt azotowy został niemal całkowicie zniszczony przez aliantów, jednak 2700 niemieckich rakiet, wypełnionych HN-3, przetransportowano drogą morską do Stanów Zjednoczonych.
Po 1945 niewiele krajów badało lub produkowało iperyty azotowe do celów militarnych, głównie z tego powodu, że iperyt siarkowy okazał się równie łatwy w produkcji i skuteczniejszy. Pozostałe zapasy tych środków były niszczone, m.in. poprzez zatapianie. Przykładami tego typu działań było zatopienie iperytu azotowego wraz z luizytem z Sunny Point Naval Pier w marcu i z Concord Naval Weapons Station w maju 1958.
Przed rozpadem Jugosławii w 1991 Jugosłowiańska Armia Ludowa, oprócz produkcji m.in. iperytu siarkowego, sarinu, BZ, CS i chloroacetofenonu, przypuszczalnie eksperymentowała z iperytami azotowymi. Według raportu Defence Intelligence Staff również wojsko irackie w latach 90. prawdopodobnie miało możliwość produkcji iperytu azotowego. Obecnie nie są znane żadne informacje sugerujące, aby iperyty azotowe znajdowały się w posiadaniu jakiegokolwiek państwa lub ugrupowania terrorystycznego.
Właściwości
Iperyty azotowe są mniej trwałe (od 3 dni do tygodnia w lecie i do kilku tygodni w zimie) i mają słabszy zapach (opisywany zazwyczaj jako rybi) od iperytu siarkowego, jednak mogą być stosowane w niższych temperaturach. W stanie czystym iperyty azotowe są bezbarwnymi oleistymi cieczami, które z czasem żółkną, a następnie brązowieją. Hydrolizują z wytworzeniem odpowiednich aminoalkoholi. Alkalia przyśpieszają tę reakcję.
Pod ciśnieniem atmosferycznym rozkładają się przed osiągnięciem przewidywanej temperatury wrzenia na stabilne produkty. Są słabo rozpuszczalne w wodzie, dobrze w rozpuszczalnikach organicznych. Z kwasami łatwo tworzą sole.
Działanie
| Metoda | HN-1 | HN-2 | HN-3 |
|---|---|---|---|
| LCt50 (inhalacja) | 1500 | 3000 | 1500 |
| LCt50 (skóra) | 20 000 | brak danych | 10 000 |
| ICt50 (skóra) | 9000 | 6000–9500 | 2500 |
Pomimo pewnych różnic pomiędzy iperytami azotowymi a iperytem siarkowym, ogólny mechanizm działania i objawy wynikające z narażenia są bardzo podobne. Zbliżone mechanizmy działania, a zwłaszcza zdolność do niszczenia komórek, sugerowały, że iperyty azotowe mogą być potencjalnymi lekami przeciwnowotworowymi. Badania wykazały zmniejszanie się guzów nowotworowych po terapii chlorometyną (HN-2), która stała się niegdyś jednym z najskuteczniejszych leków przeciwnowotworowych. Była stosowana przez wiele lat, jednak z czasem została wyparta przez mniej toksyczne i skuteczniejsze leki. Istotnym czynnikiem było też przygotowanie preparatu do podania dożylnego pacjentowi, które było kłopotliwe z uwagi na ryzyko poparzeń u personelu przygotowującego lek, gdyż chlorometyna była stabilna jedynie w postaci suchej.
Toksykokinetyka
Wchłanianie
Iperyty azotowe mogą przedostać się do organizmu głównie poprzez absorpcję przez skórę oraz błony śluzowe dróg oddechowych i oczu.
Badania wpływu czasu narażenia, temperatury i wilgotności na absorpcję par dwóch iperytów azotowych – HN-1 i HN-3 – wykazały podobieństwo do iperytu siarkowego, m.in. zwiększoną absorpcję przy wzroście temperatury i wilgotności. Stwierdzono, że wchłanianie tych związków przez skórę liniowo wzrasta z upływem czasu (5–20 min dla HN-1, 30–60 min dla HN-3).
Wyznaczone współczynniki penetracji skóry wynoszą:
- dla HN-1 – 0,8 mg/cm²/min w temperaturze 21,7–22,2 °C i przy wilgotności względnej 50–52%
- dla HN-3 – 0,18 mg/cm²/min w 22,2–22,8 °C i przy wilgotności 45–48%.
Wzrost temperatury powoduje szybsze wchłanianie – w temperaturze ok. 30 °C współczynniki penetracji wynoszą:
- 5,2 mg/cm²/min (30–30,6 °C, 47–49%) dla HN-1
- 0,3 mg/cm²/min (29,4 °C, 47–48%) dla HN-3.
Metabolizm i wydalanie
Większość danych dotyczących metabolizmu iperytów azotowych dotyczy HN-2, z uwagi na jego przeszłe stosowanie jako leku cytostatycznego. W badaniach in vitro z użyciem HN-2 oraz homogenatów wątroby szczurów i królików stwierdzono, na podstawie tworzenia się formaldehydu, że główną drogą metabolizmu jest N-dealkilowanie (do 7% w 120 min). Występowała także utrata jednego z łańcuchów chloroetylowych. Nie stwierdzono metabolitów powstałych z iperytu azotowego sprzężonego z glutationem.
W środowisku wodnym iperyty azotowe hydrolizują, tworząc odpowiednie aminoalkohole, i w takiej postaci są wydalane z organizmu.
Toksykodynamika
Mechanizm działania
Zasadniczym czynnikiem toksyczności iperytów azotowych, zbliżonym do iperytu siarkowego, jest tworzenie cyklicznych jonów amoniowych w obecności rozpuszczalników polarnych, np. wody. Jony mogą reagować z nukleofilami, m.in. z azotem w zasadach azotowych kwasów nukleinowych i grupami tiolowymi w białkach i peptydach. Mechanizm działania iperytów azotowych nie został do tej pory ostatecznie wyjaśniony, jednak istnieje kilka hipotez, m.in. alkilowanie DNA lub RNA, niekorzystny wpływ na glutation, błony komórkowe (sieciowanie białek, zaburzenia transportu jonów) lub cytoplazmę (uwalnianie enzymów lizosomalnych). We wstępnych badaniach na myszach, którym podawano dootrzewnowo HN-2, zaobserwowano zmiany w płucach, wskazujące na stres oksydacyjny i zaburzenia procesów detoksykacji, co wskazuje na słuszność tych hipotez.
W badaniach in vitro HN-2 wiąże się kowalencyjnie z resztą Cys34 ludzkiej albuminy osocza krwi. Nie wykazano tego w badaniach in vivo, jednak tworzenie się podobnych adduktów z albuminą zaobserwowano u chorych na nowotwory, leczonych melfalanem i cyklofosfamidem. HN-2 alkiluje również reszty histydynowe hemoglobiny. Iperyt nor-azotowy reaguje z N-końcowymi cząsteczkami waliny w hemoglobinie.
Iperyty azotowe tworzą addukty z DNA. Alkilowanie DNA w wodzie prowadzi do powstania czterech głównych produktów powstałych w wyniku alkilowania guaniny w pozycji N7 i adeniny w pozycji N3 oraz sieciowania, w wyniku którego powstają dwa addukty między parami zasad – guanina–guanina i guanina–adenina.
Objawy
Iperyty azotowe działają na błony śluzowe oczu, nosa i dróg oddechowych w podobny sposób do działania iperytu siarkowego. Są mniej toksyczne dla skóry niż iperyt siarkowy, jednak działają szybciej na oczy. W przeciwieństwie do iperytu siarkowego, istnieje niewiele informacji o śmiertelności zwierząt wskutek narażania na te związki.
Iperyty azotowe powodują oparzenia skóry i dróg oddechowych oraz uszkodzenia oczu. Na podstawie badań przeprowadzonych wśród ochotników uszeregowano trzy podstawowe iperyty azotowe (HN-1, HN-2 i HN-3) pod względem działania parzącego. Różnice były niewielkie, jednak najsilniejszym działaniem parzącym odznaczał się HN-3, a najsłabszym – HN-2. Wilgoć, także pot, nasilają objawy skórne. Uszkodzenia oczu w stopniu obezwładniającym pojawiają się przy znacznie słabszym narażeniu, niż to, które powoduje wystąpienie uszkodzeń skóry.
Przy narażeniu na iperyty azotowe okres utajenia wynosi od kilku godzin przy objawach ocznych do kilku dni przy oparzeniach.
Iperyty azotowe są środkami alkilującymi o potwierdzonej mutagenności. Badania na myszach i szczurach wykazały także teratogenność iperytów azotowych i ich chlorowodorków. Związki te przyczyniają się także do powstawania u tych zwierząt nowotworów, głównie raka płuc i chłoniaków, po podaniu podskórnym, dootrzewnowym i dożylnym, jak również poprzez absorpcję skórną. Dane o rakotwórczości u ludzi ograniczają się do informacji o powstawaniu raka kolczystokomórkowego skóry po terapeutycznym podaniu iperytu azotowego w leczeniu grzybicy, ziarniniaków i łuszczycy. Z tego też powodu, u osób leczonych iperytem azotowym występuje zwiększone ryzyko zachorowania na nowotwory, m.in. na przewlekłą białaczkę szpikową. Międzynarodowa Agencja Badań nad Rakiem uznaje iperyty azotowe za substancje grupy 2A, czyli prawdopodobnie rakotwórcze dla człowieka, opierając tę ocenę na ograniczonych danych o rakotwórczości u ludzi i dostatecznych – u zwierząt.
Pierwsza pomoc i leczenie
Nie istnieje odtrutka na zatrucie iperytami azotowymi. Poszkodowanego należy odciąć od źródła narażenia, a skażone części ciała natychmiast dekontaminować. Zatrucia można leczyć jedynie objawowo, a w razie potrzeby podtrzymywać funkcje życiowe. Stosowanie przeciwutleniaczy w terapii jest obecnie obiektem badań.
Pochodne
Skuteczność chlorometyny w terapii przeciwnowotworowej oraz jej wysoka toksyczność zmusiły do szukania mniej trujących leków. Obecnie niektóre pochodne iperytów azotowych, o znacznie mniejszej toksyczności, są z powodzeniem wykorzystywane w chemioterapii, a mechanizmy ich działania są analogiczne do iperytów azotowych.
Bibliografia
- Richard D.R.D. Albright Richard D.R.D., Cleanup of Chemical and Explosive Munitions: Locating, Identifying Contaminants, and Planning for Environmental Remediation of Land and Sea Military Ranges and Ordnance Dumpsites, William Andrew, 2008, ISBN 978-0-8155-1540-1 .
- Leo P.L.P. Brophy Leo P.L.P., Wyndham D.W.D. Miles Wyndham D.W.D., Rexmond C.R.C. Cochrane Rexmond C.R.C., The Chemical Warfare Service: From Laboratory to Field, seria United States Army in World War II. The Technical Services, Washington: Center of Military History. United States Army, 1988 .
- John R.J.R. Cashman John R.J.R., Emergence Response Handbook for Chemical and Biological Agents and Weapons, wyd. 2, Boca Raton: CRC Press, 2008, ISBN 978-1-4200-5265-7 .
- KimK. Coleman KimK., A History of Chemical Warfare, Palgrave Macmillan, 2005, ISBN 978-1-4039-3459-8 .
- Weapons of Mass Destruction. An Encyclopedia of Worldwide Policy, Technology, and History, Eric A.E.A. Croddy (red.), James J.J.J. Wirtz (red.), Jeffrey A.J.A. Larsen (red.), t. 1, Chemical and Biological Weapons, Santa Barbara: ABC-CLIO, 2005, ISBN 1-85109-495-4 .
- Handbook of Toxicology of Chemical Warfare Agents, Ramesh C.R.C. Gupta (red.), Elsevier, 2009, ISBN 978-0-12-374484-5 .
- Chemical Warfare Agents. Toxicology and Treatment, Timothy C.T.C. Marrs (red.), Robert L.R.L. Maynard (red.), Frederick R.F.R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, ISBN 978-0-470-01359-5 (ang.).
- Chemical Warfare Agents. Chemistry, Pharmacology, Toxicology, and Therapeutics, James A.J.A. Romano (red.), Brain J.B.J. Lukey (red.), HarryH. Salem (red.), wyd. 2, CRC Press, 2008, ISBN 978-1-4200-4661-8 .