Mifepriston
| |||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C29H35N1O2 |
||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
429,59 g/mol |
||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
żółty proszek |
||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria X |
||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Mifepriston (RU-486) – otrzymywany syntetycznie organiczny związek chemiczny z grupy steroidów, pochodna noretysteronu. Jest antagonistą receptora progesteronowego o działaniu poronnym w okresie pierwszych dwóch trymestrów ciąży. Stosowany w mniejszych dawkach służy jako środek do antykoncepcji doraźnej (przeznaczenie niezaaprobowane prawnie). Pierwotnie wytworzony w laboratorium firmy Roussel Uclaf, aktualnie znajduje się na licencji spółek Danco Laboratories (dystrybucja na terenie Stanów Zjednoczonych pod nazwą handlową Mifeprex), Exelgyn Laboratories (Europa i inne kontynenty, Mifegyne) i Nordic Drugs (Mifegyne). Z powodu wywieranego wpływu w większości krajów obrót jest ściśle monitorowany. W Polsce środek nie został dopuszczony do obrotu.
Aborcja farmakologiczna z zastosowaniem mifepristonu jest oceniana względnie bezpieczna alternatywa dla zabiegu ginekologicznego wobec kobiet przed 49 dniem ciąży (licząc od czasu ostatniej miesiączki), u których nie stwierdzono żadnych przeciwwskazań. Do najistotniejszych działań niepożądanych należą bóle brzucha, skurcze macicy i krwawienie z dróg rodnych.
Historia
W kwietniu 1980 roku chemik Georges Teutsch zsyntetyzował po raz pierwszy związek, oznaczony początkowo jako RU-486 (skrótowiec od Roussel-Uclaf, substancja nr 38 486). Pracował on w tym czasie nad rozwojem leków będących antagonistami receptora glukokortykoidowego (poszukiwanych w celu poprawy terapii m.in. zespołu Cushinga). Otrzymany produkt okazał się jednak znacznie silniej blokować działanie pokrewnych strukturalnie receptorów dla progesteronu. Endokrynolog Étienne-Émile Baulieu, konsultant firmy Roussel-Uclaf, zaproponował w październiku 1981 roku, aby sprawdzić jego skuteczność jako środka do wywoływania aborcji (do tej pory jedynym skutecznym i w miarę bezpiecznym rozwiązaniem pozostawały analogi prostaglandyn). Pierwsze próby przeprowadzono na 11 pacjentkach szpitala Uniwersytetu Genewskiego pod nadzorem ginekologa Waltera Herrmana. Sukces ogłoszono oficjalnie 19 kwietnia 1982 roku, równolegle w prasie codziennej i na łamach publikacji Francuskiej Akademii Nauk. 9 października 1987 rozpoczęły się ogólnoświatowe próby kliniczne mające na celu stwierdzenie przydatności oraz uchwycenie działań niepożądanych mifepristonu. Uczestniczyło w nich ponad 20 000 kobiet (poddających się aborcji), które otrzymywały mifepriston z jednym z dostępnych analogów prostaglandyn (początkowo sulproston i gemeprost, później mizoprostol). Na podstawie ich wyników środek zarejestrowano najpierw we Francji i Chińskiej Republice Ludowej (1988), potem również w innych krajach.
Decyzja ta od początku budziła sprzeciw stowarzyszeń pro-life. Swoje wątpliwości wyraził również sam koncern Hoechst AG (od 1999 roku Aventis, część późniejszej grupy Sanofi-Aventis), będący większościowym udziałowcem w Russel Uclaf. 21 października 1988 rada nadzorcza spółki przegłosowała (stosunkiem 16:4) zaniechanie dalszej produkcji specyfiku, co ogłoszono publicznie 26 października. Dwa dni później rząd Francji (gabinet Michela Rocarda z Partii Socjalistycznej) zażądał od Russel Uclaf wznowienia dystrybucji tego środka, powołując się na interes publiczny. Francuski minister zdrowia Claude Évin (PS) wyjaśniał: „Nie mogę pozwolić, aby dyskusja na temat aborcji miała pozbawić kobiety produktu będącego dowodem postępu w medycynie. Odkąd przyznano rządowe pozwolenie na obrót RU-486, jest on traktowany jako dobro należne wszystkim kobietom, a nie tylko własność producenta”. W okresie od kwietnia 1988 roku do lutego 1990 roku, 34 000 Francuzek skorzystało z darmowego dostępu do preparatu. Russel Uclaf uruchomił sprzedaż mifepristonu dla szpitali na normalnych warunkach ponownie w 1990 roku pod nazwą Mifegyne po cenie (wynegocjowanej z rządem Francji) 48 USD za dawkę 600 mg.
Mifegyne został następnie dopuszczony do użytku w Wielkiej Brytanii (1 lipca 1991) oraz w Szwecji (październik 1992). Przewodniczący Hoechst AG Wolfgang Hilger, praktykujący katolik, przeciwstawiał się dalszemu rozszerzaniu rynku zbytu aż do przejścia na emeryturę w kwietniu 1994 roku. W maju 1994 roku Russel-Uclaf poinformował o ofiarowaniu praw do preparatu na terenie USA organizacji pozarządowej Population Council, która udostępniła licencję Danco Laboratories LLC (rejestracja w 1995 roku w Nowym Jorku). Mifepriston (nazwa handlowa Mifeprex) jest jedynym produktem tej firmy. 28 września 2000 roku uzyskał on pozytywną opinię amerykańskiej Agencji Żywności i Leków (FDA). 8 kwietnia 1997 roku, po wykupieniu całości akcji Russel Uclaf, Hoechst AG ogłosił zaprzestanie dalszej produkcji i przekazanie praw do mifepristonu (Mifegyne; generował 3,44 mln USD z 30 mld USD obrotów spółki) poza terenem Stanów Zjednoczonych na rzecz Exelgyn S.A., spółki, której szefem pozostawał były dyrektor Roussel-Uclaf Edouard Sakiz. W 1999 roku Exelgyn wygrał dla swojego jedynego produktu prawa dystrybucji w 11 kolejnych krajach oraz 28 następnych na przestrzeni kolejnej dekady. W 2005 roku mifepriston razem z misoprostolem dopisano do Listy Leków Podstawowych WHO (ang. WHO Model Lists of Essential Medicines), a decyzję uzasadniając potrzebą niesienia pomocy kobietom z krajów rozwijających się, które nie mają dostępu do infrastruktury chirurgicznej. Ostatnimi krajami europejskimi, które wyraziły zgodę na dystrybucję mifepristonu, są Włochy, Portugalia i Rumunia (stan na 2009). Biskup Elio Sgreccia z Papieskiej Akademii Życia wyraził swoje ubolewanie z tego powodu i przypomniał, że aborcja farmakologiczna z użyciem mifepristonu jest w świetle wiary zabójstwem, a więc czynem, za który grozi ekskomunika.
Wskazania
Na terenie Wielkiej Brytanii mifepriston (rozprowadzany jako Mifegyne, Exelgyn Laboratories oraz Mifegynec, Nordic Drugs) może być przepisany z następujących wskazań:
- w kombinacji z mizoprostolem: zakończenie ciąży wewnątrzmacicznej do wieku 63 dni (poza Wielką Brytanią i Szwecją zwykle do 49 dni)
- w kombinacji z gemeprostem: zakończenie ciąży między 13 a 24 tygodniem (Wielka Brytania)
- rozszerzenie i zmniejszenie napięcia mięśniówki szyjki macicy przed mechaniczną ewakuacją płodu
- indukcja akcji porodowej w wypadku wewnątrzłonowej śmierci płodu.
W Stanach Zjednoczonych mifepriston – wytwarzany na terenie Chin i sprzedawany pod nazwą handlową Mifeprex przez Danco Laboratories – jest zarejestrowany przez Agencję Żywności i Leków (FDA) wyłącznie do przerywania ciąży wewnątrzmacicznej w wieku nieprzekraczającym 49 dni.
Postępowanie kliniczne
Zgodne ze wskazaniami – przerywanie ciąży
Sposób dawkowania zaakceptowany przez FDA polega na jednokrotnym podaniu 600 mg mifepristonu, po wcześniejszym odbyciu konsultacji lekarskiej. Dwa dni później kobieta otrzymuje 400 μg mizoprostolu w celu pobudzenia skurczów.
Proponowana metoda doprowadziła do skutecznej aborcji w 96–99% ciąż do 49. dnia. W pojedynczym amerykańskim badaniu wieloośrodkowym notowana skuteczność była niższa (92%), co autorzy przypisywali brakowi doświadczenia personelu na terenie USA (wrzesień 1994 – wrzesień 1995) oraz sposobowi przeprowadzenia samego eksperymentu. Sam mifepriston ma tylko umiarkowane działanie poronne. Mizoprostol może być przyjęty 24–72 h po mifepristonie, dając zbliżony efekt. Forma dopochwowa ma przewagę nad doustną i w takim układzie jest skuteczny do 63 dnia ciąży.
W Europie i Chinach po przyjęciu mizoprostolu kobieta pozostaje pod obserwacją kliniczną jeszcze przez okres kilku godzin (w USA jest ona tylko zalecana). Po wydaleniu szczątków sprawdzana jest całkowitość zabiegu. Jeżeli nie nastąpi wydalenie tkanek martwego płodu w tym czasie, badanie ginekologiczne może stwierdzić stopień zaawansowania procesu przed otrzymaniem wypisu. Kolejny raz pacjentka przychodzi 1–2 tygodnie później. Wówczas następuje kolejne badanie fizykalne, ewentualnie razem z USG. Przy stwierdzeniu niepowodzenia oferowana jest aborcja chirurgiczna. Wiek ciąży był najlepszym pojedynczym czynnikiem prognozującym ewentualne niepowodzenia w wywoływaniu aborcji.
Wytyczne brytyjskiego Royal College of Obstetricians and Gynaecologists zawierają m.in. następujące zalecenia:
- wszystkie metody przerywania ciąży w pierwszym trymestrze niosą za sobą małe ryzyko porażki, która wymusza usunięcie płodu zabiegiem chirurgicznym
- ryzyko powikłań dla różnych sposobów farmakologicznych waha się między 0,1 a 1,4%; w wypadku aborcji chirurgicznej wynosi ok. 0,23%
- aborcja farmakologiczna z użyciem mifepristonu i prostaglandyny jest rozwiązaniem najbardziej skutecznym do 7 tygodnia ciąży (czyli 49 dnia)
- między 7. a 9. tygodniem ciąży zastosowanie mifepristonu i prostaglandyny będzie nadal właściwą metodą.
Szczegółowe schematy dawkowania są dostępne zarówno w krajowych wytycznych, jak i w publikacjach z serii British National Formulary.
Mifepriston jest również skuteczny w wypadku stwierdzonej wcześniej patologii ciąży. Chociaż w wypadku pustego jaja płodowego lub wewnątrzmacicznej śmierci płodu zwykle preferuje się interwencję chirurgiczną, można dokonać wcześniejszej próby aborcji farmakologicznej. W kombinacji z prostaglandynami osiągano wówczas zadowalające rezultaty. Zmniejszenie napięcia mięśniówki szyjki macicy ułatwia też użycie narzędzi mechanicznych. Sposób nie jest zalecany przy poronieniu częściowym spontanicznym.
Zastosowania off-label
Antykoncepcja
Mifepriston może być również użyty jako środek do antykoncepcji awaryjnej (ang. emergency contraception). Zastosowany po stosunku, ale przed rozpoczęciem owulacji, jest w stanie jej zapobiec i w ten sposób nie dopuścić do zapłodnienia. Dawka 10 mg nie jest tak skuteczna jak 600 mg, ale ma mniej działań niepożądanych. Należy zwrócić uwagę, że zarówno Mifeprex jak i Mifegyne są dostępne tylko w postaci tabletek po 200 mg. Dawki tego rzędu nie tylko zaburzają jajeczkowanie, lecz również zmieniają stopień ekspresji receptorów steroidowych we wnętrzu jajowodu, zapobiegają zmianom endometrium i skutecznie blokują implantację zarodka. Dość wysoki koszt i brak na rynku optymalnej dawki są przyczyną braku rejestracji tego wskazania.
Główną obawą przy długotrwałym stosowaniu mifepristonu jest możliwość wywierania niezrównoważonego wpływu przez estrogeny. Problem zostanie najpewniej rozwiązany uzyskaniem związków o bardziej pożądanych właściwościach.
Stosowany systematycznie jako środek antykoncepcyjny zapobiega owulacji w dawce 2 mg (ilość 1 mg jest nieskuteczna). Pojedyncza dawka 10 mg potrafi opóźnić jajeczkowanie o 3–4 dni i jest równie dobrym środkiem antykoncepcji doraźnej jak 1,5 mg lewonorgestrelu (sztuczny gestagen). Inne badania również wykazywały zbliżoną skuteczność, podobne działania niepożądane oraz uzyskały akceptację ze strony pacjentek.
Inną metodą antykoncepcji jest wymuszenie menstruacji po 27 dniu cyklu miesiączkowego (zdecydowanie dłuższy odstęp od momentu zapłodnienia niż w wypadku standardowych metod). Z 62 osób leczonych w ten sposób (600 mg mifepristonu) w ciążę zaszła jedna kobieta.
Pozostałe
W drugiej fazie badań klinicznych sprawdzano przydatność mifepristonu jako doustnego środka antykoncepcyjnego do długotrwałego stosowania oraz jako leku w terapii mięśniaków macicy, endometriozy, ciężkiej depresji z objawami psychotycznymi (według klasyfikacji ICD-10 podtyp F33.3), jaskry, oponiaków, raka piersi, raka jajników i raka prostaty. Długotrwałe (ponad 10 lat) podawanie środka pacjentom z zespołem Cushinga nie wiązało się dotąd z żadnymi działaniami niepożądanymi. Z uwagi na oddziaływanie in vivo z białkiem regulatorowym vpr wirusa HIV próbowano włączyć go jako element terapii antyretrowirusowej. W badaniach klinicznych nie zademonstrowano jednak żadnej dodatkowej korzyści. Aktualnie bada się przydatność mifepristonu w leczeniu przewlekłej choroby wieloobjawowej (ang. chronic multisymptom illness, CMI; termin zbliżony znaczeniowo do „syndromu Zatoki Perskiej”, według klasyfikacji ICD-10 jest tylko stanem lękowym). Środek nie został dopuszczony przez FDA wobec żadnego z powyższych wskazań. Dość obiecujące są perspektywy zastosowania mifepristonu do terapii depresji psychotycznej, formy depresji opornej na normalne leczenie. Pierwsze badanie z użyciem podwójnie ślepej próby przyniosło wyraźne efekty, jednak opierało się na niewielkiej liczbie pacjentów oraz krótkim czasie obserwacji.
Przy leczeniu endometriozy dawkowanie wynosiło 25–100 mg/dzień. Dawki powyżej 50 mg powodowały zmniejszenie dolegliwości bólowych i w 55% wiązały się z częściowym zanikiem zmian, bez znaczących efektów ubocznych. Mniejsze ilości mogą nie wpływać na przebieg choroby.
W przemyśle biotechnologicznym mechanizm wiązania się mifepristonu z receptorem progesteronowym posłużył za podstawę do opracowania indukowanego systemu ekspresji genów GeneSwitch. Wprowadzany do organizmu w formie plazmidu, ma on wzmagać ekspresję insuliny, erytropoetyny, hormonu wzrostu, itp. Mifepriston (w bardzo niskich stężeniach) odgrywa rolę sygnału, niezbędnego do podtrzymania produkcji – przy zaprzestaniu jego stosowania proces ustaje.
Przeciwwskazania
Zgodnie z zaleceniami, Mifepriston jest przeciwwskazany kobiecie, u której minęło więcej niż 70 dni od pierwszego dnia ostatniej miesiączki, a także kobiecie, która:
- ma założoną wkładkę domaciczną (ang. intrauterine device, IUD);
- ma ciążę pozamaciczną;
- cierpi na niewydolność nerek;
- ma skazę krwotoczną;
- cierpi na dziedziczną porfirię;
- ma problemy z krwawieniem lub stosuje leki przeciwkrzepliwe;
- przyjmuje kortykosterydy;
- ma reakcję alergiczną na mifepriston, misoprostol lub podobne preparaty .
W informacjach na temat działania tego środka amerykańska Agencja Żywności i Leków (FDA) zaznacza, że nie do końca poznany jest wpływ na osoby cierpiące z powodu chorób przewlekłych, będące powyżej 35. roku życia oraz palących ponad 10 papierosów dziennie. Grupy te były systematyczne wykluczane z badań klinicznych i powinny być traktowane ze szczególną ostrożnością.
Działania niepożądane
Stwierdzone u ludzi
Producent opublikował dane na temat działań niepożądanych zaobserwowanych u pierwszych 80 000 kobiet, które otrzymały specyfik; stwierdzono 139 komplikacji. Według komunikatu ACOG z 2004 roku odsetek zgonów związanych z zażyciem RU-486 wynosi 0,8 na 100 000 wykonanych procedur. Liczbę tę powinno się przyrównać do śmiertelności po poronieniu spontanicznym (1 na 100 000), po przyjęciu dożylnie penicyliny (2 na 100 000) oraz okołoporodowej (12 na 100 000).
W ciągu prób klinicznych prawie wszystkie pacjentki, którym podano mifepriston, doświadczały bólów brzucha, skurczów macicy oraz pokrwawiania lub plamienia z pochwy przez 9–16 dni. U 8% badanych okres krwawienia przedłużał się ponad 1 miesiąc. W 0,1% przypadków z powodu krwawienia trzeba było przeprowadzić transfuzję. Krwawienia nie występowały przy przewlekłym (eksperymentalnym) stosowaniu preparatu przeciwko mięśniakom macicy; znowu w badaniu innej grupy kobiet dwukrotnie zanotowano ciężki krwotok.
Do rzadziej spotykanych działań niepożądanych zaliczyć można nudności, wymioty, biegunkę, zawroty głowy, zmęczenie i gorączkę. Jednym ze sporadycznie spotykanych, ale poważnych stanów, jest zapalenie narządów miednicy. Dotychczas nie przeprowadzono długoterminowych prób, które mogłyby stwierdzić rakotwórcze działanie mifepristonu. Zmiany w poziomach enzymów wątrobowych podczas stosowania mifepristonu były niewielkie i nie spełniały kryteriów diagnostycznych uszkodzenia narządu. Odsetek wad wrodzonych u dzieci, które były narażone na działanie mifepristonu i mizoprostolu w czasie ciąży jest bardzo niski. Nie da się też określić, który składnik terapii byłby za nie odpowiedzialny.
W wypadku nadmiernego krwawienia lub niekompletnego poronienia wymagana jest interwencja lekarska (np. aspiracja próżniowa). Podczas prób klinicznych pomocy chirurgicznej (z różnych przyczyn) wymagało łącznie od 4,5 do 7,9% pacjentek.
Zmiany histopatologiczne
Badania histopatologiczne endometrium, wykonywane u kobiet stosujących mifepriston, były przedmiotem nieporozumień. W dużym odsetku (28%) preparatów była opisywana hiperplazja; po konsultacji w ośrodkach referencyjnych ilość rozpoznań spadła do 14%. Prace przeprowadzone pod patronatem Narodowych Instytutów Zdrowia (NIH) stwierdziły, że powstałe zmiany nie są konsekwencją wzrostu aktywności mitotycznej (co pokrywa się z wynikami badań farmakologicznych). Brak również śladów atypii. Ostatecznie zaobserwowana budowa histologiczna (torbielowato poszerzone gruczoły, asymetryczny wzrost podścieliska i nabłonka) została sklasyfikowana jako odrębna jednostka (ang. PRM-associated endometrial changes). Niektóre raporty mówią dodatkowo o wykrywalnym za pomocą USG pogrubieniu ściany endometrium.
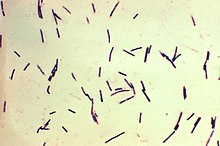
Zakażenia C. sordellii i C. perfringens
Clostridium sordellii to Gram-dodatnia laseczka, kolonizująca drogi rodne u 0,5–10% kobiet. Bywa ona sporadycznie przyczyną poważnych zakażeń podczas zabiegów ginekologicznych i położniczych . Clostridium perfringens, należąca do tego samego rodzaju, jest powszechnie znana jako laseczka zgorzeli gazowej. Toksyny przez nią wydzielane to przyczyna procesu gangreny toczącego się w zanieczyszczonych ranach. Obie są ścisłymi beztlenowcami wytwarzającymi spory.
Kilka (6–8) przypadków sepsy spowodowanej tymi gatunkami było odnotowanych po procedurze aborcji farmakologicznej na terenie Stanów Zjednoczonych i Kanadzie w latach 2000–2010. Cytowane zgłoszenia, chociaż niepokojące, nie były przyczyną prób wycofywania środka, gdyż ogólna śmiertelność związana z zastosowaniem tabletek wczesnoporonnych jest mimo to niska. Należy zauważyć jednak, że pojedynczy przypadek wykryty podczas kanadyjskich badań klinicznych przyczynił się do zaniechania jego rejestracji.
Na razie brak dowodu, który mógłby wykazać, że bezpośrednią przyczyną tych infekcji były zastosowane środki. Na temat możliwej patogenezy istnieją różne przypuszczenia:
- zwiększenie światła szyjki macicy ułatwia zakażenie drogą wstępującą
- przejściowa blokada receptorów dla glikokortykoidów może upośledzać wydzielanie cytokin zapalnych
- zarówno mifepriston, jak i toksyny C. sordellii powodują brak przeciwwagi dla TNFα (ang. tumour necrosis factor alfa)
Brak zgłoszeń o zachorowaniach na terenie Europy może być związany z odmiennym wykonaniem procedury. Aplikacja dopochwowa mizoprostolu (drugiego składnika metody) jest mało rozpowszechniona – prostaglandyny podaje się zazwyczaj doustnie. W razie wykorzystania globulek dopochwowych osłonowo podaje się antybiotyk. Z powyższych względów również w USA zaczęto stosować zapobiegawczo antybiotykoterapię podczas wykonywania zabiegu; wiązało się to z ogólnym spadkiem ilości infekcji oraz całkowitym brakiem zakażeń C. sordellii. Ryzyko sepsy figuruje wśród ostrzeżeń wymienionych na ulotne załączanej do opakowania Mifeprexu.
Badane na zwierzętach
Badania przeprowadzone na zwierzętach w warunkach in vitro wskazują, że środek nie wywiera efektu genotoksycznego. Narażenie szczurzych noworodków na pojedynczą dużą dawkę specyfiku nie powodowało u nich żadnych zaburzeń reprodukcyjnych. Dopiero przewlekła aplikacja mniejszych ilości preparatu prowadziła do nieprawidłowości rozwojowych i zmniejszenia płodności. Testy teratologiczne z udziałem myszy, szczurów i królików dowiodły szkodliwego wpływu na zarodki królicze, ale nie pozostałych gryzoni.
Profil farmakologiczny
Budowa chemiczna
Mifepriston jest 19-nor-steroidem o dwóch istotnych podstawnikach:
- obszernej objętościowo grupie p-(dimetyloamino)fenylowej powyżej płaszczyzny cząsteczki w pozycji 11β, która sprzyja lub stabilizuje receptor w konformacji nieaktywnej;
- hydrofobowej grupie 1-propynylowej, poniżej wspomnianej płaszczyzny, w pozycji 17α, gdzie zwiększa siłę wiązania z receptorem.
Cząsteczką o zbliżonej strukturze i działaniu jest onapriston.
Farmakokinetyka
Mifepriston zachowuje aktywność po podaniu doustnym i cechuje go duża biodostępność. Szczytowe stężenie w osoczu przypada na kilka godzin po podaniu, po czym środek jest powoli usuwany z czasem półtrwania wynoszącym 20–40 godzin. W osoczu wiąże się z α-1 kwaśną glikoproteiną, co wpływa na długie utrzymywanie się związku we krwi. Wtórnymi metabolitami są mono- i didemetylowane pochodne (mogące mieć również efekt farmakologiczny), tworzone w reakcji katalizowanej przez CYP3A4. W mniejszym stopniu pojawiają się produkty hydroksylowane. Środek podlega metabolizmowi wątrobowemu i jest usuwany głównie razem z kałem.
Farmakodynamika
Progesteron oddziałuje na docelowe tkanki poprzez swój specyficzny receptor, należący do rodziny receptorów jądrowych. Białka te są aktywowanymi ligandem czynnikami transkrypcyjnymi, z domenami przeznaczonymi do wiązania się z DNA, hormonami oraz do transaktywacji. Receptor progesteronu istnieje w 3 izoformach (PR-A, PR-B i PR-C), które są kodowane przez jeden gen, transkrybowany z odmiennym wykorzystaniem sekwencji promotora. Badania prowadzone na myszach z knock-outem PR-A/PR-B wykazały, że PR-A jest niezbędny do utrzymania płodności, owulacji oraz zdolności macicy do przyjęcia zarodka, a także zapobiega proliferacyjnemu efektowi estrogenów. PR-B pośredniczy w rozwoju i dojrzewaniu gruczołów sutkowych. Stężenie PR-C zwiększa się w ciąży donoszonej. Łącząc się z PR-B i progesteronem zapobiega dalszemu przekazywaniu przez nich sygnału.
W obecności progesteronu mifepriston działa jako kompetencyjny antagonista receptora progesteronowego. Przy jego braku (głównie podczas prób in vitro) ujawnia się jego funkcja częściowego agonisty. Z PR łączy się bliżej N-końcowego fragmentu domeny wiążącej hormon. Mifepriston, oprócz bycia antagonistą progesteronu, wykazuje działanie antyglikokortykosteroidowe oraz antyandrogenowe. Cząsteczka preparatu wiąże się:
- z receptorem progesteronu ponad dwukrotnie silniej od naturalnego związku
- z receptorem kortykosteroidowym trzykrotnie silniej od deksametazonu i dziesięciokrotnie silniej od kortyzolu
- z receptorem androgenowym trzykrotnie słabiej od testosteronu
- nie oddziałuje z receptorami estrogenowymi i mineralokortykoidowymi
Działanie poronne mifepristonu jest skutkiem blokady receptora progesteronowego, która prowadzi do:
- bezpośredniej degeneracji doczesnej
- uszkodzenia naczyń endometrium, upośledzając przepływ krwi do zarodka
- zmniejszenia napięcia i rozszerzenia szyjki macicy (aktywacja MMP-2, aktywacja iNOS)
- uwolnienia endogennych prostaglandyn
- uczulenia myometrium na prostaglandyny, skutkujące zwiększeniem jego siły skurczowej
Zniszczenie doczesnej pośrednio przyczynia się do osłabienia przylegania trofoblastu. Syncytiotrofoblast przestaje produkować gonadotropinę kosmówkową (ang. human chorionic gonadotropin, hCG), która jest niezbędna do podtrzymania wydzielania progesteronu przez ciałko żółte. Podczas pierwszych 9 tygodni ciąży zarodek jest uzależniony od matczynej produkcji progesteronu przez ciałko żółte – później rolę tę przejmuje łożysko.
Późne efekty, uwidaczniające się przy długotrwałym stosowaniu preparatu (terapie eksperymentalne, na przykład. endometriozy; jako stały środek antykoncepcyjny):
- zmniejszenie aktywności proliferacyjnej endometrium
- wtórne zwiększenie ilości receptorów steroidowych dla estrogenu, progesteronu i androgenów (wywierających również wpływ antyproliferacyjny)
- zanik krwawienia miesięcznego, aż do całkowitego jego braku (hamowanie osi podwzgórze–przysadka–gonady)
Podawany razem z prostaglandyną, 200 mg mifepristonu jest równie skuteczne w wywołaniu poronienia, co standardowe 600 mg. Dawka 100 mg może wywierać zbliżony efekt, 50 mg jest zwykle niewystarczające. W dawkach wynoszących równo lub więcej niż 1 mg/kg mifepriston znosi działanie progesteronu na endometrium i myometrium. Efekt antyglikokortykosteroidowy u ludzi przejawia się przy ilościach większych lub równych 4,5 mg/kg. Odnotowuje się wówczas wzrost poziomu osoczowego ACTH i kortyzolu. Słabe oddziaływanie antyandrogeniczne można wykazać u zwierząt, podając im przez długi okres bardzo duże dawki (rzędu 10–100 mg/kg).
Status prawny i odbiór społeczny
Stany Zjednoczone
Firma farmaceutyczna Roussel Uclaf początkowo nie zgłaszała wniosku o wprowadzenie mifepristonu do obrotu na terenie USA, więc początkowo korzystanie z tego środka odbywało się całkowicie poza prawem. W 1989 roku został nałożony rządowy zakaz sprowadzania leku z zagranicy na własny użytek – decyzja ta uzyskała poparcie ze strony producenta. Po zmianie na stanowisku kierownika firmy, w 1994 roku Roussel Uclaf przekazał prawa do obrotu na terenie Stanów Zjednoczonych stowarzyszeniu Population Council w zamian za zrzeczenie się odpowiedzialności na wypadek roszczeń. Organizacja finansowała eksperyment kliniczne wymagane przy wprowadzeniu na rynek nowego terapeutyku, na które otrzymała pozwolenie w 1996 roku. Równolegle miał zostać uruchomiony proces produkcyjny, jednak pierwotny partner biznesowy grupy Danco (powołanej do dystrybucji preparatu) okazał się niewiarygodny, co kosztowało rok zwłoki. Agencja Żywności i Leków ostatecznie zaaprobowała mifepriston (Mifeprex) jako środek do wywoływania aborcji farmakologicznej we wrześniu 2000 roku. Obecnie jest legalnie dostępny na terenie wszystkich 50 stanów, Waszyngtonie oraz wyspach Guam i Portoryko. Jest wydawany na receptę osobom i placówkom upoważnionym do przeprowadzania tego rodzaju zabiegu.
Statystyka
Od czasu wprowadzenia mifepristonu na rynek odsetek aborcji z użyciem środków farmakologicznych (ang. medical abortions) systematycznie wzrastał:
| Rok badania | Procent udziału |
|---|---|
| 2000 | 1,0% |
| 2001 | 2,9% |
| 2002 | 5,2% |
| 2003 | 7,9% |
| 2004 | 9,3% |
| 2005 | 9,9% |
| 2006 | 10,6% |
| 2007 | 13,1% |
Dane z Instytutu Guttmachera (ośrodka non-profit założonego przez organizację Planned Parenthood) zebrane od klinik aborcyjnych wskazują, że w 2008 roku aborcje farmakologiczne stanowiły 17% wszystkich interwencji, w grupie poniżej 9. tygodnia ciąży, dochodząc do 25% (94% aborcji pozaszpitalnych wykorzystywało kombinację mifepristonu i misoprostolu, 6% – metotreksat i mizoprostol). W klinikach stowarzyszonych w Federacji odsetek ten jest jeszcze większy i sięga 32% dla pierwszego trymestru (2008).
Łączna ilość dokonywanych zabiegów nie zwiększyła się od czasu wprowadzenia pigułki wczesnoporonnej. Najwięcej aborcji dokonywano w latach 80 (26,8–29,3 aborcji na 1000 kobiet w wieku rozrodczym). Od 2001 roku trend jest w miarę stabilny (wskaźnik oscyluje w granicach 19,4–21,0).
Subsection H
Na liście leków aprobowanych przez FDA mifepriston figuruje w podpunkcie H (ang. subsection H), który wyszczególnia środki oparte na specjalnych zasadach dystrybucji:
- Leki przeciwnowotworowe i retrowirusowe przechodzą przez skrócony proces decyzyjny i są szybko dostarczane potrzebującym pacjentom z uwagi na ich krytyczny stan zdrowia.
- Stosowanie pozostałych preparatów (z drugiej części podpunktu) poddawane jest dodatkowemu monitoringowi, aby sprawdzić bezpieczeństwo ich stosowania w szerszej populacji i w przeciętnych warunkach klinicznych.
Konsekwencją tego jest ograniczona dostępność preparatu na rynku; nie można wykupić go w zwykłych aptekach. Środek jest uzyskiwany bezpośrednio przez lekarza, który ma obowiązek zareagować w wypadku nasilenia się zwykłych działań niepożądanych. Z uwagi na ryzyko obfitych krwawień i niepełnego wydalenia płodu ośrodek, w którym przeprowadzany jest zabieg, musi dysponować zapasem krwi do transfuzji oraz sprzętem chirurgicznym. Informacja o możliwych zagrożeniach musi być wyraźnie wyeksponowana na opakowaniu (ang. blackbox warning).
Głosy sprzeciwu
Wiele amerykańskich stowarzyszeń pro-life prowadziło działania przeciwko legalizacji mifepristonu. Po dopuszczeniu środka przez FDA rozpoczęły walkę o wycofanie go z użycia. Powołują się głównie na etyczne kontrowersje związane ze stosowaniem tego środka oraz możliwe działania niepożądane, które (w razie komplikacji) mogą prowadzić nawet do zgonu kobiety. Wynikiem tych działań była propozycja ustawy RU-486 Suspension and Review Act, szerzej znana jako Holly's Law, gdyż bezpośrednim bodźcem do jej powstania była petycja Monty'ego Pattersona, ojca 18-letniej Holly, która miała być 3. ofiarą śmiertelną stosowania tego środka na terenie Stanów Zjednoczonych. Wniosek przepadł podczas prac w komisjach parlamentarnych. 17 maja 2006 roku, w trakcie prac House Subcommittee on Criminal Justice, Drug Policy and Human Resources, nastąpił odczyt przedstawiciela Izby Reprezentantów Marka Soudera, aktywisty pro-life i szefa tejże jednostki. Było to najbardziej znaczące osiągnięcie osób zaangażowanych w tę walkę. Podobne protesty miały miejsce w innych krajach, m.in. w Niemczech i Australii.
Niewielka, ale bardzo zaangażowana grupa kobiet, pracujących naukowo w Massachusetts Institute of Technology's Institute on Women and Technology, wydała na początku lat 90. raport pt. Feminist International Network of Resistance to Reproductive and Genetic Engineering, w którym poddała mifepriston ostrej krytyce. „Czułyśmy, że w trakcie debaty politycznej pominięta została kwestia wpływu leku na organizm kobiety. W przeciwieństwie jednak do grup nastawionych antyfeministycznie i antyaborcyjnie Institute on Women and Technology popiera dążenie kobiet do aborcji i decydowania o własnym losie” – wyjaśniała dr Janice Raymond. Podobne głosy krytyczne ze strony feministek pojawiły się w Anglii, gdzie Pauline Connor (LI.B.) z Feminists Against Eugenics argumentowała: „To, co przedstawia się jako proste zażycie jednej pigułki, jest w rzeczywistości skomplikowaną i bolesną dla pacjentki procedurą medyczną, która może kosztować cztery wizyty w klinice i trwać do 12 dni”.
Europa
Poza terenem Stanów Zjednoczonych produkcją i sprzedażą preparatu (pod nazwą Mifegyne) zajmuje się Exelgyn Laboratories. Mifepriston został dopuszczony we Francji w 1988 roku (w obrocie od 1989), następnie w kolejnych krajach – zgodnie z poniższą tabelą:
| Data dopuszczenia | Kraje |
|---|---|
| 1988 | Francja |
| 1989 | Zjednoczone Królestwo |
| 1992 | Szwecja |
| 1999 | Austria, Belgia, Dania, Finlandia, Niemcy,
Grecja, Luksemburg, Holandia, Hiszpania, Szwajcaria, Rosja |
| 2000 | Norwegia, Ukraina |
| 2001 | Serbia i Czarnogóra |
| 2002 | Białoruś, Litwa |
| 2003 | Estonia |
| 2004 | Mołdawia |
| 2005 | Albania, Węgry |
| 2007 | Portugalia |
| 2008 | Rumunia |
| 2009 | Włochy |
| 2014 | Czechy |
Na Węgrzech mifepriston nie został wprowadzony do sprzedaży, pomimo legalizacji w 2005 roku, ze względu na niegasnący sprzeciw środowisk koserwatywnych. Nowa konstytucja, mająca wejść w życie od 2012 roku, narzuca całkowitą ochronę życia poczętego. We Włoszech (30 lipca 2009) decyzja spotkała się z ostrą krytyką Watykanu. Środek terapeutyczny jest tam poddany ograniczeniom dystrybucyjnym i musi być użyty pod nadzorem klinicznym. Pierwszą pacjentką (kwiecień 2010) miała zostać 25-letnia Polka. Krajami, które dotychczas nie zaaprobowały jego stosowania, pozostają m.in. Irlandia (zabieg aborcji jest tam karalny) oraz Polska (aborcja podlega ścisłym ograniczeniom). Holenderska organizacja pro-choice Women on Waves oferuje możliwość przesłania niezbędnych preparatów drogą pocztową do tych państw, gdzie ich sprzedaż jest zabroniona.
Aborcja farmakologiczna jest coraz częściej wybieraną opcją w wielu krajach Europy. We Francji ich odsetek sięgał w 2007 roku 49%. W Anglii i Walii 52% wczesnych (poniżej 9. tygodnia) aborcji zostało dokonane tą drogą. Łącznie stanowią one 40% wszystkich zabiegów (2009). W Szwecji 85,6% aborcji do 9. tygodnia i 73,2% do 12 tygodnia było sprowokowanych farmakologicznie. Przykładowe statystyki pokazują, że do 2000 roku 620 000 kobiet w Europie zastosowało mifepriston w celu usunięcia ciąży. W Danii 3000–4000 na 15 000 aborcji odbyło się z użyciem mifepristonu (2005).
Inne kraje

Legalna na życzenie
Legalna ze względu na gwałt, życie matki, zdrowie, zdrowie psychiczne, czynniki socjoekonomiczne lub defekty płodu
Legalna albo nielegalna z wyjątkiem gwałtu, życia matki, zdrowia, defektów płodu lub zdrowia psychicznego
Nielegalna z wyjątkiem gwałtu, życia matki, zdrowia lub zdrowia psychicznego
Nielegalna z wyjątkiem życia matki, zdrowia lub zdrowia psychicznego
Nielegalna z wyjątkiem zagrożenia życia matki
Nielegalna bez względu na okoliczności
Brak informacji
Protokół aborcji farmakologicznej w Kanadzie obejmuje metotreksat i mizoprostol. Mifepriston nie został w tym celu zarejestrowany i obecnie nie jest legalnie dostępny. Od 2000 roku w różnych miastach kanadyjskich odbywały się testy kliniczne z użyciem obydwu schematów terapeutycznych, które nie wykazały różnic w ich skuteczności (mifepriston miał mieć szybszy początek działania). Rok później wstrzymano jednak postępowanie legalizacyjne, kiedy jedna z pacjentek zmarła na skutek uogólnionego zakażenia bakterią Clostridium sordellii.
Użycie mifepristonu w Australii zostało zakazane w 1996 roku. Pod koniec 2005 roku Senat Australii zajął się ustawą poselską, która znosiła to ograniczenie i przekazywała moc decyzyjną Therapeutic Goods Administration (TGA), instytucji odpowiedzialnej za nadzór nad środkami farmaceutycznymi. Wniosek wywołał wiele kontrowersji na terenie całego kraju. 10 lutego 2006 roku prawo zostało uchwalone i od tej pory mifepriston stał się ponownie legalnie dostępny. Aktualnie aborcje farmakologiczne są przeprowadzone na terenie klinik specjalizujących się w tej dziedzinie (kilka na każdy ze stanów). W praktyce jej dostępność jest dość ograniczona.
W Nowej Zelandii spółkę Istar, mającą zająć się importem preparatu, powołało do istnienia kilku lekarzy o poglądach pro-choice. Ich wniosek został zatwierdzony przez MedSafe, agencję regulującą handel lekami na terenie wyspy. Stowarzyszenie Right to Life New Zealand pozwało wówczas przedstawicieli firmy do sądu. Po przegraniu sprawy sprzedaż mifepristonu została ostatecznie zalegalizowana.
Próby kliniczne z mifepristonem w Chinach rozpoczęły się już w 1985 roku. Rejestrując środek w 1988 roku, Chiny stały się pierwszym państwem na świecie, który pozwolił na jego użytek. W kolejnych latach były czynione zabiegi o wykupienie praw do preparatu. Firma Russel Uclaf (ich właściciel) konsekwentnie sprzeciwiała się tym zamiarom. Wobec tego Chiny rozpoczęły niezależną produkcję preparatu. Ze względu na stosunkowo wysoki koszt (stan na 2000 rok) aborcja farmakologiczna upowszechniła się tylko na terenach miejskich, gdzie stanowiła 30–70% wszystkich zabiegów. Raport ambasady Stanów Zjednoczonych z 2000 roku stwierdzał, że mifepriston jest stosowany na szeroką skalę w aglomeracjach miejskich od dwóch lat. Równolegle rozwija się czarny rynek, na którym kobiety mogą nielegalnie nabyć opakowania środka odsprzedawane z klinik i aptek za równowartość ok. 15 USD. Władze zaczynają się obawiać, że stosowanie mifepristonu na własną rękę może w konsekwencji przynieść wzrost wypadków medycznych związanych z brakiem odpowiedniego nadzoru.
Tajwan dopuścił używanie mifepristonu w 2001 roku. Wietnam zawarł go zaś w swoim Narodowym Programie Zdrowia Reprodukcyjnego w 2002 roku. Tylko jedno afrykańskie państwo subsaharyjskie oficjalnie popiera używanie środka – jest nim RPA, które zalegalizowało go w 2001 roku. Dostępny jest również w Tunezji od 2001 roku i Izraelu (1999). W Indiach aborcję farmakologiczną (określaną angielskim zwrotem Medical Termination of Pregnancy, MTP) z użyciem mifepristonu dokonuje się od 2002 roku. Wymagana jest kontrola lekarza nad zabiegiem, a za rozprowadzanie lekarstw na własny użytek grożą konsekwencje prawne. Mifepriston został zarejestrowany również w Azerbejdżanie, Gruzji i Uzbekistanie w roku 2002, Gujanie i Mołdawii w 2004, w Mongolii w 2005 oraz Armenii w 2007.
Bibliografia
Książki:
- Laurence L. Brunton, John S. Lazo, Keith L. Parker: Goodman's & Gilman's Pharmacological Basis of Therapeutics. Wyd. 11. The McGraw-Hill Companies, 2006. ISBN 0-07-142280-3.
- Ernst Mutschler, Gerd Geisslinger: Farmakologia i Toksykologia Mutschlera. MedPharm, 2010. ISBN 978-83-60466-81-0.
- British National Formulary 61. London: BMJ Group and the Royal Pharmaceutical Society of Great Britain, marzec 2011. ISBN 978-0-85369-962-0.
- Jonathan S. Berek: Berek & Novak's Gynecology. Wyd. 14. Lippincott Williams & Wilkins, 2007. ISBN 978-0-7817-6805-4.
- F. Gary Cunningham, Kenneth J. Leveno i inni: Williams Obstetrics. Wyd. 23. The McGraw-Hill Companies, 2010. ISBN 978-0-07-149701-5.
- Francis J. Beckwith: Defending life. Cambridge University Press, 2007. ISBN 978-0-511-33430-6.
- ACOG practice bulletin. Clinical management guidelines of obstetrician-gynecologists. Number 67. Medical management of abortion. „Obstet Gynecol”. 4 (106), s. 871–882, październik 2005.
Przeglądy systematyczne Cochrane Collaboration z udziałem mifepristonu:
- Lale Say, Dalia Brahmi. Medical versus surgical methods for first trimester termination of pregnancy. „Cochrane Database of Systematic Reviews”, 2010. brak numeru strony
- Patricia A. Lohr, Jennifer L. Hayes. Surgical versus medical methods for second trimester induced abortion. „Cochrane Database of Systematic Reviews”, 2008. brak numeru strony
- Regina Kulier, Nathalie Kapp. Medical methods for first trimester abortion. „Cochrane Database of Systematic Reviews”, 2010. brak numeru strony
- Hajo Wildschut, Marieke I. Both. Medical methods for mid-trimester termination of pregnancy. „Cochrane Database of Systematic Reviews”, 2011. brak numeru strony
- Dharani Hapangama, James P. Neilson. Mifepristone for induction of labour. „Cochrane Database of Systematic Reviews”, 2009. brak numeru strony
- Linan Cheng, A. Metin Gülmezoglu. Interventions for emergency contraception. „Cochrane Database of Systematic Reviews”, 2008. brak numeru strony
- Nathalie Kapp, Patricia A. Lohr. Cervical preparation for first trimester surgical abortion. „Cochrane Database of Systematic Reviews”, 2010. brak numeru strony
- Sara J. Newmann, Andrea Dalve-Endres. Cervical preparation for second trimester dilation and evacuation. „Cochrane Database of Systematic Reviews”, 2010. brak numeru strony
| G03A – Hormonalne środki antykoncepcyjne do stosowania wewnętrznego |
|
||||||||
|---|---|---|---|---|---|---|---|---|---|
| G03B – Androgeny |
|
||||||||
| G03C – Estrogeny |
|
||||||||
| G03D – Progestageny |
|
||||||||
| G03E – Połączenia androgenów z żeńskimi hormonami płciowymi |
|
||||||||
| G03F – Połączenia progestagenów z estrogenami |
|
||||||||
| G03G – Gonadotropiny i inne leki pobudzające owulację |
|
||||||||
| G03H – Antyandrogeny |
|
||||||||
| G03X – Inne hormony płciowe i modulatory ich wydzielania |
|