
Mięsak Kaposiego
| Kaposi sarcoma | |
 Mięsak Kaposiego | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
| C46.0 |
Mięsak Kaposiego skóry |
| C46.1 |
Mięsak Kaposiego tkanki miękkiej |
| C46.2 |
Mięsak Kaposiego podniebienia |
| C46.3 |
Mięsak Kaposiego węzłów chłonnych |
| C46.7 |
Mięsak Kaposiego innych umiejscowień |
| C46.8 |
Mięsak Kaposiego licznych narządów |
| C46.9 |
Mięsak Kaposiego, nie określony |
{{Choroba infobox}}
|
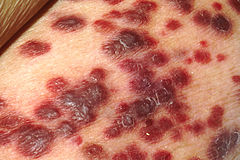
Mięsak Kaposiego – mięsak tkanek miękkich pochodzenia naczyniowego zaliczany do nowotworów o granicznej złośliwości rzadko przerzutujących. Klinicznie wyróżnia się postać klasyczną dotyczącą starszych mężczyzn regionu basenu Morza Śródziemnego oraz – w Europie Środkowej – postać związaną z AIDS, postać endemiczną występującą w Afryce Środkowej i Wschodniej oraz postać jatrogenną związaną z immunosupresją. Choroba przebiega w trzech stadiach, początkowo zmiany nowotworowe przybierają formę czerwononiebieskich, fioletowych, ciemnobrązowych plamek przekształcających się w blaszki, a następnie w guzki.
Rozpoznanie mięsaka Kaposiego często jest stawiane na podstawie charakterystycznego obrazu klinicznego, ale ostateczne rozpoznanie wymaga badania histopatologicznego materiału pobranego drogą biopsji.
Leczenie mięsaka Kaposiego ma na celu poprawę i kontrolę objawów wywoływanych przez chorobę oraz zapobiegnięcie progresji nowotworu. W leczeniu miejscowym stosuje się metody chirurgiczne oraz radioterapię. W przypadku szybkiej progresji choroby czy zajęcia narządów wewnętrznych stosuje się chemioterapię opartą na liposomalnej doksorubicynie lub taksanach. U chorych z postacią związaną z AIDS konieczne jest wdrożenie intensywnej terapii antyretrowirusowej (HAART).
Postacie kliniczne mięsaka Kaposiego
Wyróżnia się cztery postacie kliniczno-epidemiologiczne choroby: postać klasyczną, postać związaną z AIDS, postać endemiczną i postać jatrogenną.
Postać klasyczna (sporadyczna, przewlekła)
Postać klasyczna mięsaka Kaposiego w zdecydowanej większości przypadków dotyczy starszych mężczyzn, głównie w szóstej i siódmej dekadzie życia. Występuje 10–15 razy częściej u mężczyzn niż u kobiet. Choroba najczęściej występuje u Żydów Aszkenazyjskich w Europie Środkowej oraz w regionie basenu Morza Śródziemnego.
Choroba początkowo manifestuje się jako liczne, drobne zmiany skórne pojawiające się w dystalnej części kończyn dolnych. Czasem zmiany są obecne w obrębie dystalnej części kończyn górnych, a rzadko wyłącznie w obrębie trzewi bez obecności zmian skórnych. Zmiany przybierają formę fioletowych, czerwononiebieskich lub ciemnobrązowych plamek, blaszek czy grudek. Zmiany mogą ulegać owrzodzeniu, może występować obrzęk zajętej kończyny. Wielkość zmian ulega powolnemu powiększaniu, następnie zlewaniu, również liczba zmian ulega zwiększeniu poprzez proksymalne szerzenie się choroby. Typowo przebieg choroby jest powolny i indolentny. Rzadziej obserwuje się postać o piorunującym przebiegu z szybkim rozwojem rozsianych zmian w obrębie skóry, błon śluzowych i narządów wewnętrznych. Postaci klasycznej towarzyszy zwiększone ryzyko współwystępowania drugiego niezależnego nowotworu.
Postać związana z AIDS (epidemiczna)
Zespół nabytego niedoboru odporności (AIDS) spowodowany przez zakażenie HIV wiąże się ze znacznym upośledzeniem odporności i w konsekwencji zakażeniami oportunistycznymi oraz zwiększonym ryzykiem rozwoju nowotworów. Historycznie, przed opracowaniem intensywnej terapii antyretrowirusowej (HAART), w przebiegu AIDS 30% chorych rozwijało mięsaka Kaposiego. Mięsak Kaposiego jest wczesnym objawem AIDS (chorobą wskaźnikową) i u 30% chorych na AIDS jest pierwszą manifestacją tego zespołu.
Ryzyko rozwoju mięsaka Kaposiego jest większe u homoseksualnych mężczyzn niż w innych populacjach kluczowych. Szacuje się, że 40–50% homoseksualnych zakażonych mężczyzn rozwija mięsaka Kaposiego, podczas gdy w pozostałych grupach epidemiologicznych takie ryzyko nie przekracza 5%, a u chorych zakażonych drogą transfuzji skażonej krwi choroba jest wyjątkowo rzadka. Ocenia się, że AIDS aż 20 000 razy zwiększa ryzyko zachorowania na mięsaka Kaposiego.
Postać typowo manifestuje się poprzez obecność licznych, drobnych, różowych plamek, które następnie przybierają formę niebiesko-fioletowych grudek. Zmiany mogą występować w dowolnej lokalizacji skóry, błon śluzowych oraz narządów wewnętrznych. W badaniach autopsyjnych w mięsaku Kaposiego związanym z AIDS najczęstszymi lokalizacjami narządowymi były węzły chłonne (72%), płuca (51%), przewód pokarmowy (48%), wątroba (34%) oraz śledziona (27%). Ponadto w obrazie choroby obok zmian typowych dla mięsaka Kaposiego występują zakażenia oportunistyczne oraz inne choroby typowe dla AIDS.
Postać endemiczna
Postać endemiczna występuje w Afryce Środkowej i Wschodniej. Postać dotyczy osób młodszych niż postać klasyczna, występuje głównie u mężczyzn w młodym i średnim wieku oraz u dzieci. Obecnie wobec pandemii zakażenia HIV w Afryce postać jest trudna do odróżnienia od postaci związanej z zakażeniem HIV. Wyróżnia się kilka wariantów postaci endemicznej: łagodna węzłowa, agresywna lokalnie, rozsiana oraz dziecięca z limfadenopatią. Warianty mogą przypominać postać klasyczną albo progresję postaci związanej z HIV. Postać dziecięca charakteryzuje się zajęciem węzłów chłonnych, czasem ślinianek, zwykle bez lub wyłącznie z niewielkimi zmianami skórnymi. Z postacią endemiczną wiąże się zwiększone ryzyko występowania nowotworów limfoproliferacyjnych.
Postać jatrogenna
Postać jatrogenna jest powikłaniem immunosupresji koniecznej u biorców przeszczepów narządów litych. Przeszczep wiąże się z 400–500-krotnym zwiększeniem ryzyka rozwoju mięsaka Kaposiego. Przebieg jatrogennego mięsaka Kaposiego jest zróżnicowany. Choroba może obejmować rozsiane zajęcie skóry, błon śluzowych oraz narządów wewnętrznych. W większości przypadków choroba wiąże się z reaktywacją zakażenia wirusem mięsaka Kaposiego (KSHV, HHV-8).
Epidemiologia
Mięsak Kaposiego w populacji światowej nie jest częstym nowotworem. W 2012 roku na całym świecie rozpoznano blisko 44 000 nowych przypadków mięsaka Kaposiego i zanotowano niemal 27 000 zgonów. W krajach rozwiniętych stwierdzono jedynie 3300 przypadków chorych. Aż 85% przypadków rozpoznano w Afryce. Stwierdza się dwukrotnie wyższą zapadalność na ten nowotwór u mężczyzn niż u kobiet. W badaniu RARECARE roczna zapadalność na mięsaka Kaposiego w Europie wynosiła 0,3 na 100 000, ale w Europie Południowej była ona większa i wynosiła ona 0,8 na 100 000. W Polsce w 2010 roku zanotowano 22 przypadki tego nowotworu u mężczyzn i 9 przypadków u kobiet.
Cztery postacie kliniczne znacznie różnią się pod względem epidemiologii. Postać klasyczna jest stosunkowo rzadką chorobą. Występuje głównie u mężczyzn w średnim i starszym wieku, pomiędzy 50. a 80. rokiem życia, szczyt zapadalności przypada na szóstą i siódmą dekadę życia. Występuje 10–15 razy częściej u mężczyzn niż u kobiet. Choroba jest rozpowszechniona w niektórych częściach świata i najczęściej występuje przede wszystkim u Żydów Aszkenazyjskich w Europie Środkowej oraz w regionie basenu Morza Śródziemnego. Postać klasyczna mięsaka Kaposiego najbardziej jest rozpowszechniona we Włoszech, Grecji, Turcji i Izraelu. Zapadalność na postać klasyczną w basenie Morza Śródziemnego jest dziesięciokrotnie wyższa niż w Stanach Zjednoczonych. We Włoszech zapadalność u mężczyzn jest oceniana na 1,0 przypadek na 100 000, przy czym na Sardynii zapadalność była znacznie większa i wynosiła 4,7 na 100 000, z kolei w Izraelu zapadalność u mężczyzn wynosi około 2,07 przypadków na 100 000.
Mięsak Kaposiego wraz z chłoniakami nieziarniczymi należy do najczęstszych nowotworów związanych z AIDS i około 30% nieleczonych chorych zakażonych HIV rozwija tego mięsaka. Przed pandemią zakażenia HIV mięsak Kaposiego, poza obszarami basenu Morza Śródziemnego, Europy Wschodniej oraz Afryki Subsaharyjskiej był bardzo rzadką chorobą. Pandemia AIDS znacząco wpłynęła na epidemiologię mięsaka Kaposiego, wielokrotnie zwiększając częstość jego występowania w częściach świata o wysokiej zapadalności na HIV i występowania AIDS. W regionach typowych dla postaci klasycznej, takich jak Włochy, u osób poniżej 50. roku życia zaobserwowano kilkukrotne zwiększenie zapadalności na mięsaka Kaposiego, z kolei u osób powyżej 50. roku życia nie stwierdzono istotnej zmiany zapadalności. Od lat 80. do połowy lat 90. w związku ze wzrostem liczby przypadków AIDS obserwowano systematyczny wzrost zapadalności na mięsaka Kaposiego i na te lata przypadał szczyt zapadalności na ten nowotwór. Wprowadzenie do leczenia AIDS skutecznej terapii antyretrowirusowej w latach 90. spowodowało znaczne zmniejszenie zapadalności na mięsaka Kaposiego i pomogło obniżyć liczbę nowych przypadków o 60–70%. W badaniu z 2003 roku opisano spadek zapadalności na mięsaka Kaposiego z 30 rozpoznań na 1000 osobo-lat do 0,03 na 1000 osobo-lat.
Postać endemiczna występuje w Afryce Subsaharyjskiej, choroba pojawia się u mężczyzn w młodym i średnim wieku oraz u dzieci. Częstość występowania postaci jatrogennej zależy od rozpowszechnienia zakażenia KSHV (HHV-8) i najczęściej jest rozpoznawana w obrębie Afryki Subsaharyjskiej, basenu Morza Śródziemnego oraz Karaibów.
Obraz kliniczny
Mięsak Kaposiego objawia się wieloogniskowymi zmianami w obrębie skóry, może również pojawiać się w zakresie błon śluzowych, węzłów chłonnych oraz narządów wewnętrznych.
Choroba może przybrać przebieg od postaci indolentnej i ograniczonej do jednej lokalizacji skórnej do agresywnej, szybko postępującej z rozsianymi zmianami skórnymi i zajęciem trzewi. Początkowo zmiany skórne mogą przybierać formę czerwononiebieskich, fioletowych, ciemnobrązowych plamek, które następnie ulegają przekształceniu w grudki, guzki lub blaszki. Zmiany wykazują zróżnicowaną wielkość i morfologię. W postaci klasycznej drobne zmiany skórne są zlokalizowane w dystalnej części kończyn dolnych, z kolei w postaci związanej z AIDS zmiany są drobne, mogą pojawiać się w dowolnej lokalizacji, zajmując błony śluzowe i nierzadko również narządy wewnętrzne. Guzki wykazują tendencję do kopulastego powiększania się. Zmiany mogą ulegać owrzodzeniu, mogą prezentować wyraźny wzrost egzofityczny, przypominając róg skórny, naciekać niżej położone tkanki oraz powodować obrzęk limfatyczny.
W pozaskórnym mięsaku Kaposiego zmiany obserwuje się w obrębie błon śluzowych, w narządach wewnętrznych oraz węzłach chłonnych. Zmiany narządowe najczęściej stwierdza się w przewodzie pokarmowym, wątrobie, płucach oraz sercu, ale mogą występować w dowolnej lokalizacji. Zajęcie narządów wewnętrznych oraz węzłów chłonnych może przebiegać bez obecności choroby w zakresie skóry.
Zmiany w obrębie głowy i szyi przed pandemią AIDS były rzadkie. Obecnie zmiany w obrębie skóry i błon śluzowych okolicy głowy i szyi dotyczą przede wszystkim chorych na AIDS, u których jest to jedna z najczęstszych lokalizacji zmian w przebiegu mięsaka Kaposiego. U blisko 70% chorych na mięsaka Kaposiego związanego z AIDS stwierdza się wykwity w zakresie skóry twarzy, skalpu i szyi, a u blisko 60% w obrębie jamy ustnej, jamy nosowej, gardła i krtani. U 13% stwierdza się powiększone węzły chłonne tej okolicy. Rzadko stwierdza się zmiany w spojówkach, gruczołach łzowych, śliniankach, migdałkach i mięśniu żwaczu. Zmiany zwykle są bezobjawowe, ale mogą powodować ból, krwawienie, ulegać owrzodzeniu, wtórnym zakażeniom oraz wywoływać objawy poprzez ucisk innych struktur.
Zajęcie przewodu pokarmowego jest najczęstszą lokalizacją narządową mięsaka Kaposiego. Zmiany mogą pojawiać się w dowolnym odcinku układu pokarmowego, choć najczęściej stwierdza się je w dwunastnicy. Mięsak może przebiegać bezobjawowo, ale może doprowadzić do krwawienia z przewodu pokarmowego, nudności, wymiotów, niedrożności przewodu pokarmowego, niedrożności dróg żółciowych, wgłobienia, perforacji, utraty masy ciała, biegunki i enteropatii z utratą białek. Zmiany w wątrobie i śledzionie mogą prowadzić do powiększenia wątroby i śledziony.
Zmiany w obrębie układu oddechowego, w tym płuc, manifestują się kaszlem, krwiopluciem, krwotokiem, dusznością, bólem w klatce piersiowej oraz gorączką. Zajęcie płuc stanowi istotną przyczynę zgonów w następstwie zniszczenia miąższu płuc i niewydolności oddechowej, zamknięcia dróg oddechowych lub krwotoku, najczęściej w konsekwencji powikłań infekcyjnych wtórnych do zmian w drogach oddechowych. Obecność zmian w opłucnej może być przyczyną wysięku do jamy opłucnej.
Zmiany w sercu, pomimo że dotyczą 28% chorych z mięsakiem Kaposiego związanego z AIDS, rzadko są na tyle rozległe, by powodować objawy kliniczne.
Histopatologia
Makroskopowo zmiany przyjmują formę niebieskoczerwonych plamek, przekształcających się w grudki, guzki lub blaszki. Wielkość zmian waha się od kilku milimetrów do kilku centymetrów.
Obraz mikroskopowy wszystkich typów klinicznych mięsaka Kaposiego nie różni się. Guz jest zbudowany z dobrze wykształconych przestrzeni naczyniowych oraz komórek śródbłonka pozostających w różnych wzajemnych proporcjach. Okres plamisty, tarczkowy i guzkowy stanowią pewny następujący po sobie ciąg zmian morfologicznych i w większych bioptatach poszczególne etapy mogą współwystępować ze sobą.
Okres plamisty jest najwcześniejszym stadium rozwoju mięsaka Kaposiego. W obrazie mikroskopowym charakterystyczna jest obecność proliferacji nieprawidłowych drobnych naczyń wokół większych ektatycznych naczyń lub w pobliżu przydatków skóry. Zmiany występują w górnej części skóry właściwej, mogą sięgać do warstwy siatkowatej skóry właściwej. Przestrzenie naczyniowe cechują się nieregularnym, postrzępionym lub szczelinowatym światłem. Wyścielające przestrzenie naczyniowe komórki są spłaszczone lub bardziej owalne z niewielką atypią. Wcześniej istniejące natywne naczynia mogą być wpuklone do światła ektatycznych nowotworowych naczyń. Może być widoczny naciek z limfocytów i komórek plazmatycznych, wynaczynione erytrocyty oraz makrofagi przeładowane hemosyderyną.
Okres tarczkowy jest następstwem wzrostu prowadzącego do uniesienia zmiany. Zmiany widoczne w etapie plamki stają się bardziej zaznaczone. Naciek mięsaka jest bardziej rozlany. W tym etapie mięsak obejmuje całą grubość skóry właściwej i może sięgać do tkanki podskórnej. Proliferacja naczyń z obecnością postrzępionych przestrzeni naczyniowych staje się bardziej rozległa, bardziej widoczny jest naciek zapalny. Obecny jest komponent komórek wrzecionowatych, który początkowo jest obecny wokół proliferujących naczyń.
W okresie guzka narasta proliferacja komórek wrzecionowatych, zmiany stają się bardziej komórkowe. Ogniska komórek wrzecionowatych z czasem ulegają połączeniu, tworząc dobrze ograniczone guzki, zbudowane z przecinających się pęczków komórek wrzecionowatych z licznymi szczelinowatymi przestrzeniami zawierającymi erytrocyty. Komórki wykazują łagodną atypię, występuje tylko niewielka liczba figur mitotycznych, pleomorfizm nie jest obecny. W części obwodowej zmiany widoczne są ektatycznie poszerzone naczynia, złogi hemosyderyny oraz obecność nacieku zapalnego. Charakterystyczną cechą jest obecność bezbarwnych szklistych złogów w obrębie i poza komórkami wrzecionowatymi, które mogą być zniszczonymi erytrocytami. Duże zmiany guzkowe często ulegają owrzodzeniu.
Obecnie wyróżnia się wariant hiperkeratotyczny, keloidalny, teleangiektatyczny, pęcherzowy oraz wariant z towarzyszącymi wylewami naczyniowymi. Wariant hiperkeratotyczny cechuje się nadmiernym rogowaceniem i brodawkowaniem skóry pokrywającej ogniska mięsaka Kaposiego. Postać jest związana z obrzękiem limfatycznym w przebiegu mięsaka Kaposiego. Postać keloidalna występuje wyjątkowo rzadko, charakteryzuje się obecnością twardych, gumowatych zmian. W postaci z towarzyszącymi wylewami naczyniowymi proliferacji ze zmianami nowotworowymi współistnieją rozległe wynaczynienia. W starszej literaturze wyróżnia się również wariant anaplastyczny oraz przypominający obrzęk limfatyczny. Wariant anaplastyczny (pleomorficzny) cechuje się zaznaczonym pleomorfizmem, większą liczbą mitoz, możliwością obecności atypowych mitoz oraz ognisk martwicy. Klinicznie przekłada się to na większą agresywność lokalną, głębszą inwazję oraz zdolnością do wytwarzania przerzutów.
W około 90% przypadków mięsaka Kaposiego stwierdza się dodatnią reakcję dla LANA-1 (latency-associated nuclear antigen) będącego białkiem wirusowym KSHV (HHV-8). Reakcja na ten antygen jest negatywna dla innych nowotworów naczyniowych. Oznaczenie antygenu LANA-1 jest przydatne w diagnostyce wczesnych przypadków mięsaka Kaposiego przede wszystkim u chorych na AIDS oraz w diagnostyce różnicowej w celu wykluczenia naczyniakomięsaka. W mięsaku Kaposiego stwierdza się dodatnią reakcję dla CD31, CD34, VEGFR-3 oraz D2-40.
Etiologia
Transformacja nowotworowa jest wieloetapowym procesem, w którym musi dojść do zwiększenia zdolności do proliferacji, oporności na apoptozę oraz wytworzenia odpowiedniego mikrośrodowiska. W patogenezie choroby kluczowa jest infekcja wirusem KSHV, która jednak nie jest zjawiskiem wystarczającym do transformacji nowotworowej. Kofaktorem niezbędnym do indukcji mięsaka Kaposiego jest przede wszystkim zakażenie HIV i rozwój AIDS.
- Pochodzenie nowotworu
Badania sugerują, że mięsak Kaposiego wywodzi się z komórki śródbłonka naczyń limfatycznych. Komórki wykazują ekspresję LYVE-1, D2-40 i VEGFR-3, które są swoiste dla śródbłonka naczyń limfatycznych. Mięsaka Kaposiego nie stwierdza się w obszarach pozbawionych naczyń limfatycznych takich jak mózg. Z drugiej strony obecne są markery śródbłonka naczyniowego w tym czynnik von Willebranda i PAL-E. Również profil ekspresji genów bardziej przemawia za pochodzeniem nowotworu z komórek śródbłonka naczyń limfatycznych, a zakażenie KSHV może wpływać na zmianę profilu ekspresji genów bardziej typowego dla komórek śródbłonka naczyniowego.
- Niedobory immunologiczne
Ryzyko rozwoju mięsaka Kaposiego jest ściśle związane z występowaniem niedoborów immunologicznych. Spadek liczby limfocytów CD4+ zwiększa ryzyko rozwoju mięsaka Kaposiego zarówno w przebiegu zakażenia HIV, jak i podtypu klasycznego. Wykazano, że u chorych zakażonych HIV rozwijających mięsaka Kaposiego swoista odpowiedź immunologiczna zależna od limfocytów CD4+ przeciw KSHV jest zmniejszona w porównaniu do chorych zakażonych HIV bez mięsaka Kaposiego, a wprowadzenie leczenia antyretrowirusowego wiąże się ze wzrostem liczby limfocytów CD4+ oraz poprawą swoistej odpowiedzi przeciw KSHV. Również lokalny niedobór odporności może sprzyjać rozwojowi mięsaka Kaposiego. W regionach występowania postaci endemicznej stwierdzono związek choroby z występowania słoniowacizny niezwiązanej z filariami oraz chodzeniem boso przez rolników po ziemi zawierającej glinkę wulkaniczną. Zaburzenie odpływu chłonki sprzyja lokalnemu osłabieniu odpowiedzi immunologicznej.
- Rola infekcji KSHV (HHV-8)
Patogeneza mięsaka Kaposiego jest ściśle powiązana z zakażeniem wirusem KSHV (HHV-8). Sekwencje DNA wirusa KSHV są obecne w ponad 90% przypadków mięsaka Kaposiego, także tych niezwiązanych z zakażeniem HIV. Wiadomo, że zakażenie KSHV wyprzedza rozwój mięsaka Kaposiego. Pośrednio za rolą tego wirusa przemawiają dane epidemiologiczne, ponieważ obszary o największej zapadalności na KSHV pokrywa się z obszarem o najwyższej zapadalności na postać klasyczną postać mięsaka Kaposiego, z kolei w obszarach o niskiej zapadalności na KSHV również zapadalność na postać klasyczną mięsaka Kaposiego pozostaje niska. Również częstsze występowania mięsaka Kaposiego u homoseksualnych mężczyzn chorych na AIDS jest powiązane z epidemiologią z KSHV, którego zakażenie jest częściej obserwowane u homoseksualnych mężczyzn oraz w innych grupach ryzyka zakażenia HIV niż w populacji ogólnej. Z drugiej strony większość zakażonych KSHV nie rozwija mięsaka Kaposiego, zatem sam wirus nie jest wystarczającym czynnikiem do rozwoju tego nowotworu. Znaczne zwiększenie ryzyka rozwoju mięsaka Kaposiego u zakażonych HIV oraz spadek tego ryzyka po włączeniu skutecznego leczenia antyretrowirusowego sugeruje, że jest on głównym kofaktorem prowadzącym do tego nowotworu.
Patogeneza rozwoju mięsaka Kaposiego w następstwie zakażenia KSHV jest związane z wytwarzaniem przez tego wirusa licznych białek stymulujących proliferację i hamujących apoptozę. Część genów wirusa ulega stałej ekspresji również w fazie zakażenia latentnego. Jednym z takich genów jest gen LAMA, który pełni kluczową funkcję w replikacji wirusa KSHV. Kodowane przez ten gen białko sprzyja przeżyciu zakażonych komórek poprzez inhibicję apoptozy, a w wyniku zaburzenia funkcji białek supresorowych p53 i RB1 sprzyja transformacji nowotworowej, ponadto może wpływać na regulację stężenia β-kateniny i regulacji szlaku Wnt/β-katenina. Rozpoznano funkcjonalny homolog cykliny D zwany v-cykliną, który może wpływać na zwiększenie oporności cdk6 na działanie inhibitorów cdk, w tym p27, jednak jego rola w patogenezie mięsaka Kaposiego nie jest jasna.
Obserwacje z gancyklowirem sugerują, że do rozwinięcia mięsaka Kaposiego konieczne jest występowanie cyklu litycznego. W trakcie cyklu litycznego wytwarzane jest białko v-GPCR kodowane przez gen ORF-74. Białko poprzez homologię z receptorem IL-8 wpływa na angiogenezę, sprzyja proliferacji komórek i hamuje apoptozę. Białko wywiera silny efekt proangiogenny w wyniku indukcji VEGF, angiogeniny i angiopoetyny. vGPCR poprzez aktywację VEGF aktywuje szlak PI3K/AKT/mTOR. Białko vFLIP wykazuje działanie onkogenne, wiążąc się z konstytutywną aktywacją szlaku NF-kB. Poprzez wirusowy homolog IL-6 – vIL-6 – wirus wpływa na szlak JAK/STAT.
Utajone zakażenie KSHV nie prowadzi do transformacji nowotworowej, z kolei cykl lityczny prowadzi do efektu cytopatycznego i do odpowiedzi immunologicznej, a zatem nie może doprowadzić do transformacji nowotworowej u osób immunokompetentnych. W teorii „parakrynnej onkogenezy” komórki w fazie litycznej w wyniku ekspresji genów typowych dla tej fazy, w tym vGPCR i ORF45, stymulują proliferację komórek zakażonych KSHV w fazie latentnej. W teorii „nieudanych liz” komórki wykazujące ekspresję wczesnych genów fazy litycznej, ale nieulegających lizie, mogą wpływać na komórki pozostające w fazie latentencji i stymulować onkogenezę, a także powracać do fazy zakażenia utajonego ostatecznie bez ulegania lizie. Oba modele mogą wyjaśniać wysoką częstość występowania mięsaka Kaposiego u zakażonych HIV, gdzie przewlekła aktywacja immunologiczna może aktywować fazy lityczną i jednocześnie w następstwie immunosupresji nie prowadzić do lizy tych komórek.
- Rola zakażenia HIV
Patogeneza mięsaka Kaposiego związana z AIDS jest ściśle powiązana z infekcją KSHV. Kluczowym zjawiskiem jest wysoki poziom cytokin prozapalnych typu Th1 (TNF-α, IFN-γ, IL-1β i IL-6) w środowisku immunosupresji. Wysokie stężenie cytokin prozapalnych w obrazie zakażenia HIV wpływa do aktywacji do fazy litycznej zakażenia KSHV pozostającego w fazie latentnej. Dochodzi do wzrostu rozprzestrzeniania się KSHV i promowania replikacji HIV, co dodatkowo napędza produkcję białka tat i pogorszenie zdolności do odpowiedzi immunologicznej. Białko tat powstałe w wyniku zakażenia HIV indukuje proliferację komórek śródbłonka, ponadto może wpływać na regulację w górę ekspresji genu litycznego vGPCR wirusa KSHV. Ponadto białko tat indukuje produkcję kilku metaloproteinaz, co przyczynia się do rozkładu macierzy pozakomórkowej, a w konsekwencji ułatwienia migracji oraz inwazji nowotworu. MMP-2 przyczynia się do promowania wzrostu komórek śródbłonka i angiogenezy. Związanie się białka tat z receptorami integryn α5β1 i αVβ3 zapewnia niezbędny sygnał umożliwiający proliferację w odpowiedzi na sygnały mitogenne.
Rozpoznanie
Podejrzenie mięsaka Kaposiego, szczególnie u chorych zakażonych HIV lub rozwijających AIDS, często jest stawiane na podstawie charakterystycznego obrazu klinicznego. Ostateczne rozpoznawanie jest ustalane na podstawie badania histopatologicznego materiału pobranego drogą biopsji.
Badania obrazowe w tym tomografia komputerowa, rezonans magnetyczny oraz metody endoskopowe takie jak bronchoskopia, gastroskopia i kolonoskopia pełnią funkcję pomocniczą w przypadku podejrzenia zajęcia trzewi. Nie ma konieczności poszerzania diagnostyki o badania obrazowe i endoskopowe, gdy nie ma objawów sugerujących zajęcie narządów wewnętrznych. W zdjęciu rentgenowskim klatki piersiowej mięsak Kaposiego może powodować zmiany siateczkowo-guzkowe, ogniskowe obszary wzmożonej konsolidacji lub nadmiernej powietrzności, mogą być widoczne cechy wysięku do opłucnej. W tomografii komputerowej klatki piersiowej mięsak Kaposiego może być uwidoczniony jako pogrubienie oskrzela lub spikularny guz w obrębie płuca. Mogą być widoczne powiększone węzły chłonne. Badania endoskopowe umożliwiają pobranie materiału tkankowego, który następnie jest wykorzystywany do oceny histopatologicznej. Podczas bronchoskopii zmiany w płucach mogą się uwidocznić jako fioletowe zmiany w tchawicy i oskrzelach. W diagnostyce zmian w przewodzie pokarmowym wykorzystywane są metody endoskopowe, które mogą wykazać obecność czerwonofioletowych zmian w przewodzie pokarmowym. Ze względu na położenie podśluzówkowe guza pobrane podczas badania endoskopowego biopsje mogą dać wynik fałszywie ujemny i konieczne jest wykonanie głębszej biopsji.
Badanie histopatologiczne materiału pozyskanego drogą biopsji umożliwia ostateczne potwierdzenie rozpoznania choroby. Samo rozpoznanie kliniczne, ze względu na trudności z różnicowaniem z podobnie przebiegającymi zmianami skórnymi, jest niewystarczające. Zastosowanie metod immunohistochemicznych znacznie ułatwia rozpoznanie mięsaka Kaposiego oraz poprawia czułość i swoistość tego badania.
Wykrywanie wirusa KSHV nie ma znaczenia praktycznego, bo choć wirus ma kluczowe znaczenie w patogenezie choroby, to nie wszyscy zakażeni rozwijają mięsaka Kaposiego i nie wszyscy chorzy z mięsakiem wykazują wiremię tego wirusa.
Zaawansowanie kliniczne
| Rokowanie dobre (0) | Rokowanie złe (1) | |
| Guz pierwotny (T) | Zmiany ograniczone do skóry lub węzłów chłonnych z lub bez minimalnych zmian w jamie ustnej | Choroba związana z obrzękiem, owrzodzeniem, masywnymi zmianami w jamie ustnej lub zajęciem narządów wewnętrznych |
| Układ immunologiczny (I) | Liczba komórek CD4+ >150/μl | Liczba komórek CD4+ <150/μl |
| Objawy ogólne (S) | Bez zakażeń oportunistycznych, stan sprawności >70% według Karnofsky’ego, bez objawów B (niewyjaśniona gorączka, utrata powyżej 10% masy ciała, poty nocne) | Zakażenia oportunistyczne, stan sprawności <70% według Karnofsky’ego, objawy B i inne choroby związane z zakażeniem HIV |
Leczenie
Leczenie mięsaka Kaposiego ma na celu kontrolę objawów choroby i uniemożliwienie jej progresji, jednak nie umożliwia całkowitego wyleczenia. Leczenie chirurgiczne ma na celu poprawę lokalnej kontroli choroby, w tym poprawę nasilenia objawów oraz wyglądu kosmetycznego zmian. Chemioterapia znajduje zastosowanie w leczeniu chorych z zajęciem narządów wewnętrznych lub szybką progresją choroby. Chemioterapia mięsaka Kaposiego jest oparta na liposomalnej doksorubicynie i taksanach. W przypadku mięsaka Kaposiego związanego z AIDS konieczne jest wdrożenie intensywnej terapii antyretrowirusowej (HAART). Z kolei u chorych z już włączonym leczeniem antyretrowirusowym konieczna jest weryfikacja skuteczności leczenia.
Leczenie mięsaka Kaposiego związanego z AIDS
Leczenie miejscowe
Mięsak Kaposiego jest chorobą wieloogniskową i postępowanie zabiegowe zwykle nie jest konieczne. Leczenie miejscowe jest przydatne w terapii lokalnych i objawowych zmian, a także w celu uzyskania efektu kosmetycznego. Ze względu na skuteczność leczenia antyretrowirusowego rola leczenia miejscowego w dużym stopniu uległa zmniejszeniu.
- Metody chirurgiczne
Małe zmiany mogą być chirurgicznie wycinane, poddane krioterapii, termoablacji i łyżeczkowaniu. Skuteczność metody ograniczają stosunkowo częste wznowy miejscowe.
- Wstrzyknięcia winblastyny
W leczeniu miejscowym zmian mogą być stosowane wstrzyknięcia winblastyny. W wyniku leczenia zmiany ulegają zblaknięciu i zmniejszeniu, ale zwykle nie ustępują całkowicie.
- Retinoidy
0,1% żel z alitretinoiną jest wykorzystywany w celu uzyskania kontroli miejscowej zmian. W dwóch badaniach u chorych otrzymujących HAART alitretinoina wywoływała odpowiedź u 37% oraz 35% leczonych tym lekiem, a placebo wywoływało odpowiedź odpowiednio u 7% i 18%.
- Radioterapia
Radioterapia ma na celu poprawę lokalnej kontroli choroby i łagodzeniu jej objawów. Jeśli jest taka konieczność, to metoda może być łączona z leczeniem ogólnoustrojowym (HAART z lub bez chemioterapii) i wówczas leczenie jest prowadzone sekwencyjnie. Korzyści z podania większej liczby mniejszych frakcji daje tylko niewielkie korzyści kliniczne i wiąże się z gorszą akceptacją chorych oraz wyższym kosztem.
HAART
Intensywna terapia antyretrowirusowa (HAART) powoduje zmniejszenie wiremii HIV i pozwala na odbudowę układu immunologicznego.
U części chorych sama terapia antyretrowirusowa i uzyskanie podwyższenia liczby limfocytów CD4+ i spadku wiremii HIV do poziomu nieoznaczalnego są wystarczające do uzyskania kontroli mięsaka Kaposiego. Chorzy na AIDS z rozwijającym się mięsakiem Kaposiego bez leczenia antyretrowirusowego, pomimo stosowania chemioterapii paliatywnej, mają złe rokowanie, a wprowadzenie do leczenia intensywnej terapii antyretrowirusowej wydatnie poprawiło rokowanie leczonych. Wszyscy zakażeni HIV powinni otrzymywać skuteczne leczenie antyretrowirusowe (HAART), ale nie jest jasne, którzy chorzy wymagają dołączenia do HAART chemioterapii. We wczesnych stadiach według ACTG podaje się HAART i poddaje się chorego obserwacji, w bardziej zaawansowanej chorobie obok HAART stosuje się chemioterapię. Wytyczne Światowej Organizacji Zdrowia (WHO) sugerują włączenie samodzielnego leczenia antyretrowirusowego bez chemioterapii u chorych ze zmianami w obrębie skóry lub węzłów chłonnych, bez objawowego zajęcia narządów wewnętrznych, bez istotnego zajęcia błony śluzowej jamy ustnej oraz bez obrzęków. Z kolei u chorych z objawowym zajęciem narządów wewnętrznych, z rozległymi objawowymi zmianami w obrębie błony śluzowej jamy ustnej lub obrzękami leczenie antyretrowirusowe jest włączane w połączeniu z chemioterapią.
W przypadku rozwoju mięsaka Kaposiego u chorego, który już otrzymuje HAART, konieczna jest weryfikacja skuteczności leczenia oraz współpracy chorego w przestrzeganiu zaleceń. Jeśli obserwuje się wzrost wiremii, spadek liczby limfocytów CD4+, oporność lub inne przesłanki sugerujące nieskuteczność leczenia antyretrowirusowego to poddaje się je modyfikacji.
U chorych we wczesnym stadium choroby (T0 według ACTG) regresja mięsaka Kaposiego związanego z AIDS może być rezultatem samodzielnego leczenia antyretrowirusowego. W tym stadium 80% leczonych samym HAART osiąga remisję z medianą 3–9 miesięcy czasu odpowiedzi. W badaniu na 175 chorych na wczesnym etapie (T0) mięsaka Kaposiego związanego z AIDS z czteroletnią medianą obserwacji 90% leczonych HAART nie wymagała włączenia chemioterapii, która była konieczna głównie w przypadku współwystępowania chłoniaka lub wieloogniskowej choroby Castelmana. W badaniach klinicznych zaobserwowano, że u chorych zakażonych HIV z mięsakiem Kaposiego leczenie antyretrowirusowe dodane do leczenia miejscowego lub chemioterapii wpływa na wydłużenie mediany czasu wolnego od niepowodzenia leczenia. Wykazano, że leczenie antyretrowirusowe wpływa na wydłużenie przeżycia u chorych leczonych chemioterapią.
Leczenie antyretrowirusowe jednocześnie jest metodą zapobiegania mięsaka Kaposiego, ponieważ u zakażonych HIV zmniejsza ono ryzyko rozwoju mięsaka Kaposiego. Nie jest jasne czy leczenie antyretrowirusowe zmniejsza prawdopodobieństwo zachorowania przez zwiększenie ilości limfocytów CD4+ czy poprzez bezpośredni efekt na wirus KSHV (HHV-8).
W związku z włączeniem HAART objawy AIDS mogą ulec paradoksalnemu przejściowemu pogorszeniu, co jest związane z zespołem rekonstrukcji immunologicznej (IRIS). Zespół dotyczy głównie zakażeń oportunistycznych, jednak może zaznaczać się również w przebiegu wcześniej istniejącego mięsaka Kaposiego jako jego nagła kliniczna progresja lub nawet pojawienie się nowych zmian. Leczenie w przypadku progresji mięsaka Kaposiego po włączeniu HAART polega na dołączeniu chemioterapii.
Chemioterapia
Mięsak Kaposiego jest nowotworem chemiowrażliwym. Chemioterapia jest włączana do leczenia u chorych z rozległym zajęciem skóry lub błon śluzowych, objawowym zajęciem narządów wewnętrznych, szybką progresją choroby oraz obecnością znacznego obrzęku. U wszystkich chorych z guzem T1 zaleca się rozpoczęcie chemioterapii w połączeniu z HAART. W pierwszej linii leczenia podaje się antracykliny – liposomalną doksorubicynę lub liposomalną daunoubicynę, w drugiej linii leczenia podaje się paklitaksel. Monoterapia liposomalną antracykliną czy paklitakselem w porównaniu do programów wielolekowych takich jak ABV (doksorubicyna, bleomycyna i winkrystyna) nie wiąże się z ryzykiem zakażeń oportunistycznych, a ponadto liposomalna doksorubicyna częściej niż ABV prowadzi do remisji mięsaka Kaposiego.
- Liposomalne antracykliny
Liposomalna doksorubicyna jest lekiem z wyboru w chemioterapii zaawansowanego mięsaka Kaposiego. Liposomalne antracykliny w porównaniu do konwencjonalnych antracyklin wykazują lepszy profil toksyczności i lepsze właściwości farmakokinetyczne. Całkowitą (CR) lub częściową remisję (PR) osiąga około 60% leczonych doksorubicyną, nieco niższe odsetki odpowiedzi wywołuje daunorubicyna.
W badaniu klinicznym porównywano skuteczność liposomalnej doksorubicyny z programem ABV złożonym z doksorubicyny, bleomycyny i winkrystyny i wykazano wyższy odsetek odpowiedzi u leczonych liposomalną doksorubicyną. Podobnie u leczonych liposomalną doksorubicyną stwierdzono wyższy odsetek odpowiedzi w porównaniu do połączenia bleomycyny i winkrystyny w programie BV. W badaniu porównującym skuteczność liposomalnej daunorubicyny z programem ABV zawierającym doksorubicynę, bleomycynę i winkrystynę zaobserwowano porównywalną skuteczność obu metod pod względem odsetka odpowiedzi oraz przeżycia całkowitego. W niewielkim badaniu na 80 chorych porównano skuteczność liposomalnej doksorubicyny z liposomalną daunorubicyną, odsetki odpowiedzi były wyższe dla liposomalnej doksorubicyny, choć te różnice nie osiągnęły istotności statystycznej.
- Taksany
W kilku badaniach oceniono aktywność paklitakselu w monoterapii. W badaniu porównującym skuteczność w kontroli objawów choroby paklitakselu i liposomalnej doksorubicyny nie wykazano istotnej przewagi żadnego leku w zakresie odsetka odpowiedzi, mediany przeżycia wolnego od progresji choroby i odsetka przeżyć dwuletnich, ale paklitaksel częściej wywoływał poważną toksyczność. U chorych otrzymujących HAART z progresją na antracyklinach, którzy otrzymali paklitaksel w drugiej linii leczenia nie stwierdzono wpływu tej chemioterapii na ilość komórek CD4+, CD8+ i CD16+/CD56+ oraz na poziom wiremii HIV. Sugeruje to, że łączne stosowanie taksanów i HAART redukuje ryzyko infekcji oportunistycznych związanych z chemioterapią. Dane dotyczące skuteczności i bezpieczeństwa docetakselu są ograniczone. Małe badania sugerują jego skuteczność, jednak istnieją doniesienia o znacznej toksyczności, gdy lek jest łączony z ritonawirem.
Immunoterapia
Interferon nie powinien być stosowany u chorych z zajęciem narządów wewnętrznych ani w chorobie progresywnej. Metoda jest rzadko stosowana u chorych z resztkowym mięsakiem Kaposiego, którzy w trakcie leczenie HAART uzyskali rekonstrukcję układu immunologicznego. Metoda była oceniana w badaniach klinicznych przed upowszechnieniem HAART oraz liposomalnych antracyklin. U chorych z klasycznym mięsakiem Kaposiego interferon alfa porównano z liposomalną doksorubicyną stwierdzono lepszą odpowiedź i lepszy profil toksyczności u chorych leczonych liposomalną doksorubicyną
Leczenie postaci klasycznej
Mięsak Kaposiego wykazuje znaczną wrażliwość na radioterapię. Radioterapia umożliwia lokalną kontrolę choroby, jednak stosunkowo częste są nawroty w sąsiednich nienaświetlanych polach. W leczeniu pojedynczych zmian stosuje się frakcjonowane dawki 4–8 Gy do łącznej dawki 20–32 Gy. W dużych zmianach z obrzękiem lub zajęciem węzłów chłonnych leczenie jest prowadzone w konwencjonalnym frakcjonowaniu po 2 Gy do łącznej dawki 40 Gy. W badaniu na 16 chorych radioterapia wywoływała całkowitą odpowiedź u 88% leczonych.
Leczenie chirurgiczne jest opcją terapeutyczną dla chorych z niewielkimi zmianami. W leczeniu miejscowym znajdują również zastosowanie iniekcje do zmiany bleomycyny lub winblastyny, stosuje się również inferferon oraz retinoidy.
W przypadku szybko postępującej choroby, bolesnych, owrzodziałych, naciekających zmian, powodujących znaczny obrzęk lub zniekształcenie kończyn oraz zajęcia narządów wewnętrznych stosuje się chemioterapię. W pierwszej linii leczenia stosuje się liposomalną doksorubicynę. W badaniu na 55 chorych lek wywoływał odpowiedź u 70% leczonych. Niewielkie badania sugerują wysoką aktywność taksanów. Zastosowanie w leczeniu znajduje również winblastyna.
Leczenie postaci jatrogennej
Przerwanie i redukcja natężenia immunosupresji może prowadzić do spontanicznych i trwałych remisji. U chorych, u których nie można zakończyć immunosupresji, zmiany mogą być poddane radioterapii. U niektórych chorych po przeszczepie narządów, otrzymujących cyklosporynę, możliwa jest zmiana leczenia na sirolimus będącego inhibitorem mTOR wykazującym działanie antyangiogenne. W przypadku zmian narządowych wykorzystuje się chemioterapię, ale nie ma randomizowanych badań oceniających skuteczność leczenia w tym podtypie mięsaka Kaposiego.
Rokowanie
W dużym europejskim wieloośrodkowym badaniu zaobserwowano 74,9% odsetek przeżycia pięcioletniego. Przeżycie jest lepsze w przypadku lokalizacji zmian w obrębie skóry, gdzie 75,5% osiąga pięcioletnie przeżycie, z kolei lokalizacja zmian w układzie oddechowym oraz przewodzie pokarmowym wpływa na gorsze przeżycie chorych, gdzie przeżycie pięcioletnie wynosi odpowiednio 50,4% oraz 25,3%.
Historia
Chorobę w 1872 roku opisał węgierski dermatolog Moritz Kaposi. W 1882 roku Tommaso de Amicis opublikował serię 12 chorych na mięsaka Kaposiego. W latach 80. XX wieku zaobserwowano asocjację pomiędzy mięsakiem Kaposiego a AIDS. W 1994 roku odkryto kluczową rolę wirusa KSHV w patogenezie choroby.
Bibliografia
- John R. Goldblum, Sharon W. Weiss, Andrew L. Folpe: Enzinger and Weiss’s Soft Tissue Tumors. Wyd. 6. Elsevier Health Sciences, 2013. ISBN 978-0-323-08834-3.
- Christopher D.M. Fletcher, K. Krishnan Unni, Fredrik Mertens: Pathology and Genetics of Tumours of Soft Tissue and Bone. Lyon: IARC Press, 2002.
- Murray F. Brennan, Cristina R. Antonescu, Robert G. Maki: Management of Soft Tissue Sarcoma. Springer Science & Business Media, 2012.
- Jerzy Stachura, Domagała Wenancjusz: Patologia znaczy słowo o chorobie. T. II. Polska Akademia Umiejętności, 2009. ISBN 978-83-60184-02-8.
- Piotr Rutkowski: Biblioteka chirurga onkologa. Mięsaki tkanek miękkich. Via Medica, 2015. ISBN 978-83-7599-864-1.
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Piotr Rutkowski, Zbigniew Nowecki: Mięsaki tkanek miękkich u dorosłych. Medical Tribune, 2009. ISBN 978-83-60135-69-3.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Jason L. Hornick: Practical Soft Tissue Pathology: A Diagnostic Approach: A Volume in the Pattern Recognition Series. Elsevier Health Sciences, 2013. ISBN 978-1-4557-3814-4.













