- 1,3-Bisfosfoglicerynian
- Adenozyno-5′-difosforan
- Adenozyno-5′-trifosforan
- Aerob
- Oksydaza alternatywna
- Oddychanie beztlenowe
- Syntaza ATP
- Beta-oksydacja
- Oddychanie komórkowe
- Chemiosmoza
- Cykl kwasu cytrynowego
- Ubichinon
- Cytochrom bc1
- Cytochrom c
- Oksydaza cytochromu c
- Gradient elektrochemiczny
- Anaerob fakultatywny
- Dekarboksylaza glicyny
- Kwas jabłkowy
- Methemoglobina
- Mitochondrium
- Dinukleotyd nikotynoamidoadeninowy
- Fosforylacja oksydacyjna
- Reakcja pomostowa
- Kompleks dehydrogenazy pirogronianowej
- Kwas pirogronowy
- Cykl Q
- Termogenina
Oddychanie komórkowe
Oddychanie komórkowe – wielostopniowy biochemiczny proces utleniania związków organicznych związany z wydzieleniem energii użytecznej metabolicznie. Oddychanie przebiega w każdej żywej komórce w sposób stały. Zachodzi ono nawet wtedy, gdy inne procesy metaboliczne zostaną zahamowane. Chociaż istnieją różnice w przebiegu procesu oddychania u poszczególnych grup organizmów, to zestaw enzymów katalizujących poszczególne reakcje składające się na oddychanie jest zbliżony u wszystkich organizmów żywych. Zachodzenie oddychania jest jednym z najczęściej stosowanych wskaźników zachodzenia procesów życiowych. Jedynie wirusy będące strukturami na pograniczu życia i cząstek chemicznych nie przeprowadzają procesu oddychania.
Chociaż substratem w reakcji oddychania mogą być wszystkie związki organiczne obecne w komórkach, najczęściej ogólną reakcję oddychania komórkowego zapisuje się dla utleniania cukru – glukozy w obecności tlenu:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Energia uwolniona w procesie utleniania związków organicznych pojawia się częściowo w postaci związku wysokoenergetycznego – ATP, który może być wykorzystany do przeprowadzania reakcji chemicznych zachodzących w komórce lub do poruszania organizmu np. w tkance mięśniowej. Proces produkcji ATP nie przebiega ze 100% sprawnością i część energii uwalniana jest w postaci ciepła.
Poza węglowodanami organizmy w procesie oddychania mogą utleniać tłuszcze oraz białka, a po bardziej złożonych modyfikacjach także pozostałe związki organiczne.

Dla najczęściej używanego substratu, glukozy, reakcje oddychania komórkowego zachodzą na trzech szlakach metabolicznych:
- Glikoliza, w której glukoza przekształcana jest do kwasu pirogronowego i powstają niewielkie ilości ATP oraz NADH.
- Cykl Krebsa określany także cyklem kwasu cytrynowego lub cyklem kwasów trikarboksylowych, w którym kwas pirogronowy po przekształceniu do acetylo-CoA w cyklu przemian przekształcany jest do CO2 z wytworzeniem NADH, FADH2 oraz GTP lub ATP.
- Oddychanie końcowe, czyli mitochondrialny łańcuch transportu elektronów i fosforylacja oksydacyjna. W tym etapie zredukowane nukleotydy NADH, FADH2 są utleniane. W efekcie szeregu reakcji powstaje woda, a uwalniana energia zamieniana jest na ATP.
Pierwszy z wymienionych etapów jest charakterystyczny dla utleniania węglowodanów i zachodzi w cytozolu. Dwa pozostałe etapy zachodzą u organizmów eukariotycznych w wyspecjalizowanych organellach – mitochondriach. W komórkach prokariontów enzymy biorące udział we wszystkich etapach oddychania znajdują się w cytozolu i błonie komórkowej.
Tłuszcze oraz białka mogą być także włączane w cykl Krebsa. Wcześniej jednak tłuszcze rozkładane są do acetylo-CoA w procesie β-oksydacji, a białka muszą być rozłożone na aminokwasy, te zaś pozbawione reszty aminowej. Powstałe po odłączeniu reszty aminowej ketokwasy włączane są bezpośrednio lub po przekształceniu w reakcje glikolizy i cyklu kwasu cytrynowego.
U organizmów, które stale lub okresowo nie mają dostępu do tlenu, uwalnianie energii użytecznej biologicznie może polegać na niepełnym utlenieniu związków organicznych. Proces taki nazywany jest fermentacją. W efekcie fermentacji związki organiczne ulegają zarówno utlenianiu, jak i redukcji.
Drugim sposobem uzyskania energii w warunkach beztlenowych jest utlenianie związków organicznych z wykorzystaniem utlenionych związków nieorganicznych np. azotanów, siarczanów, związków żelaza lub manganu, a nawet dwutlenku węgla. Związki te służą jako akceptory elektronów w łańcuchu transportu elektronów zbliżonym do łańcucha oddechowego zachodzącego przy przenoszeniu elektronów na tlen. Pozostałe etapy oddychania nie różnią się od oddychania tlenowego.
Oba procesy zachodzące w warunkach beztlenowych mogą być określane jako oddychanie beztlenowe, jednak w mikrobiologii terminem oddychania beztlenowego określa się jedynie wykorzystywanie związków nieorganicznych w roli utleniacza. Fermentacje są traktowane jako oddzielna grupa procesów metabolicznych prowadzących do uzyskania energii użytecznej metabolicznie.
Oddychanie komórkowe glukozą
Glikoliza
Pierwszy etap utleniania heksoz zachodzi w cytozolu i jest określany nazwą glikoliza lub szlak Embdena-Meyerhofa-Parnasa. Najczęściej na szlak glikolityczny wchodzi glukoza, która może powstawać z rozkładu cukrów zapasowych np. skrobi lub glikogenu. Jednak inne cukry sześciowęglowe mogą także łatwo wziąć udział w glikolizie. Dekstroza (jak i inne heksozy) są do niego włączane dzięki fosforylacji.

W pierwszym etapie glikolizy glukoza lub inna heksoza ulega fosforylacji. Reakcję tę przeprowadza enzym – heksokinaza [EC 2.7.1.1], zużywając cząsteczkę ATP. Powstała cząsteczka glukozo-6-fosforanu przekształcana jest do fruktozo-6-fosforanu przez izomerazę heksozofosforanową [EC 5.3.1.9]. Reakcja ta jest odwracalna. W podobny sposób do fruktozo-6-fosforanu mogą być przekształcane inne fosfoheksozy. Fruktoza, która jest produktem rozkładu często występującego u roślin cukru zapasowego, sacharozy, jest przekształcana bezpośrednio do fruktozo-6-fosforanu poprzez przyłączenie reszty fosforanowej z ATP przez fruktokinazę. Wytworzony fruktozo-6-fosforanu ulega fosforylacji w pozycji 1 katalizowanej przez 1-fosfofruktokinazę (ATP-fosfofruktokinazę) [EC 2.7.1.11], co prowadzi do powstania fruktozo-1,6-bisfosforanu. Podobnie jak przy fosforylacji glukozy zużywana jest cząsteczką ATP, a reakcja jest nieodwracalna. W komórkach roślinnych przekształcenie fruktozo-6-fosforanu do fruktozo-1,6-bisfosforanu może być także przeprowadzane przez 1-fosfotransferazę pirofosforan – fruktozo-6-fosforan (PP-fosfofruktodikinaza). W tym przypadku reszta fosforanowa pochodzi z pirofosforanu, a reakcja jest odwracalna. Aktywność PP-fosfofruktodikinazy jest większa w tkankach intensywnie rosnących. W komórkach o stosunkowo wolnym metabolizmie przeważa aktywność ATP-fosfofruktokinazy. Powstały fruktozo-1,6-bifosforan jest rozkładany na dwie cząsteczki: aldehyd 3-fosfoglicerynowy i fosfodihydroksyaceton. Reakcję katalizuje aldolaza fruktozobisfosforanowa [EC 4.1.2.13]. Powstanie dwóch trioz jest końcem pierwszego etapu glikolizy.
W drugim etapie aldehyd 3-fosfoglicerynowy zostaje utleniony do 1,3-bisfosfoglicerynianu. Reakcję tę katalizuje dehydrogenaza aldehydu 3-fosfoglicerynowego [EC 1.2.1.12]. Energia wyzwolona podczas utleniania aldehydu 3-fosfoglicerynowego wystarcza do zredukowania cząsteczki NAD+ do NADH oraz ufosforylowania powstającego kwasu 1,3-bisfosfoglicerynowego przez przyłączenie fosforanu nieorganicznego. Fosfodihydroksyaceton także wchodzi w opisaną reakcję, po odwracalnym przekształceniu do aldehydu 3-fosfoglicerynowego przez izomerazę triozofosforanową [EC 5.3.1.1]. Kwas 1,3-bisfosfoglicerynowy traci jedną z grup fosforanowych, przekazując ją na ADP. Reakcję przeniesienia fosforanu na ADP przeprowadza kinaza fosfoglicerynianowa [EC 2.7.2.3], co prowadzi do powstania cząsteczki ATP (fosforylacja substratowa) oraz 3-fosfoglicerynianu. Związek ten może być łatwo przekształcony do 2-fosfoglicerynianu w odwracalnej reakcji katalizowanej przez mutazę fosfoglicerynianu [EC 5.4.2.1]. 2-fosfoglicerynian w kolejnej odwracalnej reakcji zostaje przekształcony w fosfoenolopirogronian (PEP) przez enolazę [EC 4.2.1.11], która odłącza cząsteczkę wody. Energia zawarta w fosfoenolopirogronianie zostaje wykorzystana do syntezy kolejnej cząsteczki ATP w ostatniej reakcji nieodwracalnej glikolizy katalizowanej przez enzym, kinazę pirogronianową [EC 2.7.1.40], której efektem działania jest powstanie ostatecznego produktu glikolizy: pirogronianu.
W efekcie zachodzenia szlaku glikolitycznego jedna cząsteczka glukozy przekształcana jest do dwóch cząsteczek pirogronianu, zużywane są dwie cząsteczki ATP, a powstają 2 cząsteczki NADH oraz 4 cząsteczki ATP. Powstające w procesie glikolizy ATP jest efektem przenoszenia reszty fosforanowej z substratu na ADP przez odpowiednie enzymy i nosi nazwę fosforylacji substratowej.
Oksydacyjny szlak pentozofosforanowy i jego powiązania z glikolizą

Glukoza może zostać utleniona także inną drogą niż opisana wyżej glikoliza. W cytozolu komórki glukoza może zostać przekształcona w rybulozo-5-fosforan w oksydacyjnym szlaku pentozofosforanowym. Metabolity tego szlaku są wspólne z metabolitami glikolizy, dzięki czemu zwiększa się ilość glukozy utlenianej w ogólnym metabolizmie oddechowym.
Podobnie jak w glikolizie, pierwsza reakcja polega na ufosforylowaniu glukozy w pozycji 6. Powstały glukozo-6-fosforan przekształcany jest do 6-fosfoglukonolaktonu przez dehydrogenazę glukozo-6-fosforanu [EC 1.1.1.49]. W reakcji tej redukcji ulega cząsteczka NADP+ i powstaje NADPH. 6-fosfoglukonolakton przekształcany jest do 6-fosfoglukonianu poprzez przyłączenie cząsteczki H2O przez laktonazę 6-fosfoglukonianu [EC 3.1.1.31]. Powstały 6-fosfoglukonian zostaje przekształcony do związku pięciowęglowego poprzez dekarboksylację przy jednoczesnej redukcji kolejnej cząsteczki NADP+ do NADPH. Reakcję przeprowadza dehydrogenaza 6-fosfoglukonianu [EC 1.1.1.43], a powstaje w niej rybulozo-5-fosforan. Opisany szereg reakcji określany jest jako faza oksydacyjna szlaku pentozofosforanowego.
W kolejnych reakcjach rybulozo-5-fosforan może zostać przekształcony do związków włączanych w glikolizę. Z rybulozo-5-fosforanu powstaje rybozo-5-fosforan, w reakcji katalizowanej przez izomerazę rybozo-5-fosforanu [EC 5.3.1.6], lub ksylulozo-5-fosforan w reakcji katalizowanej przez epimerazę rybulozo-5-fosforanu [EC 5.1.3.1]. Poprzez przenoszenie fragmentów łańcucha węglowego pomiędzy rybozo-5-fosforanem a ksylulozo-5-fosforanem powstaje sedoheptulozo-7-fosforan oraz aldehyd 3-fosfoglicerynowy. Reakcje przeprowadza transketolaza [EC 2.2.1.1], enzym przenoszący dwuwęglowy fragment z ketozy na aldozę. Aldehyd 3-fosfoglicerynowy oraz sedoheptulozo-7-fosforan biorą udział w kolejnej reakcji przeprowadzanej przez transaldolazę [EC 2.2.1.2], w wyniku której powstają fruktozo-6-fosforan i erytrozo-4-fosforan. Oba wytworzone związki mogą zostać przekształcone przez transketolazę do aldehydu 3-fosfoglicerynowego i ksylulozo-5-fosforanu.
Dwa spośród metabolitów opisanych przekształceń są jednocześnie związkami biorącymi udział w glikolizie i mogą być w nią włączane. Są to aldehyd 3-fosfoglicerynowy oraz fruktozo-6-fosforan.
Dekarboksylacja pirogronianu
Powstały w glikolizie pirogronian w komórkach eukariotycznych jest transportowany do matriks mitochondrialnej przez przenośnik znajdujący się w błonie mitochondrialnej. W matriks mitochondrialnej pirogronian jest oksydacyjnie dekarboksylowany przez kompleks enzymatyczny dehydrogenazy pirogronianowej. W jego skład wchodzi wiele kopii pięciu różnych enzymów. Są to dehydrogenaza pirogronianowa (PDH) [EC 1.2.4.1], acetylotransferaza dihydrolipoamidowa [EC 2.3.1.12] i dehydrogenaza dihydrolipoamidowa [EC 1.8.1.4] przekształcające pirogronian do acetylo-CoA oraz kinaza dehydrogenazy pirogronianowej i fosfataza P-PDH, które poprzez odwracalną fosforylację dehydrogenazy pirogronianowej regulują aktywność całego kompleksu. Cała reakcja przebiega według równania:
pirogronian + CoA + NAD+ → Acetylo-CoA + NADH + CO2 + H+
Jednocześnie z dekarboksylacją, która prowadzi do powstania cząsteczki CO2, redukcji ulega jedna cząsteczka NAD+, a dwuwęglowy fragment łańcucha pirogronianu przenoszony jest na koenzym A.
Dostarczanie substratów do cyklu Krebsa w mitochondriach roślin
Transport pirogronianu przez przenośnik pirogronianowy jest głównym sposobem jego dostarczenia do mitochondriów. W komórkach roślinnych istnieje także drugi sposób dostarczenia do matriks mitochondrialnej kluczowego dla dalszych etapów oddychania zawiązku. Pirogronian może być wytwarzany w matriks przez dehydrogenazę jabłczanową dekarboksylującą, nazywaną także enzymem jabłczanowym. Enzym ten przeprowadza reakcję dekarboksylacji jabłczanu, co wiąże się ze zredukowaniem cząsteczki NAD+. Jabłczan do mitochondriów dostarczany jest przez przenośnik kwasów dikarboksylowych z cytozolu, gdzie powstaje z fosfoenolopirogronianu będącego metabolitem glikolizy. Fosfoenolopirogronian przekształcany jest karboksylazę fosfoenolopirogronianu do szczawiooctanu poprzez przyłączenie cząsteczki CO2. Powstały szczawiooctan redukowany jest do jabłczanu przez dehydrogenazę jabłczanową i zużywającą do redukcji NADH obecny w cytozolu. Przenoszenie jabłczanu przez wewnętrzną błonę mitochondrialną dostarcza pirogronianu dla kompleksu dekarboksylazy pirogronianu lub też jabłczan jest bezpośrednio włączany w cykl Krebsa. Istotne jest przeniesienie w postaci jabłczanu także siły redukcyjnej (NADH) odtwarzanej przez enzym jabłczanowy w matriks. Enzym jabłczanowy może również dekarboksylować jabłczan wytwarzany w cyklu Krebsa tworząc alternatywny cykl metaboliczny.
Cykl Krebsa
Powstały na skutek dekarboksylacji pirogronianu acetylo-CoA jest substratem dla kolejnego etapu oddychania: cyklu Krebsa – szeregu reakcji biochemicznych zachodzących w macierzy mitochondrialnej. W reakcjach tych ze związków organicznych wytwarzany jest CO2 oraz związki wysokoenergetyczne w postaci NADH, FADH2 oraz GTP lub ATP.
W pierwszej reakcji reszta acylowa z acetylo-CoA przyłączana jest do cząsteczki szczawiooctanu przez enzym syntazę cytrynianową [EC 2.3.3.1]. W wyniku tej reakcji powstaje cząsteczka cytrynianu oraz odtwarzany jest koenzym A. Cytrynian przekształcany jest do izocytrynianu przez akonitazę [EC 4.2.1.3]. Reakcja ta jest odwracalna, a jej produktem pośrednim jest cis-akonitan – związany z cząsteczka enzymu. Izocytrynian zawierający sześć atomów węgla ulega kolejno utlenieniu i dekarboksylacji przeprowadzanej przez dehydrogenazę izocytrynianową [EC 1.1.1.42]. W wyniku tej reakcji powstaje cząsteczka α-ketoglutaranu, określanego także 2-oksoglutaranem, cząsteczka CO2 oraz NAD+ jest redukowany do NADH. Pięciowęglowy α-ketoglutaran (2-oksoglutaran) ulega kolejnej dekarboksylacji przeprowadzanej przez kompleks enzymatyczny dehydrogenazy α-ketoglutaranowej [EC 1.2.4.2]. W tej reakcji również powstaje CO2 i ulega redukcji kolejna cząsteczka NAD+, a czterowęglowy produkt zostaje przeniesiony na koenzym A, tworząc bursztynylo-CoA. Powstały bursztynylo-CoA rozkładany jest na bursztynian i cząsteczkę koenzymu A, w wyniku reakcji hydrolizy. Reakcję tę katalizuje syntetaza bursztynylo-CoA, a energia wyzwalana podczas reakcji pozwala ufosforylować cząsteczkę GDP do GTP w mitochondriach części zwierząt [EC 6.2.1.4] lub ADP do ATP w mitochondriach pozostałych organizmów [EC 6.2.1.5]. Podobnie jak w glikolizie, GTP lub ATP powstaje na drodze fosforylacji substratowej. W kolejnej (odwracalnej) reakcji bursztynian ulega dehydrogenacji przeprowadzanej przez dehydrogenazę bursztynianową [EC 1.3.5.1] – jedyny enzym cyklu, który nie jest białkiem rozpuszczalnym, lecz osadzonym w wewnętrznej błonie mitochondrialnej, zawierającym grupę prostetyczną w postaci FAD. Podczas przekształcania bursztynianu do fumaranu dinukleotyd flawinoadeninowy ulega redukcji, przechodząc w FADH2. Fumaran ulega przekształceniu do jabłczanu poprzez przyłączenie cząsteczki H2O katalizowane przez fumarazę [EC 4.2.1.2]. Z jabłczanu odtwarzany jest pierwszy związek cyklu – szczawiooctan. Reakcję katalizuje dehydrogenaza jabłczanowa [EC 1.1.1.37]. Powstaje w niej ostatnia, trzecia, cząsteczka NADH wytwarzana w jednym obrocie cyklu. Dwie ostatnie reakcje są odwracalne, a powstały szczawiooctan może przyłączyć kolejną resztę acylową.

W wyniku jednego obrotu cyklu reszta acylowa zostaje przekształcona do dwóch cząsteczek CO2, a jednocześnie energia wiązań chemicznych przeniesiona zostaje na trzy cząsteczki NADH, jedną cząsteczkę FADH2 oraz cząsteczkę GTP lub ATP. W celu włączenia dwóch reszt acylowych powstałych z cząsteczki glukozy w procesie glikolizy cykl Krebsa musi zajść dwukrotnie.
Mitochondrialny łańcuch transportu elektronów i fosforylacja oksydacyjna
Powstałe w cyklu Krebsa zredukowane nukleotydy NADH i FADH2 mogą zostać utlenione na kompleksach enzymatycznych wchodzących w skład łańcucha oddechowego, a energia zostaje zgromadzona w postaci gradientu elektrochemicznego. W procesie określanym fosforylacją oksydacyjną energia gradientu elektrochemicznego służy do syntezy ATP. Reakcje łańcucha oddechowego zachodzą na kilku kompleksach białkowych będących elementami wewnętrznej błony mitochondriów. W efekcie utleniania NADH i FADH2 protony z matriks mitochondrialnej przenoszone są do przestrzeni międzybłonowej. Energia zgromadzona w postaci gradientu stężeń protonów i różnicy potencjału, określana nazwą potencjału elektrochemicznego, wykorzystana jest do wytwarzania ATP.
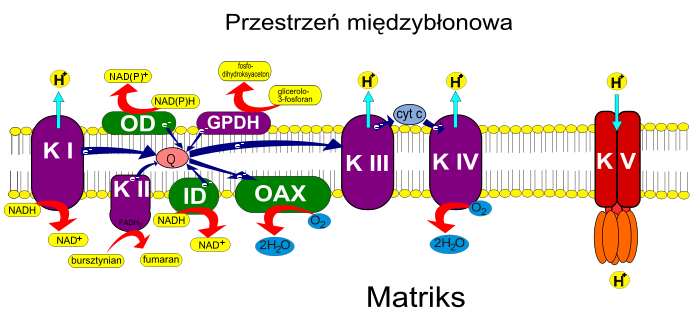
Kompleks I nazywany dehydrogenazą NADH [EC 1.6.5.3] pobiera elektrony z NADH znajdującego się w macierzy mitochondrialnej i przekazuje je na ubichinon – chinon, który ze względu na swój hydrofobowy charakter może swobodnie przemieszczać się w błonie mitochondrialnej. Ubichinon po przyjęciu dwóch elektronów pobiera z matriks mitochondrialnej dwa protony i przechodzi w swoją zredukowaną formę – ubichinol. W skład kompleksu I wchodzi kilka przenośników elektronów, w tym mononukteotyd flawinowy (FMN) oraz kilka białek z centrami żelazo-siarkowymi. NADH może być utleniane przez kompleks I jedynie w matriks mitochondrialnym, gdyż tylko po tej stronie białko kompleksu posiada miejsce wiązania NADH. Podczas utleniania NADH protony z matriks mitochondrialnej przenoszone są do przestrzeni międzybłonowej. Przejściu dwóch elektronów z NADH na ubichonon towarzyszy przeniesienie czterech protonów z matriks do przestrzeni międzybłonowej.
Kompleks II to jeden z enzymów cyklu Krebsa – dehydrogenaza bursztynianowa [EC 1.3.5.1] zawierająca kilka centrów żelazo-siarkowych oraz dinukleotyd flawinoadeninowy redukowany podczas przekształcania bursztynianu w fumaran. Elektrony ze zredukowanego FADH2 podobnie jak w przypadku kompleksu I przekazywane są za pośrednictwem centrów Fe-S na ubichinon, który ulega redukcji do ubichinolu. Kompleks II nie jest białkiem transbłonowym i nie posiada zdolności do przenoszenia protonów przez wewnętrzną błonę.
Zredukowany na kompleksie I lub II ubichinon (ubichinol) przemieszcza się w błonie mitochondrialnej do kompleksu III łańcucha oddechowego nazywanego kompleksem bc1 lub oksydoreduktazą ubichinon-cytochrom c [EC 1.10.2.2]. Kompleks ten zawiera dwa cytochromy b, białko Rieskiego oraz cytochrom c1. Na kompleksie III zachodzi cykl Q, w wyniku którego dodatkowe protony przemieszczane są z matriks do przestrzeni międzybłonowej. Elektrony ze zredukowanego ubichinonu przenoszone są na cytochrom c – niewielkie hydrofilowe białko znajdujące się po stronie przestrzeni międzybłonowej, które po zredukowaniu na kompleksie III przenosi elektrony na kompleks IV.
Kompleks IV to oksydaza cytochromowa [EC 1.9.3.1], która obiera elektrony od cytochromu c i przekazuje je na cząsteczkę O2. Po przeniesieniu 4 elektronów z macierzy mitochondrialnej pobierane są 4 protony i powstają dwie cząsteczki H2O. Oksydaza cytochromowa składa się z 13 podjednostek, zawiera także dwa hemy A i trzy jony miedzi ulokowane w centrach miedziowych. Cząsteczka O2 przyłączana jest do zredukowanego żelaza hemu. Dostarczenie trzech elektronów przez cytochrom c powoduje rozerwanie cząsteczki tlenu na grupę ferrytową przy hemie Fe4+=O i grupę —OH związaną z jonem Cu2+. Czwarty elektron redukuje grupę ferrytową do Fe3+—OH. Obie grupy OH po przyłączeniu protonów przekształcają się w dwie cząsteczki wody. Wszystkie cztery protony pobierane są z matriks, zwiększając gradient protonowy. Cztery protony są przez kompleks IV przenoszone do przestrzeni międzybłonowej, w efekcie z matriks mitochondrialnej ubywa osiem protonów.
W wyniku przenoszenia elektronów pomiędzy kompleksami I-IV jony H+ przenoszone są z matriks mitochondrialnej do przestrzeni międzybłonowej. Zgromadzoną w tej postaci energię wykorzystuje kompleks V (tzw. czynnik sprzęgający), czyli syntaza ATP [EC 3.6.3.14] składająca się z dwóch elementów: podjednostki F0 stanowiącej kanał jonowy oraz podjednostki F1 znajdującej się po stronie matriks przyłączającej do cząsteczki ADP fosforan nieorganiczny, wykorzystując energię potencjału elektrochemicznego. Wytworzenie jednej cząsteczki ATP wymaga przejścia do matriks 3,33 protonów.
Włączanie cytozolowego NADH do łańcucha oddechowego
Na opisanych powyżej kompleksach łańcucha transportu elektronów utlenione może być NADH+ wytworzone w matriks mitochondrialnym. Wewnętrzna błona mitochondrialna nie przepuszcza jednak dla większości substancji chemicznych. Nie jest więc możliwe proste przeniesienie NADH powstałego w procesie glikolizy do wnętrza mitochondriów i jego utlenienie. Zwierzęta rozwiązały ten problem na dwa sposoby.
Pierwszy z nich polega na użyciu NADH do redukcji fosfodihydroksyacetonu, jednego z metabolitów glikolizy. Fosfodihydroksyaceton redukowany jest przez cytozolową dehydrogenazę glicerolo-3-fosforanu do glicerolo-3-fosforanu. Związek ten w przestrzeni międzybłonowej utleniany jest przez białko leżące na zewnątrz wewnętrznej błony mitochondrialnej o podobnej budowie jak kompleks II łańcucha oddechowego – mitochondrialną dehydrogenazę glicerolo-3-fosforanu odtwarzającą fosfodihydroksyaceton przy jednoczesnej redukcji grupy prostetycznej mitochondrialnej dehydrogenazy. Powstały FADH2 oddaje elektrony na chinon z puli błonowej. Dalsze losy elektronów są takie jak w klasycznym łańcuchu oddechowym. Redukcja NADH przez mitochondrialną dehydrogenazę glicerolo-3-fosforanu omija kompleks I, stąd ilość protonów przenoszonych przez błonę przy tej drodze utleniania NADH cytozolowego jest mniejsza, a tym samym sposobem powstaje mniej cząsteczek ATP.
Drugim sposobem włączenia cytozolowego NADH jest zużycie go do redukcji szczawiooctanu. Powstały w reakcji jabłczan przenoszony jest do wnętrza mitochondrium przez przenośnik zlokalizowany w wewnętrznej błonie mitochondrialnej. W matriks odtwarzany jest szczawiooctan i NADH w reakcji katalizowanej przez dehydrogenazę jabłczanową – jeden z enzymów cyklu Krebsa. Powstały w matriks szczawiooctan powraca do cytozolu w postaci asparaginianu wytwarzanego w reakcji transaminacji z glutaminianem jako dawcą grupy aminowej. Po przejściu do cytozolu asparaginian przekształcany jest w szczawiooctan w reakcji dezaminacji. Dzięki dwóm przenośnikom wewnętrznej błony mitochondrialnej, przenoszącym jabłczan i asparaginian, możliwe jest utlenienie cytozolowego NADH w opisanym powyżej łańcuchu oddechowym bez strat energii. Straty te występują w pierwszym z opisanych sposobów włączania NADH do łańcucha oddechowego. Odpowiednie przenośniki są obecne w wewnętrznej błonie mitochondrialnej komórek serca i wątroby człowieka.
Łańcuch oddechowy w mitochondriach roślinnych
W mitochondriach roślin łańcuch oddechowy może zachodzić w taki sam sposób jak opisany powyżej lub mogą zostać wykorzystane kompleksy białkowe nieobecne w mitochondriach zwierzęcych. Charakterystyczne dla mitochondriów roślinnych są dwie dehydrohenazy NADH, z których pierwsza znajduje się po zewnętrznej stronie wewnętrznej błony mitochondrialnej i może odbierać elektrony od NADH i NADPH obecnych w cytozolu i stosunkowo łatwo przechodzących przez zewnętrzną błonę mitochondrialną. Druga Dehydrogenaza specyficzna dla mitochondriów roślinnych występuje po wewnętrznej stronie wewnętrznej błony mitochondrialnej i może odbierać elektrony z NADH obecnego w matriks mitochondrialnym. Obie z wymienionych dehydrogenaz przekazują elektrony na ubichinon. Wspólna cechą jest także brak transportu protonów przez wewnętrzną błonę mitochondrialną, a więc nie biorą one udziału w wytwarzaniu gradientu elektrochemicznego, jak ma to miejsce w przypadku kompleksy I. Utlenienie NADH na dodatkowych dehydrogenaz prowadzi więc do wytwarzania mniejszych ilości ATP.
Wyjątkowym kompleksem występującym w mitochondriach roślin jest także oksydaza alternatywna. W mitochondriach zwierzęcych podanie cyjanku powoduje spadek intensywności oddychania do ułamka procenta wartości w warunkach normalnych. U roślin podanie cyjanku skutkuje jedynie obniżeniem oddychania do wartości 10-25% oddychania w normalnych warunkach. Cyjanek (KCN) jest inhibitorem oksydazy cytochromowej – kompleksy IV łańcuch oddechowego. Oksydaza alternatywna obecna w mitochondriach roślin umożliwia przeniesienie elektronów na tlen bezpośrednio ze zredukowanego ubichinonu z pominięciem kompleksu III i kompleksu IV. NADH zostaje utlenione, wytwarzana jest woda, jednak protony przenoszone są do przestrzeni mitochondrialnej jedynie przez kompleks I, lub w przypadku utleniania NADH na dehydrogenazie wewnętrznej nie są przenoszone przez błonę. Transport elektronów przez oksydazę alternatywną nie prowadzi więc do wytworzenia gradientu elektrochemicznego i syntezy ATP. Biologiczny sens działania alternatywnej drogi oddechowej nie jest dokładnie wyjaśniony. Wiadomo, że rośliny rezygnując z wytwarzania ATP, mogą uwalniać energię NADH w postaci ciepła i w ten sposób ogrzewać swój organizm lub kwiat zwiększając parowanie substancji przywabiających owady. Roślina Symplocarpus foetidus – kapusta skunksa – z rodziny obrazkowatych jest w stanie podgrzać swój kwiat o 14 °C w stosunku do otoczenia. Alternatywny szlak oddechowy może odgrywać rolę "wentyla bezpieczeństwa" – umożliwiać zachodzenie łańcucha oddechowego a co za tym idzie cyklu Krebsa w warunkach braku zapotrzebowania na ATP. Cykl Krebsa jest ważnym szlakiem metabolicznym nie tylko ze względu na utlenianie związków organicznych, lecz także na syntezę szkieletów węglowy niezbędnych do syntezy aminokwasów.
Transport substancji przez błonę mitochondrialną
Wytworzony w łańcuchu oddechowym gradient elektrochemiczny jest potrzebny nie tylko do działania syntazy ATP. Ciągły transport ATP do cytozolu oraz powrót ADP i Pi z cytozolu do matriks mitochondrialnej związany jest z usunięciem jednego ładunku ujemnego z matriks do przestrzeni międzybłonowej. Oznacza to zmniejszenie gradientu protonowego. W wewnętrznej błonie mitochondrialnej znajduje się wiele białek transportowych noszących nazwę przenośników. Przez translokazę ATP-ADP przenoszone są ATP i ADP. Przez przenośnik fosforanowy fosforan nieorganiczny trafia do matriks, a jon wodorotlenowy OH– do przestrzeni międzybłonowej. Przez przenośnik kwasów dikarboksylowych z mitochondrium transportowane są: jabłczan, bursztynian, fumaran, a tym samym przenośnikiem wnika do matriks fosforan. Przenośnik pirogronianowy przenosi pirogronian powstały w glikolizie do matriks, którą w zamian opuszcza jon OH–, także zmniejszając gradient elektrochemiczny.
Wydajność produkcji ATP
W opisanych powyżej przemianach glukoza może być utleniona do CO2 i H2O z jednoczesną syntezą cząsteczek ATP magazynujących uwalnianą energię. Ustalenie dokładnej liczby cząsteczek ATP powstałych podczas utlenienia jednej cząsteczki glukozy nie jest jednak możliwe ścisłymi i niezmienianymi ilościami są jedynie cząsteczki ATP powstałe w fofosforylacji substratowej podczas glikolizy oraz ATP lub GTP powstałe w takiej samej reakcji w cyklu Krebsa. Przy założeniu działania ATP-fosfofruktokinazy podczas fosforylacji fruktozo-6-fosforanu do fruktozo-1,6-fosforanu w procesie glikolizy zastają zużyte dwie cząsteczki ATP, a powstają 4, co daje efekt netto 2 wytworzonych cząsteczek. Przemiany dwóch cząsteczek acetylo-CoA w cyklu Krebsa prowadza do wytworzenia dwóch cząsteczek ATP lub ich odpowiedników (GTP). Wszystkie te reakcji przebiegają stechiometrycznie i powstające 4 cząsteczki ATP muszą być wytworzone. Pozostałe cząsteczki ATP wytwarzane są w łańcuchu oddechowym sprzężonym z syntazą ATP. Reakcje te nie są jednak stechiometryczne i nie jest możliwe dokładne wyliczenie cząsteczek ATP powstałych podczas utleniania NADH i FADH2. Jak wspomniano wyżej, cześć energii, zgromadzonej w postaci gradientu elektrochemicznego, zużyta zostaje do transportu substancji przez błony mitochondrialne i nie jest wykorzystana do syntezy ATP. Drogi utleniania NADH w łańcuchu oddechowym nie są stałe. NADH wytworzone podczas glikolizy może być utlenione przez mitochondrialną dehydrogenazę glicerolo-3-fosforanu lub przeniesione do matriks w postaci jabłczanu w utlenione na kompleksie I. W pierwszym przypadku ilość protonów przeniesionych przez błonę mitochondrialną jest mniejsza, co odpowiada mniejszej ilości wytworzonego ATP. W mitochondriach roślin ilość możliwych dróg elektronów jest jeszcze większa. Elektrony mogą być przekazywane na oksydazę cytochromową i przenoszącą protony przez błonę lub na oksydazę alternatywną niewytwarzającą gradientu protonowego. Dokładna analiza wszystkich możliwych sposobów utleniania NADH i FADH2 jest nadal prowadzona przez naukowców. Aby określić liczbę cząsteczek ATP powstających w łańcuchu oddechowym, doświadczalnie wyznacza się wskaźnik ADP/O, czyli ile tlenu zużyją mitochondria po podaniu określonej ilości ADP, dla różnych substratów oddechowych. W celu określenia stosunku ADP/O dla FADH2 do wyizolowanych mitochondriów dodaje się bursztynian, będący substratem kompleksu II łańcucha oddechowego. W celu Określenia ADP/O dla NADH podaje się jabłczan redukowany w matriks z wytworzeniem NADH. Mitochondriom roślinnym można także podać ANDH w celu wyznaczenia ADP/O dla utleniania na zewnętrznej dehydrogenazie. Poniżej przedstawiono tabelę z wyliczeniem powstającego podczas utleniania jednej cząsteczki glukozy ATP dla wartości ADP/O uśrednionych z wielu pomiarów. W przypadku utleniania NADH cytozolowego przez dehydrogenazę aldehydu 3-fosfo glicerynowego podawana ilość powstałego ATP około 30 cząsteczek. Wcześniej podawana była ilość 36 cząsteczek ATP dla zaokrąglonych do całości wartość dla NADH i FADH2. Elementem wpływającym na sprawność zamiany gradientu protonowego na ATP są także białka transportujące protony z przestrzeni międzybłonowej do matriks – termogeniny – występujące w brunatnej tkance tłuszczowej zwierząt. Białka te powodują uwolnienie energii zgromadzonej w gradiencie protonowym w postaci ciepła bez syntezy ATP. Podobną rolę u roślin może odgrywać oksydaza alternatywna.
| Etap | Wytworzone Koenzymy | Wytworzone ATP | Źródła ATP |
|---|---|---|---|
| Glikoliza | -2 | Fosforylacja glukozy lub fruktozy zużywa dwie cząsteczki ATP | |
| 4 | Efekt fosforylacji substratowej | ||
| 2 NADH | 5,1 | Fosforylacja oksydacyjna przy przeniesieniu NADH do matriks mitochondrialnej z użyciem przenośnika jabłczanu. W przypadku fosforylacji oksydacyjnej NADH doświadczalnie wyznaczone wartości ADP/O dla jabłczanu wynoszą 2,4-2,7. Dla dehydrogenazy zewnętrznej stosuje się współczynnik 1,5. | |
| Dekarboksylacja pirogronianu | 2 NADH | 5,1 | W przypadku fosforylacji oksydacyjnej NADH doświadczalnie wyznaczone wartości ADP/O dla jabłczanu wynoszą 2,4-2,7. |
| Cykl Krebsa | 2 | Fosforylacja substratowa w cyklu Krebsa prowadzi do powstania ATP lub jego równoważnika GTP | |
| 6 NADH | 15,3 | W przypadku fosforylacji oksydacyjnej NADH doświadczalnie wyznaczone wartości ADP/O dla jabłczanu wynoszą 2,4-2,7. | |
| 2 FADH2 | 3,4 | W przypadku fosforylacji oksydacyjnej FADH doświadczalnie wyznaczone wartości ADP/O dla bursztynianu wynoszą 1,6-1,8. | |
| Razem | Około 33 cząsteczek ATP | Przy całkowitym utlenieniu jednej cząsteczki glukozy najbardziej wydajną drogą i średnich wartościach ADP/O wyznaczonych doświadczalnie. | |
Regulacja procesów oddychania komórkowego
Procesy uwalniania energii w oddychaniu komórkowym zachodzą u większości organizmów nieprzerwanie przez całe życie. Jednak zapotrzebowanie na energię zmienia się zależnie od warunków środowiska i etapu rozwoju organizmu. Dlatego konieczna jest precyzyjna regulacja poszczególnych etapów oddychania komórkowego.
Szybkość przemian zachodzących podczas glikolizy regulowana jest przez kilka enzymów. Miejscem kontroli są w różnym stopniu wszystkie enzymy przeprowadzające reakcje nieodwracalne. Są to więc heksokinaza, fosfofruktokinaza i kinaza pirogronianowa. Najważniejszym enzymem podlegającym regulacji jest fosfofruktokinaza. Hamuje ją wysoki poziom ATP oraz jonów H+ pojawiających się podczas fermentacji mlekowej. Pozytywnym regulatorem fosfofruktokinazy nie jest ADP, lecz AMP. Związane jest to z wytwarzaniem AMP podczas niedoborów ATP w komórce w odwracalnej reakcji przeprowadzanej przez kinazę adenylową:
- ADP + ADP → ATP + AMP
Enzymem o nieco mniejszym znaczeniu dla regulacji całej glikolizy jest heksokinaza hamowana przez glukozo-6-fosforan. Regulacyjne znaczenia tego enzymu jest mniejsze ze względu na udział produktu reakcji w więcej niż jednym szlaku metabolicznym.
Ostatni enzym biorący udział w glikolizie – kinaza pirogronianowa – hamowany jest przez ATP, a aktywowany przez fruktozo-1,6-bisfosforan.
Kluczowy enzymem regulujący zachodzenia reakcji w mitochondriach to dehydrogenaza pirogronianowa. Kompleks dehydrogenazy pirogronianowej zawiera dwa enzymy niebiorące udziału w przekształcaniu pirogronianu do acetylo-CoA, a jedynie regulujące aktywność całego kompleksu. Kinaza dehydrogenazy pirogronianowej poprzez przyłączenie fosforanu hamuje aktywność kompleksu. Do fosforylacji dochodzi, gdy w mitochondriach znajduje się duża ilość ATP, a więc zapotrzebowanie na energie jest pokryte w wystarczającym stopniu. Gdy ilość ATP w mitochondriach ulega zmniejszeniu, kompleks dehydrogenazy ulega aktywacji poprzez odłączenie fosforanu przez fosfatazę P-PDH, która jest trwale powiązana z kompleksem. Dzięki kinazie i fosfatazie kluczowy dla reakcji mitochondrialnych enzym może być "włączany" i "wyłączany" zależnie od zapotrzebowania komórki na energię. Fosforylacja kompleksu zależy także od stosunku NADH/NAD+ oraz acetylo-CoA/CoA. Aktywność kompleksu regulują więc także produkty reakcji przez niego katalizowanej. Zależność taka jest ważna, ponieważ cykl Krebsa nie służy jedynie do produkcji energii użytecznej metabolicznie, ale także do wytwarzania metabolitów użytecznych w wielu procesach syntezy zachodzących w komórce (np. syntezie aminokwasów). Także sam przebieg cyklu Krebsa jest regulowany. Dehydrogenaza izocytrynianowa podlega stymulacji allosterycznej przez ADP. Zwiększenie aktywności enzymu powodują także NAD+ oraz jony Mg2+. ATP zaś pełni funkcję inhibitora enzymu. Kontrola obejmuje także dehydrogenazę α-ketoglutaranu. Jej aktywność ulega obniżeniu, gdy wzrasta stężenie produktów katalizowanej reakcji NADH i bursztynylo-CoA oraz podnosi się poziom ATP.
W komórkach bakterii, gdzie reakcje cyklu Krebsa nie są oddzielone od cytozolu, punkt kontrolny stanowi syntaza cytrynianowa. Enzym jest allosterycznie hamowany przez ATP.
Oksydacyjny szlak pentozofosforanowy regulowany jest na poziomie reakcji przeprowadzanych przez dehydrogenazę glukozo-6-fosforanu i dehydrogenazę 6-fosfoglukonianu, a podstawowym związkiem wpływającym na aktywność wymienionych enzymów jest NADPH.
W komórkach roślinnych aktywność części enzymów reguluje światło. Enzymem ulegającym dezaktywacji podczas oświetlania jest dehydrogenaza pirogronianowa obecna w mitochondriach oraz dehydrogenaza glukozo-6-fosforanu biorąca udział w oksydacyjnym szlaku pentozofosforanowym. Aktywność enzymu jabłczanowego zależnego od NAD (NAD-ME) wzrasta w ciemności, jednak ta zmiana aktywności prawdopodobnie nie jest związana z fosforylacją enzymu.
Utlenienie kwasów tłuszczowych
Węglowodany nie są jedynym substratem w szeregu reakcji określanych jako oddychanie komórkowe. Dużo bardziej zasobne w energię lipidy mogą być także włączane w opisane wyżej szlaki metaboliczne. Miejscem łączącym utlenianie kwasów tłuszczowych z ogólnymi szlakami oddychania komórkowego jest cykl Krebsa, do którego kwasy tłuszczowe włączane są jako acetylo-CoA. Aby mogło do tego dojść, lipidy przechodzą szereg reakcji określanych jako β-oksydacja, której ostatecznym efektem jest wytworzenie acetylo-CoA.
Proces utleniania lipidów pełniących funkcję materiałów zapasowych – triacylogliceroli – rozpoczyna się od ich hydrolizy. Reakcja ta przeprowadzana jest przez lipazy. W efekcie procesu hydrolizy triacylogliceroli – lipolizy – powstają kwasy tłuszczowe oraz glicerol. Alkohol ten ulega fosforylacji przeprowadzanej przez kinazę glicerolową ze zużyciem cząsteczki ATP. Powstały 3-fosfoglicerol przekształcany jest przez dehydrogenazę glicerolofosforanową do fosfodihydroksyacetonu. Podczas dehydrohenacji redukcji ulega jedna cząsteczka NAD+. Powstały fosfodihydroksyaceton jest jednym z metabolitów glikolizy, w którą jest włączany.
Wolne kwasy tłuszczowe przyłączane są do koenzymu A przez syntetazę acylo-CoA nazywaną także tiokinazą kwasów tłuszczowych lub ligazą kwas tłuszczowy:CoA (AMP) [EC 6.2.1.3]. W reakcji tej powstaje acylo-CoA, natomiast jedna cząsteczka ATP rozkładana jest do AMP i pirofosforanu (PPi). Reakcja ta jest odwracalna, jednak szybki rozkład powstałego PPi do dwóch cząsteczek fosforanu (Pi) przeprowadzany przez pirofosfatazę czyni ją praktycznie nieodwracalną. Przyłączenie kwasów tłuszczowych do CoA zachodzi na zewnętrznej błonie mitochondrialnej. Dalsze etapy utleniania w matriks mitochondrialnej. Przeniesienie acylo-CoA odbywa się poprzez translokazę acylokarnitynową obecną w wewnętrznej błonie mitochondrialnej. Proces ten polega na przyłączeniu do karnityny grupy acylowej. Reakcja ta katalizowana jest przez acylotransferazę karnitynową I związaną z zewnętrzną błoną mitochondrialną. Acylokarnityna przemieszcza się do matriks mitochondrialnej, gdzie odtwarzany jest acylo-CoA poprzez przeniesienie grupy acylowej z karnityny na CoA przez acylotransferazę karnitynową II. Krótsze łańcuchy kwasów tłuszczowych do dziesięciu atomów węgla przemieszczane są przez błonę mitochondrialną bez udziału przenośników.
β-oksydacja
Acylo-CoA utleniany jest w kilku cyklicznych reakcjach. Pierwszą z nich przeprowadza dehydrogenaza acylo-CoA [EC 1.3.99.3.], wytwarzając trans-Δ²-enoilo-CoA. Podczas tej reakcji redukowany jest także FAD stanowiący grupę prostetyczną dehydrogenazy acylo-CoA. Enzym ten, podobnie jak kompleks II łańcucha oddechowego, zlokalizowany jest na wewnętrznej stronie wewnętrznej błony mitochondrialnej, a elektrony ze zredukowanego FADH2 przekazywane są bezpośrednio na ubichinon. Trans-Δ²-enoilo-CoA ulega uwodnieniu w miejscu wiązania podwójnego pomiędzy węglem C-2 a C-3. Reakcję przeprowadza hydrataza enoilo-CoA [EC 4.2.1.17.], określana także jako krotonaza lub hydroliaza 3-hydroksyacylo-CoA. W reakcji uwodnienia powstaje L-3-hydroksyacylo-CoA utleniany następnie przez dehydrogenazę L-3-hydroksyacylo-CoA do 3-ketoacylo-CoA. Podczas dehydrohenacji redukowana jest jedna cząsteczka NAD+ do NADH. 3-ketoacylo-CoA rozszczepiany jest przez β-ketoliazę (tiolaza) [EC 2.3.1.16] z udziałem nowej cząsteczki CoA. W efekcie dwuwęglowa grupa przenoszona jest na CoA, co prowadzi do powstania acetylo-CoA, włączanego do cyklu Krebsa, a łańcuch kwasu tłuszczowego związany z CoA zostaje skrócony o dwa atomy węgla. Krótszy o odłączoną grupę acetylową acylo-CoA wchodzi w kolejny cykl reakcji opisanych wyżej aż do podzielenia na fragmenty dwuwęglowe całego łańcucha kwasu tłuszczowego.
β-oksydacja kwasów tłuszczowych o nieparzystej liczbie atomów węgla
W przypadku kwasów tłuszczowych o nieparzystej liczbie atomów węgla ostatecznie nie powstają jedynie cząsteczki acetylo-CoA, lecz odstani fragment (propionylo-CoA) posiada trzy atomy węgla. Może on być włączony do cyklu Krebsa dopiero po przekształceniu do bursztynylo-CoA – intermediatu uczestniczącego w cyklu. Propionylo-CoA ulega karboksylacji przeprowadzanej przez karboksylazę propionylo-CoA [EC 6.4.1.3]. W wyniku tej reakcji zużyty zostaje jon wodorowęglanowy HCO3–, a jednocześnie cząsteczka ATP hydrolizowana jest do ADP. Powstaje D-metylomalonylo-CoA ulegający racemizacji do L-metylomalonylo-CoA, który przekształcany jest do bursztynylo-CoA przez mutazę metylomalonylo-CoA [EC 5.4.99.2].
β-oksydacja kwasów tłuszczowych nienasyconych
Nieco bardziej skomplikowana jest β-oksydacja kwasów tłuszczowych nienasyconych. Obecność wiązania podwójnego między atomami węgla C3 i C4 zatrzymuje opisane wyżej reakcje β-oksydacji. Kontynuację procesu umożliwia przesunięcie wiązania podwójnego w łańcuchu kwasu tłuszczowego przez enzym określany nazwą izomeraza [EC 5.3.3.8], który zmienia podwójne wiązanie cis-Δ³ w trans-Δ². W przypadku kwasów tłuszczowych wielonienasyconych konieczne jest zredukowanie 2,4-dienoilowego związku pośredniego przez reduktazę 2,4-dienoilo-CoA [EC 1.3.1.34] z wykorzystaniem NADPH+ jako reduktora, co prowadzi do likwidacji wiązania podwójnego w nieodpowiedniej pozycji.
β-oksydacja w peroksysomach
Większość kwasów tłuszczowych utleniana jest u zwierząt w mitochondriach. Jednak pewna ilość podlega podobnym przemianom w peroksysomach. Różnice w reakcjach zachodzących w peroksysomach są niewielkie, dehydrogenaza acylo-CoA nie może przekazywać elektronów na ubichinon i oddaje je na tlen, co prowadzi do wytworzenia H2O2. Powstały nadtlenek wodoru rozkładany jest na wodę i tlen przez enzym charakterystyczny dla peroksysomów – katalazę [EC 1.11.1.6]. β-oksydacja w peroksysomach zatrzymuje się na ośmiowęglowych kwasach tłuszczowych, które przenoszone są następnie do mitochondriów.
Utlenianie kwasów tłuszczowych w komórkach roślinnych
Triacyloglicerole w komórkach roślin stanowią materiał zapasowy dużo rzadziej niż w komórkach zwierzęcych ze względu na trudności w ich przenoszeniu przez ścianę komórkową roślin. Pomimo to stanowią ważny materiał zapasowy w komórkach wielu nasion, gdzie zgromadzone są w szczególnym typie organelli komórkowych – oleosomach nazywanych także sferosomami. Reakcje utleniania tłuszczów rozpoczynane są przez enzym lipazę, wchodząca w skład błony oleosomów. Powstałe kwasy tłuszczowe przenoszone są glioksysomów – organelli przypominających peroksysomy – gdzie ulegają aktywacji poprzez przyłączenie koenzymu A i kolejnym reakcjom β-oksydacji opisanym powyżej. Acetylo-CoA wytworzony podczas β-oksydacji nie trafia do mitochondriów, gdzie zachodzi cykl Krebsa, lecz jest włączany w szereg reakcji zachodzących w glioksysomie określanych cyklem glioksalanowym. Podobnie jak w cyklu Krebsa początkowo acetylo-CoA przyłączany jest do szczawiooctanu z wytworzeniem cytrynianu przez syntazę cytrynianową [EC 2.3.1.1] i przekształcany do izocytrynianu przez akonitazę [EC 4.2.1.3]. Kolejna reakcja nie jest identyczna z reakcjami cyklu Krebsa. Izocytrynian zostaje rozłożony na bursztynian i glioksalan przez enzym – liazę izocytrynianową [EC 4.1.3.1]. Powstały bursztynian przenoszony jest do mitochondriów i tam włączany w cykl Krebsa, glioksalan zaś łączony jest z kolejną cząsteczką acetylo-CoA przez syntazę jabłczanową [EC 2.3.3.9]. W wyniku tej reakcji uwalniana jest cząsteczka CoA i powstaje jabłczan, ulegający następnie dehydrogenacji do szczawiooctanu przez dehydrogenazę jabłczanową [EC 1.1.1.37]. Podczas tej reakcji wytwarzana jest cząsteczka NADH. Powstały szczawiooctan może przyłączyć kolejną grupę acylową.
Dwa spośród metabolitów cyklu glioksalanowego mogą być transportowane poza glioksysom: wspomniany wcześniej bursztynian trafiający do mitochondrium oraz jabłczan, który po przeniesieniu do cytozolu może brać udział w powstawaniu węglowodanów w procesie nazywanym glukoneogenezą. Cykl glioksalanowy tylko w niewielkim stopniu służy utlenieniu kwasów tłuszczowych w kiełkujących roślinach. Wytwarzane w cyklu Krebsa związki mogą służyć jako szkielet węglowy do syntezy aminokwasów, a wytworzone z jabłczanu węglowodany transportowane do innych komórek rosnącej rośliny. W tym drugim przypadku z mitochondriów do cyklu glioksalanowego musi być dostarczony szczawiooctan, ponieważ nie powstaje on z jabłczanu w glioksysomach. Potrzebny do zachodzenia cyklu szczawiooctan transportowany jest do glioksysomów z mitochondriów w postaci asparaginianu.
Podsumowanie
W porównaniu z utlenieniem 1 mola glukozy rozkład 1 mola kwasu tłuszczowego daje kilkakrotnie więcej energii. W pewnych sytuacjach (np. w stanie długotrwałego głodzenia) niektóre komórki organizmu człowieka mogą rozkładać aminokwasy i wykorzystywać je jako źródło energii użytecznej biologicznie.
Życie bez tlenu
W warunkach braku tlenu w komórkach zahamowaniu ulegają reakcje zachodzące w łańcuchu oddechowym. Po zatrzymaniu reakcji łańcucha oddechowego następuje nagromadzenie w mitochondriach NADH i niedobór NAD+ niezbędnego do zachodzenia cyklu Krebsa. W efekcie zatrzymania dwóch z trzech etapów oddychania komórkowego energia przydatna metabolicznie (ATP) produkowana jest tylko w glikolizie. Jednak także w tym procesie konieczne jest odtwarzanie NAD+ potrzebnego do przeprowadzenia części reakcji. Jest to możliwe dzięki procesom nazwanymi fermentacjami, zachodzącymi jedynie przy braku tlenu w niektórych komórkach zwierzęcych, komórkach roślin i wielu mikroorganizmach. W takich przypadkach pirogronian będący produktem glikolizy ulega przekształceniu w komórkach mięśniowych do kwasu mlekowego. Reakcja ta przeprowadzana jest przez dehydrogenazę mleczanową z jednoczesnym utlenieniem NADH do NAD+. Dzięki odtworzeniu NAD+ proces glikolizy nie zostaje zahamowany i komórka może wytwarzać ATP bez dostępu tlenu. Proces ten określany jest jako fermentacja mleczanowa i chociaż prowadzi do wytworzenia ATP, to jego ilość jest znacznie mniejsza niż przy pełnym utlenieniu cząsteczki glukozy.
W komórkach roślin fermentacja mleczanowa zachodzi przy braku tlenu jedynie przez krótki okres, ponieważ kwas mlekowy dla komórek roślin jest związkiem wysoce toksycznym. Po obniżeniu pH cytozolu w wyniku gromadzenia mleczanu następuje aktywacja innego enzymu umożliwiającego przekształcenie pirogronianu do aldehydu octowego – dekarboksylazy pirogronianowej – odłączającej od pirogronianu cząsteczkę CO2. Powstały aldehyd octanowy ulega redukcji do alkoholu etylowego przeprowadzanej przez dehydrogenazę alkoholową odtwarzającą NAD+ z NADH. Proces tworzenia etanolu z pirogronianu nosi nazwę fermentacji alkoholowej i jest dominującym procesem fermentacji w tkankach roślinnych.
Zarówno fermentacja mleczanowa, jak alkoholowa prowadzi do powstania dwóch cząsteczek ATP przy utlenieniu jednej cząsteczki glukozy. Jest to zdecydowanie mniejsza ilość niż powstaje przy pełnym utlenieniu glukozy do CO2 i H2O (około 30 cząsteczek ATP), jednak umożliwia przeżycie organizmom w warunkach niedoboru tlenu spowodowanego np. zalaniem korzeni roślin przez wodę lub zbyt małą wydolnością układu krwionośnego przy wysiłku fizycznym w przypadku mięśni kręgowców. W organizmach wyższych procesy fermentacji przebiegają wyłącznie przez krótki okres. Gdy tlen znowu staje się dostępny organizmy powracają do metabolizmu oddychania tlenowego opisanego powyżej.
Wiele mikroorganizmów, szczególnie bakterie, a także drożdże zdolne są okresowo lub stale wytwarzać ATP bez dostępu tlenu. W przypadku zdolności do okresowego przechodzenia na oddychanie beztlenowe organizmy nazywane są względnymi beztlenowcami, w przypadku trwałego przystosowania do warunków beztlenowych organizmy określane są jako bezwzględne beztlenowce. Organizmy bezwzględnie beztlenowe niezdolne do życia w warunkach tlenowych, a pojawienie się tlenu w ich środowisku powoduje śmierć organizmów. Trwałe przystosowanie do środowiska pozbawionego tlenu może opierać się na uwalnianiu energii jedynie w procesach fermentacji lub poprzez przenoszenie elektronów na substrat inny niż tlen.
Fermentacje
Energia uzyskiwana w procesach fermentacji pochodzi w większości przypadków z fosforylacji substratowej. Jedynie w nielicznych przypadkach fermentacje prowadzą do przenoszenia protonów lub jonów sodu Na+ przez błonę komórkową. A powstały gradient jonów wykorzystywany jest przez syntazę ATP. Najczęściej wykorzystywanymi związkami w fermentacji są węglowodany, dlatego fermentacje można podzielić na trzy grupy:
- Fermentacje rozpoczynające się od glikolizy
- Fermentacje rozpoczynające się od szlaku pentozofosforanowego
- Fermentacje innych związków.
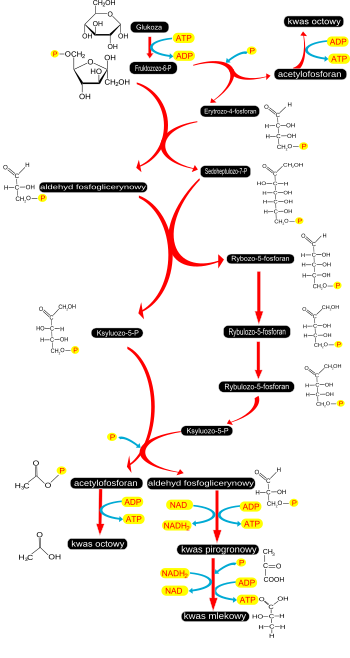
Fermentacje rozpoczynające się od glikolizy
Jest to grupa fermentacji, w których bierze udział pirogronian powstający w glikolizie. Zalicza się do nich homofermentację mlekową, przebiegającą tak samo, jak fermentacja mlekowa w organizmach wyższych opisana powyżej. Przeprowadzają ją bakterie mlekowe wykorzystujące jako źródło energii laktozę obecną w mleku. Disacharyd ten ulega hydrolizie prowadzonej przez β-galaktozydazę do glukozy i galaktozy. Oba cukry przekształcane są do glukozo-1-fosforanu, a następnie utleniane do kwasu mlekowego.
Drugą fermentacją przeprowadzaną głównie przez drożdże, a także bakterie Sarcina ventriculi, jest fermentacja alkoholowa. Jej przebieg jest analogiczny do opisanej wyżej fermentacji zachodzącej w komórkach roślin. W jej efekcie z pirogronianu wytwarzany jest etanol.

Fermentacje: mlekowa (strzałki brązowe), alkoholowa (strzałki szare) i masłowa (strzałki zielone), 1 – dehydrogenaza mleczanowa, 2 – dekarboksylaza pirogronianowa, 3 – dehydrogenaza alkoholowa, 4 – oksydoreduktaza pirogronian-ferredoksyna, 5 – tiolaza, 6 – dehydrogenaza hydroksybutyrylo-CoA , 7 – krotonaza, 8 – dehydrogenaza butyrylo-CoA.
|

Fermentacja Enterobacteriaceae.
|
Bakterie bezwzględnie beztlenowe: Clostridium butyricum, Clostridium pasteurianum, Butyrivibrio fibrisolvents, Eubracterium limosum przeprowadzają fermentację masłową. W wyniku tego procesu wytwarzany jest kwas masłowy, kwas octowy, a także duże ilości wodoru i CO2. Oba gazy powstają podczas przekształcania pirogronianu do acetylo-CoA. W reakcji tej redukcji ulega ferredoksyna, która następnie jest utleniana z uwolnieniem cząsteczki H2. Inne bakterie z rodzaju Clostridium: C. acetobutylicum i C. butylicum przeprowadzają zmodyfikowana wersję fermentacji masłowej określaną jako fermentacja acetonowo-butanowa, w której obok kwasu masłowego i kwasu octowego powstają butanol i aceton. Oba dodatkowe związki powstają dopiero po obniżeniu pH, co prowadzi do aktywacji enzymów przekształcających acetoacetyl do acetonu i redukcję kwasu masłowego do butanolu. Podczas obu fermentacji wytwarzana jest większa ilość ATP, niż fermentacjach mlekowej i alkoholowej. Dodatkowe cząsteczki ATP powstają podczas przekształcania acetylo-CoA do kwasu octowego.
Szlak glikolityczny wykorzystywany jest także przez bakterie przeprowadzające fermentację propionową. Clostridium propionicum i Megasphaera alsdenii w różny sposób przekształcają pirogronian do kwasu propionowego. Fermentację taką przeprowadzają także Propionibacterium.
Fermentacje bez glikolizy
Część bakterii mlekowych przekształca ksylulozo-5-fosforan powstający w szlaku pentozofosforanowym do etanolu i kwasu mlekowego. Proces ten nazywany jest heterofermentacją mlekową i dostarcza jedynie jedną cząsteczkę ATP na każdą utlenioną cząsteczkę glukozy. Podczas fermentacji wydzielany jest CO2 powstający w reakcji dekarboksylacji 6-fosfoglukonianu.
Zymomonas mobilis nie wytwarza kwasu mlekowego, a jedynym produktem fermentacji jest etanol. Jest to fermentacja alkoholowa oparta na szlaku pentozofosforanowym.
Bifidobacterium bifidum przekształca glukozę poprzez fruktozo-6-fosforan do ksylulozo-5-fosforanu za pomocą dehydrogenazy glukozo-6-fosforanowej. Powstały ksylulozo-5-fosforan w szeregu reakcji przekształcany jest do kwasu mlekowego oraz kwasu octowego. Wydajność energetyczna takiej fermentacji jest wyższa do heterofermentacji mlekowej, ponieważ dodatkowe ilości ATP powstają podczas wytwarzania kwasu octowego.
Fermentacje innych związków
Węglowodany są najczęściej wykorzystywanymi podczas fermentacji związkami, nie są to jednak jedyne jej substraty. Związki będące produktami jednej z fermentacji mogą być substratem w innych, przeprowadzanych przez kolejne bakterie. Wspomniane Propionibacterium w fermentacji propionowej mogą korzystać z kwasu mlekowego. Clostridium kluyveri wytwarzają ATP podczas przekształcania etanolu do kwasu masłowego. Wyjątkowy mechanizm wytwarzania ATP istnieje u Propionibacterium modestum oraz Methanosarcina mazei, u których enzym przekształcający bursztynian do propionianu powoduje przenoszenie jonów Na+ z wnętrza komórki na zewnątrz. Energia zmagazynowana w postaci gradientu jonów Na+ jest wykorzystywana przez syntazę ATP w analogiczny sposób, jak gradient jonów wodorowych w mitochondriach eukariotów. Niemal identyczny mechanizm wykorzystują do uzyskania energii w postaci ATP P. modestum podczas fermentacji szczawiooctanu. W tym przypadku przez błonę przenoszone są jednak jony H+.
Oddychanie komórkowe substancjami innymi niż tlen
Dotychczas opisane procesy pozyskiwania energii w warunkach beztlenowych – fermentacje – przebiegają ze stosunkowo mała wydajnością. Część bakterii wykształciła mechanizmy pozwalające przeprowadzać szereg reakcji podobnych do oddychania tlenowego z glikolizą, cyklem Krebsa i łańcuchem transportu elektronów sprzężonym z fosforylacją oksydacyjną, stosując jako ostateczny akceptor elektronów utlenione związki chemiczne. Równoważniki redukcyjne transportowane w łańcuchu transportu elektronów mogą być przenoszone na azotany (NO3–), siarczany (SO4–), dwutlenek węgla (CO2), jony żelaza (Fe3+), manganu (Mn4+), związki organiczne lub rzadziej związki telluru, selenu lub fosforu.
Oddychanie azotanowe
W beztlenowych łańcuchach transportu elektronów najczęściej wykorzystywany jest azotan. Proces ten jednak nieznacznie różni się od łańcucha oddechowego opisanego wyżej. Elektrony z reduktazy przekazywane są na menachinon, bakteryjny odpowiednik ubichinonu. Menachinon przenosi elektrony na cytochrom b556, z którego trafiają one na odpowiednik oksydazy cytochromowej – dysymilacyjną reduktazę azotanową. Ten obecny w błonie komórkowej enzym przekształca azotany (NO3–) do azotynów (NO2−) zgodnie z reakcją:
NO3– + 2H+ + 2e− → NO2– + H2O
Reakcję taką zdolne są przeprowadzać Escherichia coli i wiele innych bakterii. Jednak wiele prokariotów posiada cały zestaw reduktaz, przekształcając związki azotu w cyklu reakcji aż do azotu cząsteczkowego. U Paracoccus denitrificans kolejne reduktazy przekazują elektrony z łańcucha transportu elektronów w szeregu reakcji:
2NO3– + 4H+ + 4e− → 2NO2– + 2H2O
2NO2– + 4H+ + 2e− → 2NO + 2H2O
2NO + 2H+ + 2e− → N2O + H2O
N2O + 2H+ + 2e− → N2 + H2O
Ostateczny produkt w oddychaniu azotanowym zależy jedynie od zestawu enzymów, jakim dysponuje komórka bakterii. Clostridium perfringens redukuje azotany aż do jonów amonowych.
NO3– + 10H+ + 8e− → NH4+ + 3H2O
Ten typ oddychania jest podstawą denitryfikacji, ekologicznego procesu będącego jednym z etapów krążenia azotu w przyrodzie.
Oddychanie siarczanowe
Bakterie redukujące siarczany (SO42–) nie utleniają cukrów, lecz korzystają z prostych związków organicznych będących produktami fermentacji. Mogą być to: kwas mlekowy, kwas propionowy, kwas masłowy, kwas octowy, etanol, indol, benzoesany, a także związki będące składnikami ropy naftowej. W redukcji siarczanów biorą udział inne przenośniki elektronów niż w redukcji azotanów. Elektrony na reduktazę redukującą siarczany przenoszone są przez szczególny cytochrom c3 występujący jedynie w bakteriach siarczanowych. Elektrony do łańcucha dostarczane są przez dehydrogenazy związków organicznych lub hydrogenazę wykorzystującą jako źródło elektronów wodór cząsteczkowy H2. Do redukcji siarczanów zdolne są bakterie z rodzaju: Desulfovibrio, Desulfotomaculus, Desulfobacter, Desulfococcus i Desulfolobus.
Oddychanie węglanami i CO2
Metanogeny (grupa archeanów) posiadają zdolność do przenoszenia elektronów na CO2. W kolejnych reakcjach CO2 przekształcany jest do z wykorzystaniem specyficznych koenzymów i białek zawierających flawinę do metanu, przy czym elektrony do łańcucha dostarczane są przez wodór – H2.
Z węglanów jako akceptora elektronów potrafią korzystać bakterie acetogenne redukujące węglan do kwasu octowego.
Oddychanie żelazowe i manganowe
Stosunkowo nieliczne bakterie zdolne są do redukcji Fe3+ lub Mn4+. Bakterią, która oddycha w ten sposób, jest Shewanella putrefaciens, utleniająca octan lub mleczan przeprowadzając następującą reakcję:
CH3COO– + 8Fe3+ + 4H2O → 2HCO3– + 8Fe2+ + 9H+
Energia uwalniana podczas redukcji azotanów, siarczanów i innych związków umożliwia przenoszenie protonów przez błonę komórkową bakterii. Powstały gradient protonowy służy następnie do syntezy ATP w procesie fosforylacji oksydacyjnej. Ilość energii zgromadzona w postaci gradientu protonowego jest różna dla poszczególnych redukowanych związków, tym samym ilość wytworzonego ATP zależy także od redukowanego w oddychaniu beztlenowym związku. Najwięcej energii uzyskiwane jest podczas redukcji azotanów, jednak zawsze jest ona mniejsza niż przy przenoszeniu elektronów na tlen.
Kalendarium badań nad oddychaniem
- 1780-89 Antoine Laurent de Lavoisier wyjaśnił oddychanie komórkowe jako proces utleniania.
- 1857 Ludwik Pasteur wykazał, że drożdże w warunkach tlenowych produkują dwudziestokrotnie więcej biomasy z określonej ilości cukru, niż w warunkach beztlenowych. Zjawisko hamowania fermentacji przez tlen określa się jako efekt Pasteura.
- 1872 Eduard Friedrich Wilhelm Pflüger wykazał, że tlen jest używany przez wszystkie tkanki zwierząt.
- 1897 Hans i Eduard Buchner przypadkowo odkryli, że bezkomórkowym ekstrakcie z drożdży sacharoza rozkładana jest do alkoholu. Za prace dotyczące fermentacji Eduard Buchner otrzymał Nagrodę Nobla w roku 1907.
- 1900-12 Arthur Harden i William John Young, prowadząc badania fermentacji alkoholowej u drożdży, zauważyli, że dodatek fosforanu przyspiesza fermentację.
- 1905 Franz Knoop odkrył enzymatyczny rozkład kwasów tłuszczowych nazwany β-oksydacją kwasów tłuszczowych.
- 1912-22 Heinrich Otto Wieland zaproponował teorię utleniania biologicznego (oddychania komórkowego) jako odwodornienia.
- 1918 Gustav Georg Embden, Otto Fritz Meyerhof opisali szlak glikolityczny. Otto Fritz Meyerhof w roku 1922 otrzymał Nagrodę Nobla w dziedzinie fizjologii i medycyny za opisanie zależności między wytwarzaniem kwasu mlekowego w mięśniach a zużyciem tlenu.
- 1925 David Keilin wyizolował cytochromy biorące udział w łańcuchu oddechowym, badania jego dały podstawy wiedzy o oddychaniu komórkowym.
- 1929 Karl Lohmann odkrył adenozynotrifosforan – ATP.
- 1933 Gustav Georg Embden, Otto Fritz Meyerhof i Jakub K. Parnas podali nowy opis przebiegu glikolizy i fermentacji alkoholowej, nazwany schematem Embdena–Meyerhofa–Parnasa. Do roku 1940 cały szlak został szczegółowo opisany i jest pierwszym w pełni poznanym szlakiem metabolicznym.
- 1933 David Keilin wyizolował cytochrom c i opracował podstawy mechanizmu oddychania komórkowego.
- 1935 R. Schoenheimer i D. Rittenberg pierwsi zastosowali znakowanie izotopowe w badaniu metabolizmu sacharydów i tłuszczów.
- 1937 Hans Adolf Krebs opisał cykl przemian, zachodzących w nazwanym jego imieniem cyklu Krebsa. Za co otrzymał Nagrodę Nobla w dziedzinie fizjologii i medycyny w roku 1953.
- 1939 W. Belitser, J. Cybakowa, Herman Moritz Kalckar odkryli fosforylację oksydacyjną.
- 1939-41 Fritz Albert Lipmann postulował, że ATP jest związkiem wysokoenergetycznym, odgrywającym główną rolę w przenoszeniu energii w komórce.
- 1947-51 Fritz Albert Lipmann, M. Kamen, N.O. Kaplan wyizolowali i określili budowę i rolę koenzymu A oraz acetylo-koenzymu A. Za odkrycie koenzymu A Fritz Albert Lipmann otrzymał Nagrodę Nobla w dziedzinie fizjologii i medycyny w roku 1953.
- 1953 F. Dickens, Bernard Leonard Horecker i O.H. Warburg opisali szlak pentozofosforanowy.
- 1961 Peter Dennis Mitchell wyjaśnił mechanizm syntezy ATP dzięki gradientowi elektrochemicznemu w mitochondriach i chloroplastach. Nagroda Nobla w dziedzinie chemii w roku 1978 za stworzenie chemiosmotycznej teorii Mitchella.
- 1992 Rudolph Arthur Marcus otrzymał Nagrodę Nobla w dziedzinie chemii za opis działania łańcucha transportu elektronów.
- 1997 Paul Delos Boyer i John Ernest Walker otrzymali Nagrodę Nobla w dziedzinie chemii za wyjaśnienie mechanizmu działania syntazy ATP.
Zobacz też
Bibliografia
- Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 978-83-01-14379-4.
- B Hames, Nigel M Hooper, Lilla Hryniewiecka, Kazimierz Ziemnicki, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 978-83-01-13872-1.
- D. G. Nicholls, S. J. Ferguson: Bioenergetyka 2. Warszawa: Wydawnictwo Naukowe PWN, 1995. ISBN 978-83-01-11661-3.
- Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14378-9.
- Hans G. Schlegel: Mikrobiologia ogólna. Warszawa: Wydawnictwo Naukowe PWN, 2004. ISBN 83-01-13999-4.
Linki zewnętrzne
- Pedro Jorge Araújo Alves da Silva: The chemical logic behind... Fermentation and Respiration. [dostęp 2008-12-19]. (ang.).
- Michael W. King: The Medical Biochemistry. [dostęp 2008-12-19]. (ang.).