Rak żołądka człowieka
| carcinoma ventriculi | |
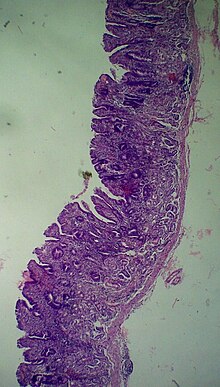
 Gruczolakorak żołądka u czterdziestoletniej kobiety (zdjęcie fragmentu krzywizny mniejszej żołądka wyciętego w subtotalnej gastrektomii) | |
| Klasyfikacje | |
| ICD-10 |
C16 |
|---|---|
| C16.0 |
Wpust |
| C16.1 |
Dno żołądka |
| C16.2 |
Trzon żołądka |
| C16.3 |
Ujście odźwiernika |
| C16.4 |
Odźwiernik |
| C16.5 |
Krzywizna mniejsza żołądka, nieokreślona |
| C16.6 |
Krzywizna większa żołądka, nieokreślona |
| C16.8 |
Zmiana przekraczająca granice jednego umiejscowienia w obrębie żołądka |
| C16.9 |
Żołądek, umiejscowienie nieokreślone |
| DiseasesDB | |
| OMIM | |
| MedlinePlus | |
| MeSH | |
{{Choroba infobox}}
|
Rak żołądka (łac. carcinoma ventriculi) – pierwotny nowotwór złośliwy żołądka, wywodzący się z nabłonka błony śluzowej żołądka. Histopatologicznie gruczolakorak stanowi około 90% wszystkich nowotworów złośliwych żołądka u ludzi. Epidemiologicznie należy do najczęściej występujących nowotworów złośliwych u ludzi, stanowi piąty nowotwór złośliwy pod względem zapadalności i trzeci pod względem śmiertelności, co przekłada się na 1 000 000 nowych zachorowań i 740 000 zgonów rocznie na całym świecie.
Rak żołądka zwykle jest rozpoznawany w zaawansowanym stadium. Do wczesnych objawów należą niecharakterystyczne objawy niestrawności, niewskazujące na poważną patologię. We wczesnym raku żołądka występują ból, pobolewanie lub dyskomfort w nadbrzuszu środkowym, uczucie wczesnej pełności czy sytości po jedzeniu, nudności i wymioty. Klasyczne objawy raka żołądka pojawiają się w stadium zaawansowanym. Często stwierdzanym objawem jest znaczny spadek masy ciała. Ból brzucha może mieć stały charakter, lecz częściej jest okresowy i pojawia się po posiłku. Nudności i wymioty są najbardziej nasilone w przypadku raka zlokalizowanego w pobliżu odźwiernika, natomiast rak zlokalizowany w okolicy wpustu może powodować zaburzenie połykania. Przewlekłe krwawienie może być przyczyną niedokrwistości z niedoboru żelaza. Nierzadko zaawansowana choroba może być rozpoznana przez stwierdzenie palpacyjnie wyczuwalnej masy w nadbrzuszu lub poprzez rozpoznanie przerzutów odległych.
W powstawaniu raka żołądka u ludzi kluczowe znaczenie ma przewlekłe zanikowe zapalenie żołądka spowodowane przez zakażenie Helicobacter pylori oraz nieprawidłowa dieta bogata w produkty słone lub konserwowane azotanami oraz uboga w świeże warzywa i owoce. Stanem przednowotworowym jest neoplazja śródnabłonkowa.
W rozpoznaniu choroby kluczowe znaczenie ma gastroskopia, która umożliwia wstępne rozpoznanie nowotworu i pobranie biopsji do badania histopatologicznego, umożliwiającego rozpoznanie typu histologicznego raka. W rozpoznaniu wczesnego raka w endoskopii przydatne jest barwienie błony śluzowej żołądka. W ocenie zaawansowania stosuje się ultrasonografię endoskopową, tomografię komputerową i pozytonową tomografię emisyjną (PET). Markery nowotworowe pełnią pomocniczą rolę w diagnostyce raka żołądka.
Wycięcie żołądka z marginesem zdrowych tkanek z odpowiednio rozległym usunięciem węzłów chłonnych jest jedyną metodą pozwalającą na wyleczenie raka żołądka. Niewielkie wczesne zmiany są możliwe do usunięcia podczas gastroskopii. W większości przypadków konieczna jest okołooperacyjna chemioterapia, która składa się z kilku cykli chemioterapii przedoperacyjnej (neoadiuwantowej) i chemioterapii uzupełniającej (adiuwantowej). Chemioradioterapia jest stosowana u chorych, którzy nie otrzymali chemioterapii neoadiuwantowej. W chorobie zaawansowanej miejscowo i uogólnionej stosuje się paliatywną chemioterapię, która wydłuża przeżycie leczonych oraz poprawia jakość życia.
Objawy
Ze względu na niespecyficzne objawy rak żołądka zwykle jest rozpoznawany w zaawansowanym stadium. Żaden objaw nie wskazuje jednoznacznie na tę chorobę, a występujące niecharakterystyczne objawy są często długo lekceważone przez chorych.
We wczesnym raku objawy mogą być zróżnicowane i przypominać objawy dyspeptyczne lub chorobę wrzodową. Występuje ból, pobolewanie lub dyskomfort w nadbrzuszu środkowym, uczucie wczesnej pełności lub sytości po jedzeniu, a także nudności i wymioty. Objawy trwają kilka miesięcy, a rzadziej kilka lat. Rzadko stwierdzany jest bezobjawowy wczesny rak żołądka.
W zaawansowanym raku żołądka występują klasyczne objawy tej choroby. Typowy jest brak łaknienia i spadek masy w ciągu kilku miesięcy, często prowadzący do wyniszczenia (zespół kacheksja-anoreksja). Spadek masy ciała o 10% stwierdzany jest nawet u 80% chorych. Występują okresowe nudności i wymioty, szczególnie w raku zlokalizowanym w obwodowej części żołądka. Ból w nadbrzuszu lub śródbrzuszu może mieć stały charakter, ale częściej pojawia się po spożyciu posiłku i nie jest mocno nasilony. Krwawienie z guza może powodować powstanie smolistych stolców (15% chorych), fusowatych albo krwistych wymiotów (10–15% chorych). Znaczne krwawienie z przewodu pokarmowego nie jest częste. Przewlekłe krwawienie może być przyczyną niedokrwistości z niedoboru żelaza. Guzy okolicy wpustu mogą powodować problemy z połykaniem (dysfagia) lub ból podczas połykania (odynofagia).
W badaniu przedmiotowym bywa wyczuwalny palpacyjnie guz w nadbrzuszu. Mogą być wyczuwalne powiększone węzły z powodu przerzutów w dole nadobojczykowym (węzeł Virchowa). Palpacja może wykazać obecność dużych przerzutów do jajników (guz Krukenberga) lub do skóry wokół pępka. W badaniu przez odbyt może być wyczuwalny próg Blumera, który jest spowodowany przez przerzuty do zachyłków otrzewnej. Masy nowotworowe w jajniku lub otrzewnej mogą powodować trudności z oddaniem stolca. W przebiegu zaawansowanej choroby może występować powiększenie wątroby, żółtaczka, wodobrzusze lub wysięk do opłucnej. Rozproszone zajęcie otrzewnej lub całkowite zamknięcie światła żołądka może być przyczyną niedrożności przewodu pokarmowego. Szerzenie się raka poprzez więzadło żołądkowo-okrężnicze może doprowadzić do powstania przetoki.
Zespoły paraneoplastyczne
Rakowi żołądka mogą towarzyszyć zespoły paraneoplastyczne:
- acanthosis nigricans – w 55% przypadków tego zespołu występuje rak żołądka,
- zapalenie skórno-mięśniowe, zapalenie wielomięśniowe,
- pęcherzyca paraneoplastyczna,
- ataksja,
- zespół Lesera-Trélata,
- zespół Cushinga, zespół rakowiaka,
- idiopatyczna zakrzepica żylna (zespół Trousseau).
Epidemiologia
Rak żołądka jest jednym z najczęściej występujących nowotworów złośliwych u ludzi na świecie. Jest piątym najczęściej rozpoznawanym nowotworem na świecie i trzecim pod względem umieralności. Rocznie na świecie jest rozpoznawanych 1 000 000 nowych przypadków zachorowań, co stanowi niemal 8% wszystkich nowych przypadków nowotworów złośliwych i powoduje około 740 000 zgonów, co stanowi około 10% wszystkich zgonów z powodu choroby nowotworowej. Bezwzględna zapadalność na świecie nieznacznie zwiększa się ze względu na wzrost liczebności oraz średniej wieku populacji.
Zapadalność na raka żołądka u ludzi znacząco różni się pod względem geograficznym i występują ponad dziesięciokrotne różnice w częstości zachorowań. Najwyższa zapadalność występuje w Japonii, Korei, wysokie ryzyko dotyczy Chile, Kolumbii, Rosji i niektórych krajów Europy (Węgry, Włochy, Portugalia, Finlandia). Niską zapadalność obserwuje się w krajach południowej Azji, północnej i wschodniej Afryce, północnej Europie, Ameryce Północnej, Australii i Nowej Zelandii.
Polska jest krajem o średniej zapadalności na tego raka, która wynosi 11,8/100 000 u mężczyzn i 4,6/100 000 u kobiet. Szacuje się, że w 2012 roku w Polsce na raka żołądka zachorowało około 5000 osób, w tym 3330 mężczyzn i 1700 kobiet. Jest to piąty nowotwór pod względem zapadalności u mężczyzn i ósmy u kobiet. Stanowi czwartą przyczynę zgonów z powodu choroby nowotworowej u mężczyzn i ósmą u kobiet. W Polsce obserwuje się powolny spadek częstości zachorowania na ten nowotwór.
Częstość zachorowania na raka żołądka rośnie wraz z wiekiem. Jest on stosunkowo rzadko rozpoznawany przed 30 rokiem życia, najwyższa zapadalność występuje pomiędzy 50–70 rokiem życia. Rak żołądka dwukrotnie częściej dotyka mężczyzn, jednak w lokalizacji w okolicy wpustu aż pięciokrotnie częściej niż u kobiet. Zapadalność na tę chorobę w lokalizacji pozawpustowej jest wyższa u ludzi czarnoskórych oraz w populacjach o gorszych warunkach socjoekonomicznych. Lokalizacja w okolicy wpustu jest częstsza u chorych rasy białej oraz lepiej sytuowanych ekonomicznie.
Występowanie poszczególnych typów histopatologicznych Lauréna różni się epidemiologicznie. Typ jelitowy u ludzi częściej dotyczy mężczyzn, osób czarnoskórych i w starszej grupie wiekowej, a także w niektórych obszarach geograficznych ze zwiększonym ryzykiem zachorowania. Z kolei typ rozlany w równym stopniu dotyczy kobiet i mężczyzn, częściej pojawia się u chorych w młodszym wieku.
Czynniki ryzyka
Do czynników ryzyka wystąpienia raka żołądka u ludzi należą:
- czynniki dietetyczne – dieta bogata w produkty słone, smażone, wędzone, konserwowane związkami azotowymi i uboga w świeże warzywa i owoce,
- infekcja Helicobacter pylori,
- czynniki genetyczne,
- palenie tytoniu,
- otyłość,
- zanikowe zapalenie błony śluzowej żołądka związane z chorobą Addisona-Biermera,
- grupa krwi A – zwiększone ryzyko raka rozlanego według Lauréna,
- wcześniejsza resekcja żołądka, szczególnie sposobem Billrotha II z powodu zarzucania żółci,
- zakażenie wirusem Epsteina-Barr,
- napromieniowanie – u osób, które przeżyły wybuchy i katastrofy jądrowe,
- narażenie zawodowe.
Helicobacter pylori
Zakażenie gram-ujemną bakterią Helicobacter pylori jest ważnym czynnikiem ryzyka powstania raka żołądka u ludzi. W regionach o wysokiej częstości zakażenia Helicobacter pylori zwykle współistnieje wysoka zapadalność na raka żołądka, a jednocześnie w krajach rozwiniętych, gdzie spada częstość zakażenia tą bakterią, obserwowany jest spadek zapadalności na raka żołądka. Liczne badania wykazały związek zakażenia z powstawaniem raka żołądka, bakteria wywołuje wielokrotny wzrost ryzyka (od 2 do 16 razy większe) zachorowania na raka żołądka.
W modelu Correa karcynogeneza powodowana przez Helicobacter pylori jest wywoływana przez sekwencję kolejnych zmian patologicznych indukowanych przez bakterię. Początkowo dochodzi do powierzchniowego zapalenia błony śluzowej żołądka, następnie do zanikowego zapalenia błony śluzowej, następnie metaplazji jelitowej, dysplazji, doprowadzając ostatecznie do inwazyjnego raka żołądka. Ryzyko raka jest większe w przypadku zakażenia szczepem posiadającym cytotoksynę cagA. Cytotoksyna zwiększa ryzyko zapalenia zanikowego błony śluzowej i ryzyka powstania raka dystalnej części żołądka. Bakteria jest bardziej związana ze zwiększonym ryzykiem raka odźwiernika niż wpustu.
Czynniki dietetyczne
Nadmierne spożywanie słonej i żywności konserwowanej solą kuchenną jest czynnikiem ryzyka rozwoju raka żołądka u ludzi. Wykazano zwiększone ryzyko rozwoju raka u osób spożywających nadmierną ilość soli kuchennej. Przypuszcza się, że rakotwórczość jest związana ze zmianami lepkości śluzu chroniącego żołądek, co prowadzi do wzmożonej ekspozycji na inne czynniki rakotwórcze, w tym związki N-nitrozowe, sól może nasilać kolonizację i zjadliwość bakterii Helicobacter pylori oraz może powodować odpowiedź zapalną błony śluzowej żołądka ze zwiększoną naprawczą proliferacją komórek nabłonkowych, ostatecznie zwiększając ryzyko mutacji.
Również spożycie żywności konserwowanej azotanami przyczynia się do zwiększonego ryzyka raka żołądka. Azotany w odpowiednich warunkach ulegają redukcji do azotynów, które prowadzą do powstania związków rakotwórczych. W badaniach na zwierzętach związki N-nitrozowe wykazują działanie rakotwórcze. Badania kohortowe wskazują na niewielki, nieistotny wzrost ryzyka zachorowania na raka w grupach o wysokim spożyciu azotynów w porównaniu do grup o niskim spożyciu azotynów. Spożycie soli jest związane z większą śmiertelnością z powodu raka żołądka niż spożycie azotanów.
Stwierdzono, że spożywanie świeżych liściastych, zielonych i żółtych warzyw oraz świeżych owoców istotnie redukuje ryzyko zachorowania na raka żołądka. Działanie protekcyjne jest wiązane z obecnością witaminy C, E i β-karotenu. Ryzyko zachorowania zmniejsza również czosnek i cebula.
Przechowywanie żywności w niskich temperaturach zmniejsza ryzyko raka żołądka i upowszechnienie się urządzeń chłodniczych prawdopodobnie przyczyniło się do zmniejszenia zapadalności na raka żołądka w wielu krajach. Jest to związane ze zmniejszeniem zastosowania soli i związków azotowych do konserwacji żywności oraz zwiększeniem dostępu do świeżych warzyw i owoców.
Prawdopodobnie policykliczne węglowodory aromatyczne występujące w wędzonych rybach i mięsie są czynnikami zwiększającymi ryzyko zachorowania na raka żołądka.
Występowanie rodzinne
W większości przypadków raka żołądka są to zachorowania sporadyczne, jednak w 5–10% przypadków stwierdza się jego rodzinne występowanie, a 3–5% przypadków występowanie w zespołach dziedzicznej predyspozycji do nowotworów.
Zaleca się poradę genetyczną u chorych w przypadku:
- rozpoznanej mutacji genetycznej powodującą zwiększoną zapadalność na ten nowotwór w rodzinie,
- raka żołądka u osoby blisko spokrewnionej przed 40. rokiem życia,
- raka żołądka u dwóch najbliższych krewnych przed 50. rokiem życia,
- raka żołądka u trzech osób w pierwszym lub drugim stopnia pokrewieństwa,
- raka żołądka i piersi u tego samego chorego przed 50. rokiem życia,
- raka żołądka u jednej i raka piersi u drugiej osoby w pierwszym lub drugim stopniu pokrewieństwa przed 50. rokiem życia.
Dziedziczny rozlany rak żołądka
Dziedziczny rozlany rak żołądka (HDGC) jest zaburzeniem dziedziczącym się autosomalnie dominująco spowodowanym mutacją genu supresorowego E-kadheryny (CDH1). Mutacja tego genu jest stwierdzana w 30–50% przypadków tej choroby. Średni wiek, przy którym pojawia się rak żołądka w dziedzicznym rozlanym raku żołądka, wynosi około 40 lat. Utrata drugiej kopii genu zwykle następuje w wyniku usunięcia całego genu lub wyciszenia promotora genu przez zaburzenia metylacji. Ryzyko wystąpienia raka żołądka wynosi około 80%. Dziedziczny rak żołądka wiąże się ze zwiększonym ryzykiem raka piersi.
Ze względu na bardzo wysokie ryzyko raka typu rozlanego zaleca się wykonanie profilaktycznej gastrektomii u osób z potwierdzoną mutacją CDH1 między 18. a 40. rokiem życia. Wykonuje się badanie śródoperacyjne mające na celu potwierdzenie całkowitego usunięcia tkanki żołądka. Gastrektomia przed 18. rokiem życia nie jest zalecana, ale wykonuje się ją, jeśli rak pojawił się u członków najbliższej rodziny przed 25. rokiem życia. Jeśli profilaktyczna gastrektomia nie została przeprowadzona, to co 6 miesięcy wykonuje się kontrolę endoskopową z licznymi losowymi biopsjami. Ponadto u kobiet z mutacją CDH1 przeprowadza się profilaktyczne badania piersi na zasadach podobnych jak w dziedzicznym raku piersi i jajnika (mutacje BRCA1 i BRCA2).
Zespół Lyncha
Zespół Lyncha (dziedziczny rak jelita grubego niezwiązany z polipowatością, HNPCC) dziedziczy się autosomalnie dominująco, jest spowodowany kilkoma różnymi mutacjami genów odpowiedzialnych za naprawę DNA. Rak żołądka jest trzecim najczęściej występującym nowotworem w tym zespole po raku jelita grubego i endometrium. Zespołowi Lyncha towarzyszy ryzyko 1–13% wystąpienia raka żołądka o typie jelitowym. U osób z mutacjami genów MLH1 i MSH2 zaleca się regularne badania przesiewowe.
Polipowatość młodzieńcza
Polipowatość młodzieńcza (JPS) dziedziczy się autosomalnie dominująco, charakteryzuje się obecnością licznych polipów w przewodzie pokarmowym. Ryzyko wystąpienia nowotworu przewodu pokarmowego wynosi 9–50% i zależy od typu mutacji. Polipy występują w odbytnicy i okrężnicy w 80% przypadków, ale mogą pojawiać się w żołądku i jelicie cienkim. Ryzyko wystąpienia raka żołądka w ciągu życia wynosi około 20%. Zaleca się badania przesiewowe dla chorych ze stwierdzoną mutacją od 15. roku życia.
Zespół Peutza-Jeghersa
Zespół Peutza-Jeghersa dziedziczy się autosomalnie dominująco, u chorych zwykle stwierdza się mutację genu supresorowego LKB1 (STK11). Ryzyko wystąpienia raka żołądka jest wysokie, w ciągu życia wynosi około 29%. Profilaktyczne badania endoskopowe rozpoczyna się już u nastolatków.
Rodzinna polipowatość gruczolakowata
Rodzinna polipowatość gruczolakowata (FAP) jest zaburzeniem dziedziczonym autosomalnie dominującym wywołanym przez mutację genu supresorowego APC. U 50% chorych pojawiają się polipy zlokalizowane w żołądku, z czego około 10% z tych polipów może ostatecznie doprowadzić do raka żołądka. Nie ma pewnych dowodów wspierających konkretny program przesiewowy wykrywania raka żołądka, jednak ze względu na zwiększone ryzyko raka w celach przesiewowych dwunastnicy wykonuje się gastroskopię.
Palenie tytoniu
Wykazano związek pomiędzy paleniem tytoniu a zapadalnością na raka żołądka, szczególnie raka dystalnej części narządu. Palacze tytoniu obarczeni są dwukrotnie wyższym ryzykiem zachorowania na raka żołądka, niż osoby niepalące.
Otyłość
Otyłość jest czynnikiem ryzyka raka połączenia przełykowo-żołądkowego. Nasila ona refluks żołądkowo-przełykowy, który z kolei może przyczyniać się do powstania przełyku Barretta.
Ekspozycja zawodowa
W niektórych grupach zawodowych zaobserwowano zwiększone ryzyko zachorowania na raka żołądka:
- górnictwo i przemysł metalowy (nikiel, cyna, węgiel, żelazo i stal),
- przemysł koksowniczy,
- przetwórstwo drewna, szczególnie u stolarzy,
- przemysł gumowy,
- rafinacja ropy naftowej,
- rolnictwo poprzez narażenie na środki ochrony roślin i nawozy syntetyczne.
Zapobieganie
- Modyfikacja stylu życia
W celu zmniejszenia ryzyka zachorowania zaleca się spożywanie świeżych warzyw i owoców. Należy unikać spożywania produktów słonych, wędzonych, smażonych i konserwowanych azotanami. Suplementacja witamin C, E i β-karotenu może mieć pomocnicze znaczenie w populacjach o niskim ich spożyciu i wysokim ryzyku raka żołądka.
- Niepalenie i zaprzestanie palenia tytoniu
Palenie tytoniu jest istotnym czynnikiem ryzyka zachorowania na wiele różnych typów nowotworów złośliwych, w tym raka żołądka. Niepalenie lub zaprzestanie znacząco redukuje ryzyka zachorowania na raka żołądka.
- Leczenie zakażenia Helicobacter pylori
Zaleca się leczenie bezobjawowych chorych zakażonych Helicobacter pylori u bliskich krewnych chorych na raka żołądka. Eradykacja jest również zalecana w chorobie wrzodowej, zapaleniu żołądka wywołanym przez tę bakterię oraz chłoniaku MALT.
- Badania przesiewowe
Badanie przesiewowe za pomocą badania endoskopowego są zarezerwowane wyłącznie dla osób, u których stwierdza się rodzinne występowanie raka żołądka. Ogólnopopulacyjne badania przesiewowe są przeprowadzane w Japonii i Korei Południowej, gdzie częstość raka żołądka jest znacznie większa niż w Europie.
Patogeneza raka żołądka
W 1975 roku Correa opracował model powstawania raka żołądka oparty na kaskadzie zmian przedrakowych. W tej teorii w procesie karcynogenezy dochodzi kolejno do przewlekłego zapalenia, następnie do zapalenia zanikowego, później do metaplazji jelitowej i dalej do dysplazji i raka inwazyjnego. W patogenezie choroby role odgrywają czynniki środowiskowe i genetyczne. Wieloletnia ekspozycja na czynniki ryzyka prowadzi do inicjacji, promocji i progresji raka żołądka.
Jednym z ważniejszych czynników w karcynogenezie raka żołądka jest przewlekłe zanikowe zapalenie spowodowane zakażeniem bakterią Helicobacter pylorii. Prawdopodobnie bakteria odgrywa rolę w powstawaniu 60% przypadków tego nowotworu u ludzi. Jednak ze względu na niejednorodność genetyczną różnych szczepów prawdopodobnie nie wszystkie z nich biorą udział w procesie nowotworzenia.
Na karcynogenezę wpływają niektóre substancje produkowane przez bakterię oraz odczyn zapalny, które jest odpowiedzią na obecność bakterii. Przewlekłe zakażenie i odpowiedź zapalna prowadzą do zaburzeń cyklu komórkowego ze zwiększeniem replikacji komórek nabłonkowych. Istotną rolę w tym procesie pełni cytotoksyna cagA, która jest bezpośrednio transportowana do komórki nabłonka, gdzie dzięki zdolności do fosforylacji reszt tyrozyny wpływa na różne ścieżki sygnałowe. Prowadzi to do rearanżacji aktyny i zmian cytoszkieletu komórki i zatarcia mikrokosmków. Aktywuje czynnik transkrypcyjny NF-κB i indukuję uwalnianie IL-8, co promuje zapalenie błony śluzowej żołądka. Wykazano, że wyższy stopień zapalenia żołądka jest związany z cytotoksyną cagA. Również toksyna wakuolizująca vacA powodująca uszkodzenie nabłonka jest związana z karcynogenezą. Bakteria posiada zdolność przekształcenia azotanów w azotyny, które mogą dalej ulegać przekształceniu w związki N-nitrozowe wykazujące działanie rakotwórcze.
Bakteria jednocześnie osłabia obronę antyoksydacyjną poprzez zmniejszenie stężenia kwasu askorbinowego (witaminy C) w soku żołądkowym. Jednocześnie proces zapalny jest związany z powstawaniem substancji utleniających, w tym reaktywnych form tlenu i azotu. W rezultacie nadmiaru związków utleniających i niedoboru antyoksydantów rozwija się stres oksydacyjny, który sprzyja uszkodzeniom materiału genetycznego.
W przewlekłym zakażeniu pomimo początkowego indukowania apoptozy dochodzi do zwiększenia replikacji komórek nabłonka. Połączenie nasilonej proliferacji i zwiększonego narażenia na mutacje DNA powoduje zwiększenie prawdopodobieństwa wystąpienia błędu podczas replikacji i pojawienia się krytycznej mutacji, a następnie do nagromadzenia się kolejnych mutacji, ukierunkowując proces uszkodzenia w kierunku raka.
Synergistyczne współdziałanie przewlekłego zakażenia Helicobacter pylorii z nieprawidłową dietą ubogą w antyoksydanty, z obecnymi azotanami i nitrozoaminami znacząco zwiększa ryzyko wystąpienia mutacji krytycznej.
Dieta jest kolejnym ważnym czynnikiem wpływającym na karcynogenezę. W żywności mogą być dostarczane substancje rakotwórcze lub substancje, które po przekształceniu w żołądku stają się rakotwórcze. Do takich substancji należą nitrozoaminy i wielopierścieniowe węglowodory aromatyczne. Rakotwórczość soli kuchennej może wynikać ze zmian lepkości śluzu chroniącego żołądek. W efekcie dochodzi do podrażnienia błony śluzowej żołądka, uszkodzenia błony śluzowej i rozwoju zapalenia zanikowego oraz nadmiernej proliferacji komórek nabłonkowych w związku z procesami naprawczymi. Konsekwencją zmian lepkości śluzu może być również zwiększona ekspozycja błony śluzowej na inne czynniki rakotwórcze. Sól może nasilać kolonizację i zjadliwość Helicobacter pylori. Ryzyko raka zmniejszają świeże warzywa i owoce, które zawierają przeciwutleniacze wykazujące działanie ochronne na błonę śluzową żołądka. Ryzyko raka również zmniejsza czosnek, cebula, oliwa z oliwek oraz zielona herbata.
Histopatologia
Gruczolakorak jest najczęstszym nowotworem złośliwym żołądka i stanowi 90–95% wszystkich nowotworów złośliwych żołądka u ludzi. Chłoniaki żołądka są drugim pod względem częstości występowania typem nowotworu złośliwego żołądka i stanowią 3–5% nowotworów złośliwych żołądka u ludzi. Najczęstszymi chłoniakami żołądka są chłoniak typu MALT i chłoniak rozlany z dużych komórek B (DLBCL), razem stanowią około 90% wszystkich chłoniaków żołądka u ludzi. Pozostałe nowotwory złośliwe stanowią rzadsze złośliwe nowotwory nabłonkowe, guzy stromalne (GIST) i rakowiaki.
Istnieje kilka różnych klasyfikacji raka żołądka pod względem histopatologicznym. Największe znaczenie ma klasyfikacja WHO i Lauréna. Klasyfikacja WHO wyróżnia wiele różnych typów nowotworów nabłonkowych, ale dominującymi typami są rak brodawkowaty, cewkowy, śluzowy i rak o słabej kohezji. Klasyfikacja Lauréna uwzględnia dwa główne typy: typ jelitowy i rozlany. Rak żołądka jest również klasyfikowany pod względem głębokości nacieku (rak wczesny i zaawansowany) i typu makroskopowego.
Rak żołądka w 50–60% przypadków jest zlokalizowany w odźwierniku, w 25% we wpuście, a reszta w trzonie i dnie żołądka. W 40% jest położony w pobliżu krzywizny mniejszej, a w 12% w pobliżu krzywizny większej.
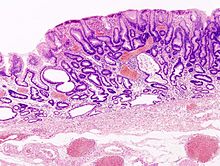
Makroskopowo zaawansowany rak żołądka może przybierać formę polipowatą, grzybiastą, wrzodziejącą lub rozlanie naciekającą (tzw. linitis plastica). Postać wrzodziejąca częściej pojawia się w okolicy przedodźwiernikowej i krzywiźnie mniejszej, klasycznie w odróżnieniu od wrzodów trawiennych wykazuje bardziej nieregularne brzegi z wzniesionymi, walcowatymi krawędziami, często zawiera obszary krwotoczne i martwicy. Forma polipowata częściej pojawia się w trzonie żołądka w obrębie krawędzi większej. Forma rozlanie naciekająca jest niewyraźnie ograniczonym guzem o owrzodziałej powierzchni zwężającym światło żołądka. Na przekroju zaawansowany rak jest szarobiałą lub żółtobiałą masą o spoistej do twardej konsystencji i zawiera obszary krwotoków i martwicy. Mikroskopowo składa się z cewkowych, groniastych lub brodawkowatych struktur lub słabo spoistych pojedynczych komórek, które naciekają głębsze warstwy ściany żołądka. Komórki nowotworowe mogą posiadać cechy komórek typu jelitowego, również wykazując różnicowanie w kierunku komórek okładzinowych, argyrofilnych komórek endokrynnych oraz komórek Panetha. Komórki zwykle produkują śluz, często stwierdza się podwyższone stężenie CEA i Ca 19-9.
Klasyfikacja WHO
Klasyfikacja WHO obejmuje nie tylko gruczolakoraka żołądka, ale również rzadsze nowotwory. Mimo dużej różnorodności klinicznie dominują cztery główne typy raka żołądka: rak brodawkowaty, cewkowy, śluzowy i rak o słabej kohezji. Pozostałe nowotwory są znacznie rzadsze i mają mniejsze znaczenie kliniczne.
Nabłonkowe nowotwory złośliwe żołądka w klasyfikacji WHO z 2010 roku są dzielone następująco:
-
gruczolakorak (ang. adenocarcinoma, ICD-O 8140/3)
- brodawkowaty rak gruczołowy (ang. papillary adenocarcinoma, ICD-O 8260/3)
- cewkowy rak gruczołowy (ang. tubular adenocarcinoma, ICD-O 8211/3)
- śluzowy rak gruczołowy (ang. mucinous adenocarcinoma, ICD-O 8480/3)
- rak o słabej kohezji (rak o małej spoistości) i gruczolakorak z komórek sygnetowatych (rak śluzowo-komórkowy) (ang. signet ring cell carcinoma and other variants; poorly cohesive carcinoma, ICD-O 8490/3)
- rak gruczołowy mieszany (ang. mixed adenocarcinoma, ICD-O 8255/3)
- rak niezróżnicowany (ang. undifferentiated carcinoma, ICD-O 8020/3)
- rak gruczołowo-płaskonabłonkowy (ang. adenosquamous carcinoma, ICD-O 8560/3)
-
rzadkie warianty:
- rak płaskonabłonkowy (ang. squamous cell carcinoma, ICD-O 8070/3)
- rak z limfoidnym podścieliskiem (rdzeniasty) (ang. carcinoma with lymphoid stroma (medullary), ICD-O 8512/3)
- rak gruczołowy hepatoidny (ang. hepatoid adenocarcinoma, ICD-O 8576/3)
- gruczolakorako-rakowiak (ang. mixed adeno-neuroendocrine carcinoma, mixed adenocarcinoma-carcinoid, ICD-O 8244/3)
- rak z komórek okładzinowych (ang. parietal cell carcinom, ICD-O 8214/3)
-
rak neuroendokrynny o wysokiej złośliwości (ang. high grade neuroendocrine carcinoma, ICD-O 8246/3)
- z dużych komórek (ang. large cell neuroendocrine carcinoma, ICD-O 8013/3)
- drobnokomórkowy (ang. small cell neuroendocrine carcinoma, ICD-O 8041/3)
- gruczolakorak onkocytarny (ang. oncocytic adenocarcinoma, ICD-O 8290/3)
- kosmówczak (ang. choriocarcinoma, ICD-O 9100/3)
- guz pęcherzyka żółtkowego (ang. endodermal sinus tumor, ICD-O 9071/3)
- rak zarodkowy (ang. embryonal carcinoma, ICD-O 9070/3)
- mieszany rak gruczołowy (ang. mixed adenocarcinoma, ICD-O 8255/3)
- mięsakorak (ang. carcinosarcoma, ICD-O 8980/3)
- złośliwy guz rabdoidalny (malignant rhabdoid tumor, ICD-O 8963/3)
- Cewkowy rak gruczołowy
Składa się z wybitnie poszerzonych lub szczelinowatych i rozgałęzionych kanalików o różnej średnicy, mogą być obecne struktury groniaste. Komórki nowotworowe przyjmują kształt walcowaty, sześcienny lub spłaszczony. Złośliwość waha się od niskiej do wysokiej.
- Brodawkowy rak gruczołowy
Są to dobrze zróżnicowane raki zbudowane z wydłużonych palcowatych wyrostków pokrytych cylindrycznymi lub prostopadłościennymi komórkami z włóknistonaczyniowym rdzeniem. Część komórek wykazuje zróżnicowanie cewkowe. Guzy różnią się stopniem atypii.
- Śluzowy rak gruczołowy
Są to nowotwory zawierające znaczną ilość pozakomórkowej mucyny przekraczającą 50% objętości guza. Występują dwa główne wzory wzrostu guza, może być zbudowany z rurowych gruczołów wyłożonych wydzielającym mucynę nabłonkiem lub o wzorze kolumn albo skupisk komórek otoczonych śluzem. Komórki sygnetowate nie dominują w obrazie. Klasyfikacja stopnia złośliwości jest trudna w guzach ubogokomórkowych.
- Rak o małej kohezji i gruczolakorak z komórek sygnetowatych
Jest to nowotwór składający się przynajmniej z 50% komórek śluzowych posiadających wewnątrzplazmatyczne wakuole zawierające śluz. Komórki występują pojedynczo lub są skupione w małych grupach. Rak o małej kohezji wykazuje tendencję do infiltracji ściany żołądka. W raku śluzowokomórkowym naciekowi towarzyszy znaczne włóknienie (desmoplazja) i może dawać makroskopowy obraz linitis plastica.
- Rak gruczołowo-płaskonabłonkowy
Jest to rzadka odmiana raka żołądka. Stanowi połączenie w różnych proporcjach utkania raka gruczołowego i płaskonabłonkowego. Zwykle występuje w okolicy odźwiernika. Nowotwór jest efektem dwukierunkowego różnicowania się i pierwotnie wywodzi się z utkania gruczołowego.
- Rak płaskonabłonkowy
Czysty rak płaskonabłonkowy występuje bardzo rzadko. Dokładne badanie histopatologiczne zwykle wykazuje niewielkie ogniska raka gruczołowego.
- Rak niezróżnicowany
Jest to nowotwór zawierający w swoim utkaniu poniżej 5% struktur gruczołowych, pozostałe komórki nie wykazują żadnych cech zróżnicowania poza fenotypem nabłonkowym.
- Rak z limfoidnym podścieliskiem (rak rdzeniasty)
Jest niezróżnicowanym nowotworem z obfitym naciekiem limfocytarnym. Guz składa się z gniazd zawierających duże eozynofilne komórki z nieobecnym lub nieznacznym różnicowaniem cewkowym. Komórki są otoczone gęstym naciekiem dojrzałych limfocytów i komórek plazmatycznych. W większości przypadków udaje się wykazać antygeny wskazujące na zakażenie wirusem Epsteina-Barr.
Klasyfikacja Lauréna
W 1965 Laurén na podstawie różnic w strukturze komórkowej, sposobie wzrastania i różnicy w wydzielaniu śluzu podzielił raka żołądka na trzy typy:
- typ jelitowy (epidemiczny) – jest to typ dobrze odgraniczony i zróżnicowany, o strukturze podobnej do nabłonka jelitowego. Obserwowane są struktury podobne do gruczołów zbudowane ze ściśle połączonych komórek. Jest związany z czynnikami środowiskowymi i występuje częściej w regionach o wyższej zachorowalności na tę chorobę, u mężczyzn i ludzi starszych. Jest związany z metaplazją jelitową oraz zakażeniem Helicobacter pylori. Stanowi 54% raków żołądka.
- typ rozlany (endemiczny) – jest to typ gorzej rokujący o niskim zróżnicowaniu i słabym odgraniczeniu. Komórki nowotworowe wykazują luźne połączenia i naciekają podścielisko jako pojedyncze lub małe grupy komórek, tworząc populację rozproszonych i niezwiązanych z otoczeniem komórek nowotworowych. Typ rozlany występuje niezależnie od wieku, nie jest poprzedzony zmianami przednowotworowymi, prawdopodobnie jest bardziej związany z czynnikami genetycznymi. Jest najczęstszym typem histopatologicznym u młodych kobiet. Stanowi około 32% raków żołądka.
- typ mieszany – łączy cechy obu form, stanowi około 15% raków żołądka.
Znaczenie prognostyczne klasyfikacji jest kontrowersyjne. Część badań wskazuje na korelację z wynikami leczenia, a część z nich nie potwierdza wartości prognostycznej tej klasyfikacji.
Klasyfikacja Goseki
W 1992 roku Goseki opisał klasyfikację histopatologiczną opierającą się na ocenie występowania struktur gruczołowych oraz obecności śluzu w cytoplazmie komórek nowotworowych:
- typ I – liczne gruczoły, uboga ilość śluzu w komórkach,
- typ II – liczne gruczoły, bogata ilość śluzu w komórkach,
- typ III – słabo uformowane gruczoły, mała ilość śluzu,
- typ IV – słabo uformowane gruczoły, duża ilość śluzu.
Klasyfikacja Ming
Klasyfikacja Minga jest oparta na wzorze wzrostu zmiany i wyróżnia:
- typ ekspansywny – nowotwór nacieka rozprężająco,
- typ inwazyjny – szerzący się gniazdami nowotworu.
Wczesny i zaawansowany rak żołądka
Wczesny rak żołądka jest zdefiniowany jako nowotwór, którego inwazja jest ograniczona do błony śluzowej lub warstwy podśluzowej z lub bez obecności przerzutów węzłowych bez względu na wielkość guza. Zwykle wczesny rak żołądka osiąga wielkość 2–5 cm, często jest zlokalizowany na krzywiźnie mniejszej koło wcięcia kątowego. Histologicznie najczęściej jest to gruczolak dobrze zróżnicowany, głównie gruczolakorak brodawkowaty i cewkowy. Rozróżnienie wczesnego raka i neoplazji (dysplazji) wysokiego stopnia może być trudne, jeśli dostępna do badania histopatologicznego jest wyłącznie błona śluzowa ze zmienionego miejsca.
Zaawansowany rak żołądka jest to nowotwór przekraczający błonę podśluzową i naciekający błonę mięśniową właściwą. Wiąże się ze znacznie gorszym rokowaniem od raka wczesnego. Wykazuje większe zróżnicowanie wzorów histopatologicznych, makroskopowo może przyjmować formę polipu, grzybiastą, wrzodziejącą lub rozlaną.
Rak połączenia przełykowo-żołądkowego
Nowotwory okolicy połączenia przełykowo-żołądkowego mogą być trudne do określenia pod względem punktu wyjścia. Wynika to z podobnej etiologii, obrazu histopatologicznego oraz trudnościami ze zdefiniowaniem granicy pomiędzy przełykiem a żołądkiem.
W klasyfikacji Siewerta wyróżnia się trzy typu raka połączenia przełykowo-żołądkowego:
- typ I – zmiana pierwotnie dotycząca przełyku,
- typ II – zmiana wywodząca się z obszaru wpustu z cechami pośrednimi między typem I i III,
- typ III – zmiana nowotworowa pierwotnie dotycząca bliższą część żołądka i naciekająca wpust.
W związku z tym nowotwory okolicy wpustu są zaliczane do jednej grupy nowotworów połączenia przełykowo-żołądkowego niezależnie od lokalizacji głównej masy guza. Guz jest klasyfikowany jako rak przełyku, jeśli epicentrum głównej masy guza znajduje się w części piersiowej przełyku lub połączenia przełykowo-żołądkowego albo w początkowych 5 cm żołądka (wpust), gdy guz rozprzestrzenia się w stronę połączenia przełykowo-żołądkowego lub dystalnej części przełyku. Nie klasyfikuje się go tak, jeśli środek guza znajduje się powyżej 5 cm od połączenia przełykowo-żołądkowego lub poniżej 5 cm, jak też jeśli nie rozciąga się w stronę połączenia przełykowo-żołądkowego.
Neoplazja śródnabłonkowa
Neoplazja śródnabłonkowa (dysplazja śródnabłonkowa) jest stanem przednowotworowym. Histologicznie jest definiowana jako obecność nabłonka nowotworowego bez inwazji blaszki właściwej i warstwy podśluzowej, obejmując szerokie spektrum zmian cytologicznych lub architektomicznych.
W klasyfikacji wiedeńskiej nabłonkowej neoplazji przewodu pokarmowego wyróżnia się:
- brak neoplazji (dysplazji),
- zmiany niejednoznaczne,
- neoplazja (dysplazja) małego stopnia (zmiany nowotworowe nieinwazyjne małego stopnia, gruczolak z dysplazją małego stopnia),
- neoplazja (dysplazja) dużego stopnia (zmiany nowotworowe nieinwazyjne dużego stopnia),
- rak inwazyjny (inwazyjna neoplazja).
Neoplazja niskiego stopnia cechuje się brakiem lub nieznacznie zmienioną architekturą błony śluzowej przy obecności łagodnej do umiarkowanej atypii, komórki są ściśle upakowane, a jądra są zgromadzone w dolnej części komórki. W obrazie występują cewkowe struktury z rozgałęzieniami, z „pączkowaniem”, wydłużone krypty z „ząbkowaniem” i zmiany torbielowate. Gruczoły są wyłożone wydłużonymi komórkami nabłonkowymi walcowatymi. Wydzielanie śluzu jest minimalne lub nie stwierdza się go.
Neoplazja wysokiego stopnia wykazuje obecność zarówno atypii, jak i wyraźnego zniekształcenia architektury błony śluzowej. Cewki są nieregularnego kształtu z częstymi rozgałęzieniami. Komórki częściej są kształtu sześciennego niż walcowatego, zawierają duże, nieregularne jądro i wyraźne jąderko. Obserwuje się zwiększenie stosunku jądrowo-cytoplazmatycznego. Stwierdza się zwiększoną aktywność proliferacyjną, częściej niż w dysplazji niskiego stopnia stwierdza się atypowe mitozy. Nie mogą występować cechy inwazji zrębu, które są typowe dla raka inwazyjnego.
Neoplazja małego stopnia ulega wycofaniu w 40–50%, nie ulega dalszym przemianom w 20–30%, a w 0–15% przechodzi w neoplazję dużego stopnia. Z kolei neoplazja dużego stopnia cofa się w 5%, nie ulega dalszym przemianom w 15%, w aż 80–85% przechodzi w gruczolakoraka. Progresja neoplazji dużego stopnia wymaga średnio 4–24 miesięcy. W neoplazji małego stopnia progresja występuje rzadziej, a jeśli już, to następuje średnio po 35–40 miesiącach. Makroskopowo zmiany mogą być płaskie lub wrastać do światła jako gruczolaki, które dzieli się zgodnie ze stopniem neoplazji.
Gruczolaki są to ograniczone łagodne zmiany złożone ze struktur cewkowych, cewkowo-kosmkowych lub kosmkowych wykazujące cechy neoplazji śródnabłonkowej (dysplazji śródnabłonkowej). W krajach zachodnich pojęcie gruczolaka obejmuje wyłącznie zmiany uniesione, ale w Japonii termin gruczolak obejmuje zmiany uniesione, płaski i obniżone. Ryzyko transformacji nowotworowej jest zależne od wielkości gruczolaka i stopnia neoplazji. Wyższe ryzyko występuje w zmianach płaskich („siedzących”), o budowie kosmkowej i dysplazji wysokiego stopnia. Małe (poniżej 1 cm), uszypułowane gruczolaki zwykle są budowy cewkowej z niskim stopniem neoplazji. Większe zwykle są związane z budową kosmkową i wysokim stopniem neoplazji. Ryzyko transformacji nowotworowej w gruczolakach powyżej 2 cm wynosi około 40–50%.
Przebieg naturalny choroby
Rozwój wczesnego raka żołądka jest powolny, po przekroczeniu przez guz około 4 cm średnicy przenika on do warstwy mięśniowej i wówczas jego wzrost gwałtownie przyspiesza. Prawdopodobnie mija około 7 lat, nim nowotwór przeniknie z błony śluzowej do warstwy podśluzowej, i kolejne 3 lata do progresji do zaawansowanego raka. Pięcioletnie ryzyko progresji wczesnego raka żołądka do zaawansowanego wynosi około 60–65%.
Zaawansowany rak żołądka szerzy się przez ciągłość, bezpośrednio naciekając sąsiednie struktury, a w następstwie inwazji naczyń żylnych i chłonnych szerzy się drogą naczyń krwionośnych i chłonnych, dając przerzuty węzłowe lub odległe. Szczególną formą rozprzestrzeniania się nowotworu jest tworzenie wszczepów w obrębie jamy otrzewnej. Początkowo wzrost guza następuje przez przenikanie poprzecznie poprzez ścianę żołądka i zajęcie coraz większego obszaru żołądka poprzez szerzenie się horyzontalne. Rak nacieka coraz głębsze warstw ściany narządu, obejmując początkowo błonę śluzową, a następnie kolejno warstwę podśluzową, mięśniówkę i surowicówkę. Skupiska komórek nowotworowych mogą znajdować się w pewnej odległości od ogniska pierwotnego, co utrudnia radykalną resekcję. W postaci linitis plastica nowotwór może naciekać śródściennie cały żołądek. Po przekroczeniu ściany żołądka nowotwór może szerzyć się przez ciągłość na sąsiednie narządy i naciekać dwunastnicę, przełyk, wątrobę, poprzecznicę, trzustkę, śledzionę, sieć większą, przeponę i nadnercze.
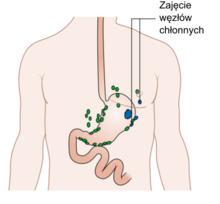
Przerzuty raka żołądka szerzą się przede wszystkim siecią naczyń chłonnych poprzez naczynia podśluzowe i podsurowicze. W zaawansowanym guzie przerzuty występują w ponad 50% przypadków choroby. Bardzo skomplikowana sieć naczyń chłonnych uniemożliwia przewidzenie miejsca spływu chłonki z guza i przewidzenie grupy węzłów mogących zawierać przerzuty. Przerzuty drogą krwionośną powstają raczej w późniejszych etapach choroby po inwazji przez guz naczyń żylnych i pojawiają się one głównie w wątrobie, płucach i kościach. W postaci zaawansowanej występują nierzadko obustronne przerzuty drogą krwionośną lub przezotrzewnowa do jajnika (guz Krukenberga) oraz przerzuty w okolicy okołorektalnej (próg Blumera).
Typ jelitowy cechuje większa skłonność do tworzenia przerzutów drogą krwionośną, z kolei typ rozlany do szerzenia drogą naczyń limfatycznych.
Rak połączenia przełykowo-żołądkowego wykazuje dużą skłonność do tworzenia przerzutów drogą chłonną, zajmując węzły dolnego śródpiersia. W raku wpustu przerzuty wykazują tendencję do rozprzestrzeniania się w dół i pojawiania się w węzłach kąta żołądkowo-przełykowego (kąt Hisa), lewej tętnicy żołądkowej, pnia trzewnego i okołoaortalnych.
Rozpoznanie choroby
Preferowaną metodą w wykrywaniu raka żołądka jest gastroskopia należąca do metod endoskopowych. Endoskopia umożliwia zobrazowanie nowotworu i postawienie wstępnego rozpoznania choroby nowotworowej oraz pobranie wycinków do badania histopatologicznego. Kluczowe, szczególnie we wczesnych zmianach, jest pobieranie wycinków ze wszystkich podejrzanych zmian, ponieważ wczesny rak może być trudny do odróżnienia od wrzodu trawiennego. W rozpoznaniu wczesnego raka przydatne mogą być barwienie błony śluzowej żołądka i endoskopia powiększająca. Radiologiczne badania obrazowe pełnią większą rolę w ocenie zaawansowania choroby.
Pobrane wycinki podczas badania endoskopowego są badane histopatologicznie pod mikroskopem świetlnym, dodatkowo wykorzystywane są techniki badania histochemicznego, immunohistochemicznego i wykonuje się badania molekularne. Umożliwiają one ostateczne rozpoznanie raka żołądka i określenie czynników rokowniczych. Czasem ostateczne rozpoznanie typu histopatologicznego może być postawione dopiero po zbadaniu całego preparatu pooperacyjnego.
W ocenie zaawansowania rutynowo stosowana jest ultrasonografia endoskopowa (EUS) w ocenie głębokości nacieku oraz tomografia komputerowa w ocenie stopnia zajęcia węzłów chłonnych i obecności przerzutów. Pozytonowa tomografia emisyjna (PET) wykazuje mniejszą czułość w wykryciu przerzutów węzłowych niż tomografia komputerowa, jednak charakteryzuje ją większa swoistość. U niektórych chorych przed radykalnym zabiegiem chirurgicznym wykonuje się diagnostyczną laparoskopię w celu wykrycia ukrytych przerzutów niewykrywalnych w badaniach obrazowych.
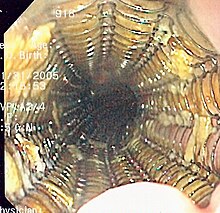
Gastroskopia
Endoskopia żołądka jest metodą pozwalającą na czułe i swoiste stwierdzenie obecności raka żołądka, jego lokalizacji oraz umożliwia wykonanie biopsji, dostarczając materiału do badania histopatologicznego. Zaleca się pobranie 6–8 bioptatów z podejrzanej zmiany za pomocą kleszczyków, co jest szczególnie ważne w przypadku zmian z owrzodzeniem. Czułość badania w wykrywaniu wczesnego raka żołądka sięga 80%.
Wczesne zmiany są płaskie i przypominają nadżerki lub pogrubiałe fałdy. Ocenia się kolor i morfologię zmiany. W celu różnicowania stosuje się barwienie błony śluzowej za pomocą indygokarminu (chemoendoskopia) oraz endoskopię powiększającą. Po wybarwieniu zmiany ocenia się jej ograniczenie, nieprawidłowości koloru i powierzchni.
W zaawansowanym raku stwierdza się guz, często z rozpadem jego części lub duże owrzodzenie o nieregularnym kształcie albo równomierny naciek ściany narządu.
Makroskopowo zaawansowany rak żołądka w endoskopii jest klasyfikowany w cztery osobne typy makroskopowe (klasyfikacja Bormanna):
- postać polipowata – jest to pojedynczy egzofityczny guz bez owrzodzenia,
- postać grzybiasta (wrzodziejąco-polipowata) – ostro ograniczony rak o uniesionych brzegach,
- postać wrzodziejąca – słabo ograniczone owrzodzenie,
- postać rozlana (linitis plastica) – rak jednolicie naciekający ścianę żołądka.
Ultrasonografia endoskopowa
Ultrasonografia endoskopowa (EUS) pozwala wstępnie ocenić zaawansowanie miejscowe choroby. Umożliwia ocenienie głębokości nacieku guza (cecha T), stwierdzenie zajęcia węzłów chłonnych (cecha N), a czasami stwierdzenie obecności przerzutów odległych w okolicznych strukturach anatomicznych (cecha M).
Zajęte węzły chłonne są obserwowane jako dobrze odgraniczone hipoechogenne, jednorodne struktury o okrągłym kształcie. Czułość badania zwiększa biopsja cienkoigłowa i ocena cytologiczna.
Tomografia komputerowa
Tomografia komputerowa (TK) jest ważną metodą pozwalającą nieinwazyjnie ocenić stopień zaawansowania choroby, w tym stopień zaawansowania miejscowego, zajęcia węzłów chłonnych i obecności przerzutów odległych.
Badanie jest wykonywane po doustnym podaniu około 500–750 ml wody lub leku powodującego powstanie gazu. Zabieg ten ma na celu dostateczne rozciągnięcie ściany żołądka, tak aby cała jego powierzchnia była dostępna do badania. Podane środki stanowią jednocześnie negatywny kontrast w badaniu. Unika się stosowania pozytywnych środków kontrastujących ze względu na ryzyko zasłonięcia małych guzów lub utworzenia „pseudoguzów” w wyniku nieodpowiedniego zmieszania się środka. Skany są oceniane po podaniu jodowego środka kontrastującego w fazie tętniczej po 30–35 s od rozpoczęcia dożylnego podania kontrastu i w fazie wrotnej po 60–70 s po podaniu.
W warunkach prawidłowych ściana żołądka w wielorzędowej tomografii komputerowej jest uwidaczniana jako struktura złożona z 2–3 warstw odpowiadających budowie histopatologicznej. Typowo rak powoduje zaburzenie radiologicznego obrazu warstw oraz jest związany z różnego stopnia zgrubieniem ściany i wzmocnieniem kontrastowym. Guz o zaawansowaniu T1 może uwidaczniać się jako wyraźne wzmocnienie z pogrubieniem ściany żołądka, jako wzmocnienie bez pogrubienia ściany lub jako wzmocnienie i pogrubienie bez wyraźnego zwężenia środkowej i zewnętrznej warstwy odpowiadających histologicznie warstwie podśluzowej i mięśniowej. Guz o zaawansowaniu T2 może wykazywać przezwarstwowe wzmocnienie z ogniskowym zgrubieniem lub wzmocnieniem z nagłym zwężeniem środkowej warstwy w trójwarstwowym obrazie radiologicznym żołądka lub ogniskowe zgrubienie lub wzmocnienie ze zwężeniem zewnętrznej warstwy w dwuwarstwowym obrazie z jednocześnie gładką zewnętrzną krawędzią pogrubionej ściany żołądka.
Tomografia komputerowa jest wykorzystywana w ocenie zaawansowania choroby. Wykazuje ona wysoką dokładność diagnostyczną w zobrazowaniu zasięgu guza pierwotnego (cecha T) wynoszącą około 77–89%. W ocenie zajęcia węzłów chłonnych (cecha N) wykazuje dokładność 69–92%, czułość 78–92% i swoistość 62–86%. Dokładność diagnostyczna w ocenie obecności przerzutów odległych wynosi około 70%.
Rezonans magnetyczny
Rezonans magnetyczny (MRI) jest pomocniczą metodą stosowaną w diagnostyce i ocenie zaawansowania. Metody ograniczające wpływ ruchu na badanie pozwalają na wykorzystanie go w badaniu żołądka. Konieczne jest rozdęcie żołądka za pomocą wody lub tabletek uwalniających gaz. Obecnie zastosowanie metody jest ograniczone do sytuacji, gdy chorzy nie mogą przyjąć jodowych środków kontrastujących lub gdy wyniki TK lub EUS są niejednoznaczne.
Pozytonowa tomografia emisyjna
Pozytonowa tomografia emisyjna (PET) z glukozą znakowaną fluorem (18F-FDG) szczególnie w połączeniu z tomografią komputerową jest przydatną metodą w ocenie zaawansowania guza, jednak nie znajduje zastosowania w rutynowej diagnostyce choroby przed operacją.
Największe zastosowanie PET znajduje w ocenie zajęcia węzłów chłonnych oraz oceny przerzutów odległych. Wykrywa ona przerzuty węzłowe z czułością 21–40% i swoistością 89–100%, a przerzuty odległe z czułością 35–74% i swoistością 74–99%. Ze względu na ograniczoną zdolność do określenia przestrzennego nacieku w ocenie zaawansowania guza PET nie jest metodą przydatną klinicznie w określeniu zaawansowania miejscowego guza (cecha T).
PET ma ograniczoną zdolność do wykrywania przerzutów do otrzewnej, ale wykazuje dużą czułość w wykryciu ukrytych przerzutów odległych. Nie wiadomo, czy wychwyt FDG ma znaczenie prognostyczne. PET może być pomocny w ocenie odpowiedzi na leczenie, która jest wcześniej stwierdzana niż w tomografii komputerowej.
Metoda wykazuje różną czułość w zależności od typu histopatologicznego guza, która jest znacznie niższa w typie rozlanym Lauréna, śluzowym raku gruczołowym, raku o słabej kohezji, a większa w typie jelitowym Lauréna i cewkowym raku gruczołowym. Czułość jest zależna od wielkości zmian. Wynosi ona tylko 17% w zmianach poniżej 30 mm. Istotna jest głębokość inwazji, czułość PET jest znacznie większa w zaawansowanym raku żołądka niż wczesnym raku i w jednym badaniu wynosiła odpowiednio 93–98% i 26–63%.
Ze względu na stosunkowo niską czułość PET ma ograniczoną rolę w pierwotnej diagnostyce nowotworu.
Laparoskopia
Laparoskopia pozwala na bezpośrednie uwidocznienie otrzewnej trzewnej i ściennej oraz umożliwia wykrycie niewielkich przerzutów niewykrywalnych w badaniach obrazowych. Badanie cytologiczne płynu poprawia skuteczność wykrywania przerzutów do otrzewnej. Metoda pozwala zdyskwalifikować chorych z nieoperacyjną chorobą od niepotrzebnej laparotomii.
Przed leczeniem radykalnym przydatna jest laparoskopia diagnostyczna z badaniem cytologicznym płynu z jamy otrzewnej i w zaleceniach NCCN w celu oceny stopnia zaawansowania przed leczeniem radykalnym zaleca się wykonanie diagnostycznej laparoskopii z badaniem cytologicznym płynu otrzewnowego guza w zaawansowaniu co najmniej T1b. Laparoskopia nie jest konieczna przed wykonaniem operacji paliatywnych.
Radiologiczne badanie dwukontrastowe
Badanie polega na podaniu zawiesiny siarczanu baru jako pozytywnego środka cieniującego oraz środka uwalniającego dwutlenek węgla jako negatywnego środka kontrastującego i wykonanie serii zdjęć rentgenowskich w różnych układach. Wadą metody jest niemożność oceny głębokości naciekania, zajęcia węzłów chłonnych oraz obecności przerzutów odległych, a także pobrania wycinków do badania histopatologicznego. Choć endoskopia jest metodą z wyboru, to dwukontrastowe badanie radiologiczne może być przydatne w trudnych diagnostycznie przypadkach.
Radiologicznie rozróżnia się trzy typy raka żołądka:
- postać polipowatą – zaawansowane zmiany są widoczne jako ubytki wypełnienia kontrastu, które odpowiadają masie nowotworu wrastającej do światła żołądka, a nacieczony odcinek nie bierze udziału w perystaltyce, w późniejszym etapie choroby guz powoduje zwężenie światła z utworzeniem wąskiego kanału o sztywnych i nierównych ograniczeniach. Mniejsze zmiany są uwidaczniane jako okrągłe lub owalne guzki,
- postać wrzodziejąca – rak jest widoczny jako owrzodzenie wewnątrz światła żołądka otoczone wałowatymi brzegami odpowiadającymi naciekowi nowotworowemu. Podczas ucisku jest widoczny objaw mennisku (objaw Carmana). Fałdy są zniekształcone, dno owrzodzenia może być nierówne,
- naciekająca – charakteryzuje się sztywnością ściany żołądka, brakiem perystaltyki i ubytkami w rzeźbie błony śluzowej, w późnym okresie zwężenie ścian żołądka z charakterystycznym lejkowatym zwężeniem w guzach odcinka odźwiernikowego. Rozpoznanie we wczesnym etapie bywa trudne.
Badanie histopatologiczne
Badanie histopatologiczne polega na mikroskopowej ocenie preparatu wybarwionego hematoksyliną i eozyną (H+E) uzyskanego za pomocą endoskopowej biopsji, śródoperacyjnego badania mrożonych skrawków lub preparatu pooperacyjnego. Pomocniczo stosuje się badanie histochemiczne, immunohistochemiczne i badania molekularne.
- Biopsja endoskopowa
Endoskopowa biopsja jest podstawowym badaniem dostarczającym materiału do badania histopatologicznego. Zaleca się pobranie 6–8 bioptatów z podejrzanej zmiany za pomocą kleszczyków. Biopsja ze względu na małą objętość i heterogenność raka żołądka może nie być reprezentatywna dla całego guza, dlatego ostateczne rozpoznanie jest stawiane po ocenie histopatologicznej całego guza.
- Badanie śródoperacyjne skrawków mrożonych
Wartość badania jest kontrowersyjna. Bywa stosowane w śródoperacyjnej ocenie marginesów chirurgicznych, jednak ze względu na technikę utrwalania skrawka nie jest metodą dokładną.
- Materiał pooperacyjny
W badaniu preparatu pooperacyjnego stawia się ostateczne rozpoznanie histopatologiczne, określa się głębokość nacieku nowotworowego i stopień zaawansowania klinicznego, oceniając wielkość guza, zajęcie węzłów chłonnych oraz obecność przerzutów odległych. Bardzo ważne prognostycznie jest określenie ewentualnego nacieku marginesów chirurgicznych i ocena go w klasyfikacji R (R0, R1, R2).
HER2
Gen receptora typu 2 dla ludzkiego czynnika wzrostu naskórka (HER2, HER2/neu) pełni ważną rolę w patogenezie raka żołądka. Jego amplifikacja i nadekspresja jest stwierdzana odpowiednio w 12–27% i 9–23% przypadkach raka żołądka. W typie jelitowym częściej stwierdza się rak HER2-dodatni. W diagnostyce oceny genu HER2 stosuje się immunohistomicznię, a w razie niejednoznacznego wyniku fluorescencyjną hybrydyzację in situ.
W przeciwieństwie do raka piersi znaczenie prognostyczne genu nie jest jasne. Prawdopodobnie wiąże się ze złym rokowaniem. Wykonanie badania HER2 jest zalecane u chorych z chorobą przerzutową w momencie rozpoznania.
Markery nowotworowe
Markery nowotworowe pełnią pomocniczą rolę w diagnostyce raka żołądka ze względu na niską czułość i swoistość. Mogą być wykorzystywane w monitoringu nawrotu guza i w prognozowaniu, ponieważ ich wyższe stężenie jest obserwowane w zaawansowanej chorobie. Kontrowersyjne jest ich użycie w ocenie zaawansowania klinicznego choroby, szczególnie w ocenie przedoperacyjnej. Największe znaczenie kliniczne wykazują CEA i CA 19-9.
- Antygen rakowo-płodowy (CEA)
Stężenie CEA jest podwyższone w około 25%. Czułość markera jest niska, jednak gdy jego stężenie jest podwyższone, to koreluje ono z zaawansowaniem choroby.
Marker znajduje zastosowanie głównie w monitorowaniu skuteczności leczenia, brak spadku lub wzrost jego stężenia wskazuje na nieskuteczność terapii. Podwyższone stężenie CEA koreluje ze znacznie gorszym przeżyciem chorych na raka żołądka i wiąże się z niemal dwukrotnie większym ryzykiem zgonu. Wiąże się również z większym ryzykiem nawrotu choroby. CEA stanowi niezależny czynnik prognostyczny w raku żołądka.
- CA 19-9
CA 19-9, podobnie jak CEA, pełni tylko pomocniczą rolę w diagnostyce, używany jest głównie w monitorowaniu skuteczności leczenia. Jego podwyższone stężenie jest wiązane z wyższym ryzykiem zajęcia węzłów chłonnych oraz otrzewnej oraz gorszym rokowaniem.
- CA 72-4
CA 72-4 jest związany z wyższym ryzykiem zgonu z powodu raka żołądka, zajęciem węzłów chłonnych oraz otrzewnej. Marker jest niezależnym czynnikiem prognostycznym.
Ocena zaawansowania i rokowania
Ocena zaawansowania
Samo rozpoznanie raka żołądka nie jest wystarczające do wyboru najlepszej strategii leczenia, dlatego konieczna jest ocena zaawansowania choroby (ang. staging). Zaawansowanie choroby najczęściej jest określane według klasyfikacji TNM, na którą składa się ze stopnia zaawansowania guza pierwotnego, stopnia zajęcia lokalnych węzłów chłonnych oraz obecności przerzutów odległych. Drugą stosowanym systemem oceny zaawansowania jest klasyfikacja japońska.
W celu oceny zaawansowania choroby wykorzystuje się tomografię komputerową, ultrasonografię endoskopową (EUS), rezonans magnetyczny, pozytonową tomografię emisyjną w połączeniu z tomografią komputerową (PET-TK) oraz laparoskopię diagnostyczną. Zaleca się wykonanie podstawowych badań laboratoryjnych, wykonanie gastroskopii z biopsją i tomografii komputerowej brzucha, miednicy i klatki piersiowej.
Ultrasonografia endoskopowa cechuje się największą dokładnością w ocenie zaawansowania miejscowego. Dokładność diagnostyczną oceny zaawansowania miejscowego raka żołądka (cecha T klasyfikacji TNM) szacuje się na 65–92%, a zajęcia lokalnych węzłów chłonnych (cecha N klasyfikacji TNM) na 50–95%. Ocena dalszych węzłów chłonnych jest trudna ze względu na ograniczoną możliwość głębokości wizualizacji przetwornika. Tomografia komputerowa charakteryzuje się 43–82% dokładnością diagnostyczną w ocenie zaawansowania miejscowego raka żołądka (cecha T klasyfikacji TNM). PET-TK wykazuje niższą czułość, ale wyższą swoistość w wykrywaniu przerzutów do lokalnych węzłów chłonnych. PET-TK nie znajduje zastosowania w ocenie zaawansowania guza pierwotnego. PET-TK wykazuje wyższą dokładność diagnostyczną niż TK i PET.
W celu oceny obecności przerzutów odległych wykorzystuje się tomografię komputerową oraz PET/PET-TK, jeśli jest dostępna. U chorych z wodobrzuszem zaleca się wykonanie punkcji otrzewnej i badania cytologicznego płynu otrzewnowego. Przed leczeniem radykalnym przydatna jest laparoskopia diagnostyczna z badaniem cytologicznym płynu z jamy otrzewnej.
Ocena rokowania
- Czynniki anatomiczne
Rokowanie w raku żołądka jest uzależnione od wielkości guza, zajęcia regionalnych węzłów chłonnych, lokalizacji guza i stopnia zaawansowania klinicznego określonego w klasyfikacji TNM.
Wielkość guza pierwotnego jest istotnym niezależnym czynnikiem rokowniczym, koreluje ona z ryzykiem występowania przerzutów węzłowych i pięcioletnim przeżyciem. Zajęcie węzłów chłonnych jest jednym z najważniejszych czynników rokowniczych. Na rokowanie wpływa liczba zajętych węzłów i ich poziom anatomiczny, szczególnie u chorych poddanych radykalnej gastrektomii. Rokowanie jest gorsze w położeniu guza w okolicy wpustu. Guzy tej okolicy częściej osiągają większe rozmiary, wykazują obecność przerzutów do regionalnych węzłów chłonnych oraz gorsze przeżycie całkowite. Nie obserwuje się różnic w rokowaniu pomiędzy lokalizacjami w trzonie i odźwierniku.
- Czynniki histologiczne
Rokowanie zależy od typu histopatologicznego nowotworu. Gruczolakorak z komórek sygnetowych oraz gruczolakorak brodawkowy wykazują gorsze rokowanie. Klasyfikacja WHO może być niezależnym czynnikiem rokowniczym. Znaczenie prognostyczne klasyfikacji Lauréna jest kontrowersyjne. Typ rozlany klasyfikacji Lauréna rokuje gorzej niż typ jelitowy. Stopień złośliwości histologicznej (grading) koreluje z agresywnością guza i przebiegiem choroby, jednak w kilku badaniach nie potwierdzono korelacji stopnia złośliwości z rokowaniem. Inwazja naczyń jest niezależnym złym czynnikiem prognostycznym. Obecność zatorów nowotworowych wpływa na ryzyko nawrotu nowotworu i śmierci po radykalnej resekcji. Inwazja naczyń jest związana z większym zaawansowaniem miejscowym i większą agresywnością biologiczną nowotworu.
Klasyfikacja TNM
| Guz pierwotny – cecha T | |
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| Tis | Rak in situ, nowotwór śródnabłonkowy nie naciekający blaszki właściwej błony śluzowej |
| T1 | Guz nacieka blaszkę właściwą, blaszkę mięśniową błony śluzowej lub warstwę podśluzową |
| T1a | Guz nacieka blaszkę właściwą lub blaszkę mięśniową błony śluzowej |
| T1b | Guz nacieka warstwę podśluzową |
| T2 | Guz nacieka warstwę mięśniową |
| T3 | Guz nacieka tkankę łączną pod warstwą surowiczą, nie nacieka otrzewnej trzewnej i otaczających struktur (śledziony, wątroby, okrężnicy poprzecznej, jelita cienkiego, trzustki, ściany jamy brzusznej, przepony, nerki, nadnercze i przestrzeni zaotrzewnowej). Szerzenie się guza więzadłem żołądkowo-okrężniczym, żołądkowo-wątrobowym, siecią większą lub mniejszą bez przerwania ciągłości otrzewnej trzewnej. |
| T4 | Guz nacieka otrzewną trzewną lub sąsiadujące struktury |
| T4a | Guz nacieka otrzewną trzewną |
| T4b | Guz nacieka śledzionę, wątrobę, okrężnicę poprzeczną, jelito cienkie, trzustkę, ścianę jamy brzusznej, przeponę, nerkę, nadnercze i przestrzeń zaotrzewnową |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | Obecne są przerzuty w 1–2 regionalnych węzłach chłonnych |
| N2 | Obecne są przerzuty w 3–6 regionalnych węzłach chłonnych |
| N3 | Obecne są przerzuty w powyżej 7 regionalnych węzłach chłonnych |
| N3a | Obecne są przerzuty w 7–15 regionalnych węzłach chłonnych |
| N3a | Obecne są przerzuty w powyżej 15 regionalnych węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| Mx | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Obecne przerzuty odległe |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M |
| 0 | Tis | N0 | M0 |
| IA | T1 | N0 | M0 |
| IB | T2 | N0 | M0 |
| T1 | N1 | M0 | |
| IIA | T3 | N0 | M0 |
| T2 | N1 | M0 | |
| T1 | N2 | M0 | |
| IIB | T4a | N0 | M0 |
| T3 | N1 | M0 | |
| T2 | N2 | M0 | |
| T1 | N3 | M0 | |
| IIIA | T4a | N1 | M0 |
| T3 | N2 | M0 | |
| T2 | N3 | M0 | |
| IIIB | T4b | N0 | M0 |
| T4b | N1 | M0 | |
| T4a | N2 | M0 | |
| T3 | N3 | M0 | |
| IIIC | T4b | N2 | M0 |
| T4b | N3 | M0 | |
| T4a | N3 | M0 | |
| IV | dowolne T | dowolne N | M1 |
Leczenie

Jedyną metodą pozwalającą na wyleczenie jest chirurgiczna resekcja żołądka z odpowiednim marginesem zdrowych tkanek wolnych od nacieku nowotworowego oraz odpowiednio szerokie usunięcie okolicznych węzłów chłonnych. U części chorych przy bardzo wczesnym guzie wystarczającym postępowaniem jest leczenie endoskopowe. Jednak dla większości leczonych sam zabieg operacyjny jest niewystarczający i dla wszystkich chorych z operacyjnym guzem T2 i wyższym oraz w każdym przypadku zajęcia okolicznych węzłów chłonnych zaleca się okołooperacyjną chemioterapię. Alternatywnym postępowaniem jest chemioradioterapia.
U chorych po radykalnym onkologicznie zabiegu, którzy nie otrzymali leczenia przedoperacyjnego (chemioterapia okołooperacyjna), dalsze leczenie jest uzależnione od zaawansowania miejscowego guza. Guz Tis/T1N0 nie wymaga dalszego leczenia, jeśli został usunięty radykalnie onkologicznie (resekcja R0). W guzach T3-T4N0 oraz T1–T2N+ (z zajęciem węzłów chłonnych) zaleca się chemioradioterapię u wszystkich chorych. W guzach T2N0 chemioradioterapia jest zalecana wyłącznie u chorych z wysokim ryzykiem nawrotu, obejmując przypadki niskiego zróżnicowania/wysokiej złośliwości guza, inwazji struktur naczyniowych, nowotworu poniżej 50. roku życia oraz braku resekcji węzłów chłonnych w stopniu D2.
W przypadku guzów nieoperacyjnych zaleca się chemioradioterapię opartą na fluoropirymidynach (5-fluorouracyl, kapecytabina) lub taksanach. W przypadku nieradykalnych resekcji z naciekiem mikroskopowym lub makroskopowym w marginesach chirurgicznych (resekcja R1 i R2) zaleca się chemioradioterapię.
Choroba zaawansowana miejscowo, jej nawrót lub stadium rozsiane wymaga paliatywnej chemioterapii, która wydłuża przeżycie całkowite oraz poprawia jakość życia. Zaleca się chemioterapię dwulekową, która jest preferowana w chorobie lokalnie zaawansowanej lub z przerzutami. Schematy trójlekowe są lepsze dla chorych w dobrym stanie sprawności z dobrą tolerancją toksyczności leczenia. U chorych w złym stanie może być zastosowana chemioterapia za pomocą jednego leku lub tylko leczenie wspomagające z lub bez chemioterapii.
Leczenie chirurgiczne choroby ograniczonej do narządu

Operacja radykalna – gastrektomia z usunięciem węzłów chłonnych – jest jedyną metodą pozwalającą na całkowite wyleczenie choroby.
W stadium T1b–T3 przeprowadza się resekcję o zasięgu stosownym do wielkości guza. Niewielkie zmiany kwalifikowane jako guzy Tis i T1 mogą być usunięte endoskopowo. Zmianę nowotworową usuwa się w zakresie zdrowych tkanek z zachowaniem marginesu zdrowych tkanek powyżej 4 cm. W raku dystalnej części preferowana jest subtotalna resekcja jego dystalnej części. Metoda ma podobne wyniki końcowe w porównaniu do całkowitej gastrektomii, jednak pociąga za sobą mniej powikłań. Nowotwór zlokalizowany w trzonie wymaga totalnej gastrektomii. W raku proksymalnej żołądka części zaleca się proksymalną lub totalną gastektomię. W guzach T4 przeprowadza się resekcje en bloc (w jednym bloku tkankowym) z zajętymi strukturami. U wybranych chorych usunięcie żołądka z zajętymi sąsiednimi strukturami jest konieczne, aby uzyskać marginesy wolne od nacieku nowotworowego (resekcja R0), co może wydłużyć przeżycie w ten sposób leczonych chorych. Guzy Tis lub T1a mogą być leczone endoskopowo. Po resekcji żołądka ciągłość przewodu pokarmowego odtwarza się za pomocą zespolenia przełykowo-jelitowego na pętli Roux-en-Y. Wytworzenie zbiornika jelitowego poprawia jakość życia chorych.
Tylko u około 50% chorych udaje się przeprowadzić resekcję w obrębie zdrowych tkanek (resekcja R0). Za nieoperacyjne guzy uważa się zmiany naciekające otrzewną, zajęcie węzłów chłonnych grupy N3–N4, naciek dużych naczyń (bez tętnicy śledzionowej) lub obecność przerzutów odległych. Nie przeprowadza się powtórnych zabiegów operacyjnych z intencją wyleczenia w przypadku nawrotu oraz w przypadku mikroskopowo lub makroskopowego nacieku marginesów chirurgicznych wyciętego żołądka. Nie zaleca się profilaktycznej splenektomii i pankreatektomii (usunięcia trzustki). Rutynowa splenektomia nie przynosi korzyści w przeżyciu całkowitym, a może wiązać się z nieznacznym zwiększeniem śmiertelności zabiegu.
Limfadenektomia
Usunięcie okolicznych węzłów chłonnych (limfadenektomia) jest rutynowym postępowaniem w leczeniu raka żołądka. W zależności od rozległości operacji wyróżnia się trzy stopnie resekcji węzłów: D0, D1 i D2. Resekcja D0 obejmuje niepełną resekcję węzłów grupy N1. Resekcja D1 obejmuje węzły proksymalnej lub dystalnej części żółądka, obejmując węzły krzywizny mniejszej i większej. Resekcja D2 jest trudniejsza technicznie do wykonania, dodatkowo obejmuje również węzły lewej tętnicy żołądkowej, tętnicy wątrobowej wspólnej, pnia trzewnego, wnęki śledziony i tętnicy śledzionowej.
Zakres koniecznej resekcji węzłów chłonnych jest kontrowersyjny. Wyniki kilku metaanaliz wskazują na tendencję do poprawy przeżycia całkowitego (OS) u chorych, którzy przeszli resekcję D2. Wytyczne NCCN zalecają gastrektomię z resekcją D1 lub D2 z pobraniem co najmniej 15 węzłów chłonnych.
Leczenie endoskopowe wczesnego raka
Endoskopowa resekcja błony śluzowej (EMR) i endoskopowa dysekcja podśluzówkowa (ESD) są alternatywnymi sposobami postępowania w stosunku do klasycznych metod chirurgicznych w leczeniu wczesnego raka żołądka. Ze względu na późne rozpoznanie nowotworu w krajach zachodnich metoda ma ograniczone znaczenie praktyczne.
Bardzo ważna jest właściwa kwalifikacja chorych do leczenia endoskopowego, które nie pozwala na usunięcie węzłów chłonnych. Endoskopowo mogą być usuwane zmiany, w których ryzyko zajęcia węzłów chłonnych jest niewielkie. Prawdopodobieństwo zajęcia węzłów chłonnych rośnie wraz z wielkością guza, inwazją podśluzówkową, stopniem złośliwości histologicznej i inwazją naczyniową.
Leczenie endoskopowe jest wskazane w dobrze lub umiarkowanie zróżnicowanym gruczolakoraku, ograniczonym do błony śluzowej (guz Tis, T1a), o wielkości poniżej 2 cm, bez owrzodzenia lub blizny po owrzodzeniu oraz kiedy guz nie wykazuje cech zajęcia naczyń żylnych lub limfatycznych. Endoskopowa resekcja lecznicza musi być przeprowadzona w jednym bloku tkankowym (en block). Wycięcie en bloc wczesnego raka żołądka metodą ESD wykazuje większą skuteczność nad EMR, jednak jest trudniejsze technicznie do wykonania i niesie ze sobą większe ryzyko perforacji.
W dużym japońskim badaniu na 3800 chorych tylko w 5% przypadków raka ograniczonego do błony śluzowej stwierdzono obecność przerzutów, jednocześnie nie stwierdzono ich w żadnym raku poniżej 20 mm bez owrzodzenia i inwazji struktur naczyniowych. W badaniu klinicznym oceniającym skuteczność leczenia endoskopowego guzów poniżej 2 cm 84% chorych osiągnęło pięcioletnie przeżycie całkowite oraz 64% osiągnęło przeżycie dziesięcioletnie.
W Japonii stosowane są tzw. rozszerzone kryteria leczenia endoskopowego. Wynikają one z odmiennej klasyfikacji grupy ryzyka obecności przerzutów. Podział ten wyróżnia cztery grupy. Rozszerzone kryteria leczenia pozwalają rozważyć leczenie endoskopowe w zmianach z owrzodzeniem poniżej 30 mm przy spełnieniu dodatkowych kryteriów.
| Rak ograniczony do błony śluzowej | Rak ograniczony do błony podśluzowej | |||||
| Bez owrzodzenia | Z owrzodzeniem | Inwazja raka do górnej 1/3 grubości błony śluzowej |
Inwazja raka do 2/3 grubości błony śluzowej |
|||
| Wielkość | ≤20 mm | >20 mm | ≤30 mm | >30 mm | ≤30 mm | Każdy rozmiar |
| Typ jelitowy Lauréna | A | B | B | D | B | D |
| Typ rozlany Lauréna | C | D | D | D | D | D |
| Wskazania do postępowania: | ||||||
| A – konwencjonalne wskazania do operacji endoskopowej | ||||||
| B – tzw. poszerzone wskazania do operacji endoskopowej | ||||||
| C – leczenie chirurgiczne (leczenie endoskopowe tylko w ramach badań naukowych) | ||||||
| D – leczenie chirurgiczne | ||||||
Endoskopia jest stosowana w leczeniu paliatywnym. Metoda pozwala krótkotrwale opanować potencjalnie zagrażające życiu krwawienie z przewodu pokarmowego. Możliwe jest założenie przezskórnej gastrostomii endoskopowej, umożliwiającej odżywianie dojelitowe chorych z nieresekcyjnym guzem, znacznie mniej obciążając chorych niż klasyczną operacją. W nowotworach połączenia przełykowo-żołądkowego niedrożność można leczyć za pomocą metalowych stentów samorozprężalnych.
Leczenie okołooperacyjne
Optymalny wybór leczenia okołooperacyjnego w raku żołądka nie jest ustalony. Stosuje się chemioterapię okołooperacyjną lub chemioradioterapię adiuwantową. Brakuje dowodów wskazujących na wybór jednej z tych metod leczenia. W Stanach Zjednoczonych standardową metodą jest chemioradioterapia adiuwantowa, a w Europie, ze względu późną toksyczność chemioradioterapii i zastrzeżenia metodologiczne badań dotyczących chemioradioterapii, raczej stosuje się chemioterapię okołooperacyjną niż chemioradioterapię adiuwantową.
Chemioterapia okołooperacyjna
Chemioterapia okołooperacyjna jest w Europie przyjętym standardem leczenia raka żołądka ograniczonego do tego narządu. Leczenie składa się z chemioterapii neoadiuwantowej (przedoperacyjnej) oraz chemioterapii adiuwantowej (pooperacyjnej). Leczenie okołooperacyjne ma na celu zniszczenie mikroprzerzutów oraz zmniejszenie masy guza, umożliwiając radykalną operację z wolnymi marginesami wycięcia od nowotworu (resekcja R0). W leczeniu okołooperacyjnym stosuje się kilka programów leczniczych:
- ECF – epirubicyna, cisplatyna, 5-fluorouracyl,
- ECX – epirubicyna, cisplatyna, kapecytabina,
- EOF – epirubicyna, oksaliplatyna i 5-fluorouracyl,
- EOX – epirubicyna, oksaliplatyna i kapecytabina,
- CF – cisplatyna, 5-fluorouracyl.
Badanie MAGIC wykazało, że schemat ECF (epirubicyna, cisplatyna, 5-fluorouracyl) zwiększa pięcioletnie przeżycie całkowite chorych poddanych chemioterapii okołooperacyjnej z 23% do 36%. Podobne rezultaty osiągnięto w badaniu FNCLCC, gdzie schemat CF (cisplatyna, 5-fluorouracyl) zwiększał pięcioletnie przeżycie całkowite z 24% do 38%. Kapecytabina (prolek 5-fluorouracylu) wykazuje skuteczność podobną do 5-fluorouracylu i nie wymaga wkłucia centralnego.
Chemioterapia adiuwantowa (pooperacyjna)
Pooperacyjna chemioterapia jest zalecana u chorych z guzem T2N0, T3-T4N+ poddanych radykalnej resekcji żołądka (R0) z limfadenektomią D2 nie poddanych wcześniejszemu leczeniu przedoperacyjnemu. Nie udokumentowano korzyści z leczenia adiuwantowego bez leczenie neoadiuwantowego u chorych poddanych radykalnej resekcji z wycięciem węzłów chłonnych D0 i D1, dlatego u tych chorych leczeniem z wyboru jest chemioradioterapia.
W badaniu ACTS GC chorzy poddani gasterektomii i limfadenektomii D2 otrzymali adiuwantową chemioterapię za pomocą S-1, który jest skojarzeniem trzech substancji: tegafuru – proleku 5-fluorouracylu, gimeracylu – inhibitora dehydrogenazy dihydropirymidyny – oraz oksonianu potasu – substancji redukującej toksyczność dla przewodu pokarmowego. Chorzy poddani adiuwantowej chemioterapii częściej osiągali trzyletnie przeżycie całkowite (80%) w porównaniu do samego postępowania chirurgicznego, gdzie 70% osiągnęło trzyletnie przeżycie całkowite. W badaniu CLASSIC chorych po radykalnym zabiegu z resekcją węzłów D2 byli leczeni chemioterapią adiuwantową za pomocą kapecytabiny i oksaliplatyny. 74% leczonych adiuwantowo osiągnęło trzyletnie przeżycie wolne od choroby i 59% bez tej terapii.
Chemioradioterapia adiuwantowa
Chemioradioterapia jest to metoda, w której chemioterapię łączy się z napromieniowywaniem guza. W europejskich wytycznych ESMO u chorych w stadium przynajmniej IB bez wcześniejszej chemioterapii przedoperacyjnej w leczeniu okołooperacyjnym może być stosowana chemioradioterapia jako metoda równorzędna do chemioterapii okołooperacyjnej. Z kolei w amerykańskich wytycznych NCCN pooperacyjną chemioradioterapię zaleca się u chorych, którzy nie otrzymali przedoperacyjnej chemioterapii lub chemioradioterapii w guzach o zaawansowaniu T3 i T4 oraz w przypadku zajęcia lokalnych węzłów chłonnych. W guzach o zaawansowaniu T2 N0 można zastosować samodzielną chemioterapię adiuwantową, chemioradioterapię lub nie podejmować żadnego uzupełniającego leczenia (wyłączna kontrola kliniczna). W przypadku mikroskopowo (R1) lub makroskopowo (R2) dodatnich marginesów chirurgicznych również stosuje się chemioradioterapię niezależnie od zastosowanego leczenia neoadiuwantowego. Zaleca się dawki wynoszące od 45 do 50,4 Gy podzielone na frakcje wielkości 1,8 Gy dziennie. Większe dawki mogą być zastosowane w przypadku dodatnich marginesów chirurgicznych. Stosuje się symulacje 3D lub 4D do oceny optymalnej dystrybucji dawki. Planowanie dawki jest konieczne do redukcji niepotrzebnego i toksycznego napromieniowywania innych narządów.
Wyniki dwóch metaanaliz wskazują na korzyści dodania radioterapii pooperacyjnej do leczenia. W badaniu SWOG 9008/INT-0116 wykazano skuteczność pooperacyjnej chemioradioterapii za pomocą 5-fluorouracylu z leukoworyną u chorych, którzy nie otrzymali leczenia przedoperacyjnego. Chorzy, którzy otrzymali chemioradioterapię, wykazywali częstszy odsetek trzyletniego przeżycia całkowitego, które wynosił 50%, a u chorych leczonych wyłącznie chirurgicznie odsetek ten wynosił 41%.
Obecnie w chemioradioterapii stosuje się kapecytabinę albo 5-fluorouracyl z lub bez leukoworyny. Jednak skuteczność chemioradioterapii w guzach o zaawansowaniu T2 bez zajęcia węzłów chłonnych (N0) pozostaje niejasna. W badaniu ARTIST nie wykazano istotnego zmniejszenia ryzyka nawrotu u chorych po resekcji żołądka z limfadenektomią D2 i zastosowaniu chemioradioterapii. Z kolei w innym badaniu chemioradioterapia pooperacyjna była związana z niższym odsetkiem nawrotów w grupie po resekcji węzłów D1, jednak nie wykazano takich korzyści u chorych poddanych limfadenektomii D2.
Kilka badań wskazuje na skuteczność przedoperacyjnej sekwencyjnej chemioterapii indukcyjnej i następnie chemioradioterapii pooperacyjnej. Tego typu postępowanie może być odpowiednie dla wybranej grupy chorych, choć konieczne są dalsze wyniki badań.
Chemioradioterapia neoadiuwantowa
Skuteczność przedoperacyjnej (neoadiuwantowej) chemioradioterapii jest niepewna. Małe badania wskazują na potencjalną przydatność metody. Metoda bywa wykorzystywana w leczeniu raka połączenia żołądkowo-przełykowego, poza badaniami klinicznymi nie stosuje się jej rutynowo w leczeniu raka żołądka.
Leczenie nieoperacyjnej choroby zaawansowanej miejscowo
Nieoperacyjny rak żołądka bez przerzutów odległych jest leczony chemioterapią na podobnych zasadach, co choroba z przerzutami. Preferuje się programy dwulekowe, a u chorych w dobrym stanie sprawności programy trójlekowe.
U części chorych z granicznie nieresekcyjnym rakiem żołądka leczenie ogólnoustrojowe za pomocą chemioterapii lub opcjonalnie chemioradioterapii może umożliwić wykonanie radykalnej resekcji. U chorych w złym stanie sprawności, niekwalifikujących się do leczenia ogólnoustrojowego, stosuje się najlepszą terapię wspomagającą. W celu poprawy jakości życia wykonuje się zabiegi paliatywne.
Paliatywne leczenie chirurgiczne
Operacje paliatywne są przeprowadzane celem wydłużenia przeżycia chorych bez radykalnej onkologicznie resekcji, a więc bez założenia całkowitego usunięcia nowotworu. Operacje paliatywne mogą obejmować nieradykalne onkologicznie wycięcie guza oraz operacje bez resekcji guza. Często badania przedoperacyjne nie pozwalają przewidzieć koniecznego zakresu i rodzaju przeprowadzonego zabiegu, którego zakres zostaje ustalany podczas operacji. Paliatywne leczenie chirurgiczne u niektórych chorych przedłuża przeżycie całkowite.
Operacji paliatywnych bez resekcji, jeśli jest to możliwe, unika się ze względu na wysoki wskaźnik śmiertelności i opóźnienie chemioterapii. Tylko część chorych może uzyskać korzyść z zabiegów paliatywnych, dlatego operacje paliatywne są zalecane u starannie wybranych chorych z uciążliwymi objawami. Wybór postępowania jest uwarunkowany oceną wpływu na jakość życia, ryzyka wystąpienia groźnych powikłań, w tym krwawienia z guza, niedrożności przewodu pokarmowego, perforacji, trwałości uciążliwych objawów, kontroli bólu i stanu chorego pozwalającego wykonać zabieg.
Przy krwawieniu z guza preferuje się paliatywną resekcję. Z kolei w niedrożności można przeprowadzić paliatywną resekcję, utworzyć bypass żołądka (zespolenie omijające), gastrojejuniostomię (stomię odżywczą), ewentualnie zakłada się stent.
Leczenie nawrotu choroby po radykalnej operacji
Leczenie nawrotu choroby po radykalnej operacji jest trudne i zwykle jest związane z nieuleczalnością choroby. Nawrót choroby może występować pod postacią powstania przerzutów odległych, zajęcia otrzewnej albo pod postacią wznowy miejscowej (lokoregionalnej) obejmującej pojawienia się przerzutów raka w okolicznych węzłach chłonnych, nawrótu poza światłem narządu, nawrotu w pozostałej części żołądka lub nawrotu w zespoleniu.
Nie opracowano standardu leczenia nawrotu raka żołądka po leczeniu radykalnym. Podstawą leczenia nawrotu jest chemioterapia, u chorych ze wznową miejscową można przeprowadzić leczenie chirurgiczne. U chorych w złym stanie sprawności, niekwalifikujących się do leczenia ogólnoustrojowego, stosuje się wyłącznie najlepszą terapię wspomagającą.
Leczenie choroby z przerzutami i lokalnie zaawansowanej
Chemioterapia u chorych z lokalnie zaawansowaną chorobą, wznową lub przerzutami pomaga złagodzić uciążliwe objawy choroby, poprawić jakość życia chorych oraz pozwala przedłużyć przeżycie chorych, w porównaniu z najlepszym leczeniem wspomagającym. W metaanalizie wykazano, że jednolekowa chemioterapia paliatywna przekłada się na przedłużenie przeżycia całkowitego o około 6 miesięcy.
Wybór leczenia jest uwarunkowany stanem ogólnym chorego oraz obecnością współistniejących chorób. Schematy dwulekowe ze względu na niższą toksyczność są bardziej korzystne dla chorych z bardziej zaawansowanym nowotworem. Schematy trójlekowe są lepsze dla chorych w dobrym stanie ogólnym bez istotnych chorób współistniejących.
- Chemioterapia I linii
Schematy I linii leczenia choroby zaawansowanej klinicznie:
-
schemat DCF i jego modyfikacje:
- DCF – docetaksel, cisplatyna, 5-fluorouracyl,
- DOF – docetaksel, oksaliplatyna, 5-fluorouracyl,
- DPF – docetaksel, karboplatyna, 5-fluorouracyl,
-
schemat ECF i jego modyfikacje:
- ECF – epirubicyna, cisplatyna, 5-fluorouracyl,
- ECX – epirubicyna, cisplatyna, kapecytabina,
- EOF – epirubicyna, oksaliplatyna i 5-fluorouracyl,
- EOX – epirubicyna, oksaliplatyna i kapecytabina,
- IF – 5-fluorouracyl i irynotekan,
- CP – cisplatyna, 5-fluorouracyl,
- XP – cisplatyna, kapecytabina,
- CAPOX (XELOX) – oksaliplatyna, kapecytabina,
- FLO – fluorouracyl, leukoworyna (folinian wapnia), oksaliplatyna,
-
schematy dwulekowe:
- DC – docetaksel z cisplatyną,
- paklitaksel z karboplatyną,
- paklitaksel z cisplatyną,
- docetaksel z irynotekanem,
-
monoterapia:
- fluorouracyl,
- kapecytabina,
- docetaksel,
- paklitaksel.
W randomizowanym badaniu porównano połączenie docetakselu, cisplatyny i fluorouracylu (program DCF) z połączeniem epirubicyny, cisplatyny i 5-fluorouracyl (program ECF) oraz połączeniem docetakselu i cisplatyny (program DC). Wykazano, że program DCF wiązał się z większym odsetkiem odpowiedzi całkowitych kosztem większej mielosupresji i powikłań toksycznych.
Oceniono wiele modyfikacji schematu DCF. Badanie II fazy wskazuje, że jedna z tych modyfikacji – docetaksel, oksaliplatyna i fluorouracyl (program DOF) – wiąże się z lepszym przeżyciem całkowitym i dłuższym czasem do progresji choroby (TTP) w porównaniu do połączenia docetakselu i oksaliplatyny oraz połączenia docetakselu, oksaliplatyny i kapecytabiny. W badaniu V325 porównano schemat DCF z CF (cisplatyna i 5-fluorouracyl). Wykazano, że DCF powoduje większy odsetek odpowiedzi całkowitych (9,2 miesiąca dla DCF i 8,6 miesiąca dla CF) oraz większy odsetek odpowiedzi całkowitych (37% dla DCF i 25% dla CF).
Schematy oparte na fluorouracylu i kapecytabinie oceniono w badaniu REAL-2. Chorzy byli poddawani leczeniu za pomocą schematów ECF (epirubicyna, cisplatyna, 5-fluorouracyl), EOF (epirubicyna, oksaliplatyna i 5-fluorouracyl), ECX (epirubicyna, cisplatyna, kapecytabina) i EOX (epirubicyna, oksaliplatyna i kapecytabina). Wykazano, że kapecytabina i oksaliplatyna są równie skutecznie jak 5-fluorouracyl i cisplatyna. Schemat EOX wiązał się z najdłuższym przeżyciem całkowitym.
Podobną skuteczność kapecytabiny i fluorouracylu sugeruje również badanie ML17032, które porównało skuteczność połączenia kapecytabiny i cisplatyny (XP) oraz kombinacji 5-fluorouracylu i cisplatyny (FP). U leczonych schematem XP zaobserwowano lepsze przeżycie całkowite wynoszące 10,5 miesiąca w porównaniu do schematu FP, gdzie przeżycie całkowite wynosiło 9,3 miesiąca. Metaanaliza badań REAL-2 i ML17032 wskazuje, że programy zawierające kapecytabinę wywołują lepsze przeżycie całkowite w porównaniu do 5-fluorouracylu.
Irynotekan w połączeniu z różnymi cytostatykami oceniono w kilku badaniach klinicznych. W badaniu klinicznym III fazy wykazano nie niższe przeżycie całkowite w leczeniu za pomocą połączenia irynotekanu z 5-fluorouracylem (IF) w porównaniu do cisplatyny i 5-fluorouracylu (CF). Irynotekan z 5-fluorouracylem charakteryzował lepszy profil toksyczności. W innym badaniu II fazy irynotekan z kapecytabiną (XI) nie wiązał się z istotną różnicą w przeżyciu całkowitym w porównaniu z kapecytabiną z cisplatyną (XP). Porównywalną medianę przeżycia uzyskano przy stosowaniu programu FOLFIRI (5-fluorouracyl, leukoworyna, irynotekan) i ECF (epirubicyna, cisplatyna, 5-fluorouracyl) i schemat FOLFIRI może być zastosowany jako leczenie pierwszego rzutu dla chorych z zaawansowanym rakiem żołądka.
Nowy lek fluoropirymidyna S-1 wykazuje obiecujące efekty w leczeniu zaawansowanego raka żołądka. W badaniu SPIRITS fluoropirymidyna S-1 wykazała wyższe przeżycie całkowite wynoszące 13 miesięcy w porównaniu do cisplatyny, która zapewniała 11 miesięczne przeżycie całkowite. Z kolei w badaniu FLAGS fluoropirymidyna S-1 z cisplatyną wywoływała przeżycie całkowite podobne do cisplatyny i fluorouracylu wynoszące odpowiednio 8,6 i 7,9 miesięcy, ale wiązała się z lepszą skutecznością w typie rozlanym oraz lepszym profilem toksyczności.
- Chemioterapia II linii
U większości leczonych mimo początkowej poprawy dochodzi do rozwoju klinicznej oporności na leczenie I rzutu i progresji choroby. U części pacjentów można zastosować leczenie II rzutu. W metaanalizie wykazano znaczące obniżenie śmiertelności przy zastosowaniu chemioterapii II linii.
Schematy II linii leczenia choroby zaawansowanej klinicznie:
- preferowane schematy:
- paklitaksel z ramucirumabem,
- docetaksel,
- paklitaksel,
- irynotekan,
- ramucirumab,
- inne schematy:
- irynotekan i cisplatyna,
- irynotekan i 5-fluorouracyl lub kapecytabina,
- docetaksel i irynotekan.
- Chemioterapia dootrzewnowa
Chemioterapia dootrzewnowa bywa stosowana jako metoda eksperymentalna w leczeniu uzupełniającym po resekcji żołądka. Badano skuteczność chemioterapii dootrzewnowej bez hipertermii i ciągłą perfuzję otrzewnowej w hipertermii. Kilka badań wskazuje na skuteczność chemioterapii dootrzewnowej i może ona zwiększać przeżycie całkowite. Chemioterapia dootrzewnowa może poprawiać przeżycie u chorych z zaawansowanym rakiem żołądka.
- Trastuzumab
Trastuzumab to rekombinowane przeciwciało monoklonalne, które wybiórczo blokuje receptor typu 2 ludzkiego czynnika wzrostu naskórka (HER2). Zaleca się dodanie trastuzumabu do chemioterapii pierwszej linii. W badaniu ToGA chorzy z zaawansowanym rakiem żołądka z dodatnim receptorem HER2, którzy otrzymali chemioterapię z trastuzumabem, osiągnęli wyższą medianę przeżycia całkowitego niż chorzy, którzy otrzymali tylko chemioterapię (odpowiednio 13,8 i 11 miesięcy).
- Ramucirumab
Ramucirumab jest to przeciwciało przeciw VEGFR2. W badaniu klinicznym wykazano, że ramucirumab w połączeniu z paklitakselem wykazuje dłuższe przeżycie całkowite niż paklitaksel w monoterapii. Ramucirumab z paklitakselem oraz ramucirumab w monoterapii jest stosowany w leczeniu zaawansowanego raka żołądka w leczeniu II linii.
Rokowanie
| Stadium kliniczne | Przeżycie całkowite (%) | ||||
| 1 rok | 2 lata | 3 lata | 4 lata | 5 lat | |
| IA | 90,2 | 84,8 | 79,8 | 74,8 | 70,8 |
| IB | 87,4 | 77,9 | 69,9 | 62,7 | 57,4 |
| IIA | 82,1 | 67,4 | 57,2 | 50,2 | 45,5 |
| IIB | 76,8 | 58,3 | 46,0 | 38,4 | 32,8 |
| IIIA | 66,5 | 42,4 | 29,9 | 23,5 | 19,8 |
| IIIB | 61,6 | 35,4 | 22,9 | 17,8 | 14,0 |
| IIIC | 47,4 | 21,8 | 14,2 | 11,0 | 9,2 |
| IV | 27,0 | 10,0 | 5,6 | 4,5 | 4,0 |
| Stopień zaawansowania miejscowego (cecha T) |
Stopień zajęcia regionalnych węzłów chłonnych (cecha N) |
||
| T1 | 94% | N0 | 94% |
| T2 | 75% | N1 | 76% |
| T3 | 32% | N2 | 35% |
| T4 | 14% | N3 | 17% |
Historia
Pierwsze przypadki raka żołądka zanotowano na Papirusie Ebersa napisanym około 1550 r. p.n.e.Hipokrates wprowadził pojęcie raka i nowotworu i podał opis kilku chorób nowotworowych, w tym raka żołądka opisanego w dokumencie związanym z żyjącym później Galenem. Hipokrates ani Galen nie przeprowadzali sekcji zwłok, które, uznawane za nieetyczne, były zakazane. Doświadczenie czerpali z zaawansowanych guzów ujawniających się przez powłoki.
W 1835 roku Jean Cruveilhier odróżnił łagodny wrzód żołądka od owrzodzenia nowotworowego. William Brinton podał opis ponad 200 przypadków tej choroby. W 1959 William Brinton podał opis postaci linitis plastica.
Pierwszą próbę resekcji żołądka z powodu raka przeprowadził w 1879 francuski chirurg Jules-Émile Péan, jednak pacjent zmarł po pięciu dniach od operacji. Kolejną operację wykonał 6 listopada 1880 Ludwik Rydygier, profesor na Uniwersytecie Jagiellońskim, a później Lwowskim, jednak chory również zmarł. Pierwszą udaną dystalną gastrektomię z powodu raka żołądka u chorej z niedrożnością odźwiernika wykonał Theodor Billroth. Krótko przed nim pierwszą udaną dystalną gastrektomię u chorego z łagodnym wrzodem żołądka wykonał Ludwik Rydygier, dlatego w Polsce operację Billrotha I nazywa się operacją Rydygiera. W 1897 Karl Schlatter wykonał totalną gastrektomię.
W 1944 roku Kajitani wykazał znaczenie usunięcia węzłów chłonnych podczas resekcji raka żołądka. W 1951 roku NcNeer i współpracownicy wykazali, że operacja nie jest wskazana u każdego chorego z rakiem żołądka. W latach pięćdziesiątych powstała idea szerokiej resekcji żołądka z gastrektomią i wycięciem zajętych węzłów chłonnych. W latach sześćdziesiątych stwierdzono, że nie wszyscy chorzy wymagają gastrektomii i zaczęto wycinać guz w zakresie określonego marginesu, który wówczas uzależniano od typu nowotworu. W 1961 roku w Japonii zastosowano szeroką resekcję węzłów chłonnych (limfadektomię D2). W 1980 roku w leczeniu raka żołądka wprowadzono metody endoskopowe. W 1994 roku przeprowadzono pierwszą operację laparoskopową w leczeniu tej choroby.
Chemioterapię wprowadzono do leczenia nowotworów na początku lat pięćdziesiątych. W 1957 roku wprowadzono do leczenia raka żołądka 5-fluorouracyl, a w 1959 roku mitomycynę. W latach sześćdziesiątych do leczenia choroby zastosowano doksorubicynę i tegafur. Leczenie charakteryzował bardzo niski wskaźnik odpowiedzi i bardzo niewielki wpływ na przeżycie.
Pierwszym skutecznym programem leczniczym był FAM, czyli połączenie 5-fluorouracylu, doksorubicyny i mitomycyny. Wywoływał on odpowiedź u 40% leczonych, a mediana przeżycia wynosiła 5,5 miesiąca. Późniejsze badania podważyły skuteczność schematu FAM, nie wykazując przewagi nad 5-fluouracylem i doksorubicyną.
Przełomowe było wprowadzenie cisplatyny w późnych latach siedemdziesiątych, a następnie jej pochodnych. Pod koniec lat dziewięćdziesiątych wykazano, że ECF wykazuje przewagę nad FAM, FAMTX (5-fluorouracyl, doksorubicyna i metotreksat) i MCF (mitomycyna, cisplatyna, 5-fluorouracyl).
Współczesną diagnostykę zapoczątkował Holzknecht, który wprowadził w 1906 roku do diagnostyki raka żołądka flouoroskopię RTG. Metoda stała się standardową metodą diagnostyczną, jednak pozwalała rozpoznawać jedynie zaawansowaną chorobę. Metodę unowocześnił Shirakabe w 1958 roku, stosując metodę podwójnego kontrastu. Początki gastroskopii sięgają roku 1911, kiedy zastosowano sztywny gastroskop. Giętki endoskop po raz pierwszy użył Basil Hirschowitz w 1957 roku, który z czasem stał się standardem diagnostycznym.
Choroba u zwierząt
U zwierząt rak żołądka nie jest częsty i stwierdzano go u przedstawicieli bezkręgowców, ryb i ssaków, przede wszystkim psów, ale także u kotów, koni, bydła, owiec i świń. Nowotwory trawieńca są bardzo rzadkie i stwierdzono pojedyncze przypadki u bydła i owiec.
Epidemiologia raka żołądka u zwierząt jest mało poznana i w przypadku taksonów z dostępnymi szacunkowymi danymi odnotowuje mniej niż 1 przypadek na 100 000 osobników na rok (u psów 0,8 przypadków na 100 000 i koni 0,5 przypadków 100 000), co jest znacznie mniejszą zapadalnością w porównaniu do ludzi, choć w pewnych specyficznych populacjach odsetek ten może być większy. W porównaniu do innych nowotworów złośliwych rak żołądka u zwierząt nie jest częsty, u domowych mięsożernych ssaków stanowi mniej niż 1% rozpoznawanych nowotworów złośliwych.
- Histopatologia
Rak żołądka u zwierząt jest klasyfikowany jak u ludzi według klasyfikacji WHO, choć niektórzy autorzy proponują pewne modyfikacje tego systemu. Rzadko klasyfikuje się nowotwór według klasyfikacji Lauréna. Zwykle dominującym podtypem histopatologicznym jest gruczolakorak, jednak u koni jest to rak płaskonabłonkowy. U kotów najczęstszym złośliwym nowotworem nabłonkowym jest gruczolakorak i rak niezróżnicowany.
- Etiologia
Etiologia występowania raka żołądka u zwierząt jest bardzo mało poznana. Prawdopodobnie występują inne czynniki ryzyka niż te u ludzi. Rola zakażenia Helicobacter pylori i nitrozoamin nie została dostatecznie zbadana. Przypuszczalnie długotrwała podaż nitrozoamin ma związek przyczynowy z chorobą u psów, a przewlekłe zapalenie żołądka i zapalenie Helicobacter pylori ma związek z chorobą u kotów.
Prawdopodobnie zanieczyszczenie środowiska karcynogenami może wpływać na częstość występowania nowotworów złośliwych u dzikich zwierząt. Donoszono, że w populacji bieług żyjących w estuarium Rzeki Świętego Wawrzyńca zanieczyszczonej przez wielopierścieniowe węglowodory aromatyczne występowanie raka żołądka jest porównywalne do występowania raka żołądka u ludzi.
- Rozpoznanie
Rozpoznanie w większości przypadków jest stawiane w bardzo zaawansowanym stadium. W diagnostyce wykorzystuje się kontrastowe badanie radiologiczne, ultrasonografię i rzadko badanie endoskopowe. Ostateczne rozpoznanie stawia się na podstawie biopsji i badania histopatologicznego.
- Leczenie
Podstawową metodą leczenia jest chirurgiczna resekcja żołądka i odtworzenie ciągłości przewodu pokarmowego. Zwykle wykonuje się całkowite wycięcie żołądka lub wycięcie dystalnej części żołądka analogicznie do operacji Billroth I. Nie wykorzystuje się rutynowo radioterapii i chemioterapii.
Uwagi
Bibliografia
- J.A. Ajani, D.J. Bentrem, S. Besh, T.A. D’Amico i inni. Gastric cancer, version 2.2015. „National Comprehensive Cancer Network”, 2015.
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2014. Kraków: Medycyna Praktyczna, 2014. ISBN 978-83-7430-405-4.
- S.R.S.R. Hamilton S.R.S.R., L.A.L.A. Aaltonen L.A.L.A., Pathology and Genetics of Tumours of the Digestive System, Lyon: IARC Press, 2000, ISBN 92-83-22410-8 [dostęp 2015-05-30] [zarchiwizowane z adresu 2018-07-28] .
- Bertram G. Katzung: Gastrointestinal Oncology. Oxford University Press, 2003. ISBN 978-0-19-974786-3.
- Christopher D.M. Fletcher: Diagnostic Histopathology of Tumors. Elsevier Health Sciences, 2007. ISBN 978-0-7020-3205-9.
- Vinay Kumar, Ramzi S. Cotran, Stanley L. Robins: Robins Patologia. Wrocław: Elsevier Urban & Partner, 2005. ISBN 83-89581-92-2.
- David Kelsen: Principles and Practice of Gastrointestinal Oncology. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7617-2.
- Lazăr Daniela: Gastric Carcinoma – New Insights into Current Management. InTech, 2013. ISBN 978-953-51-0914-3.
- Radzisław Kordek: Onkologia. Podręcznik dla studentów i lekarzy. Gdańsk: VIA MEDICA, 2007. ISBN 978-83-7555-016-0.
- Robert D. Odze, John R. Goldblum: Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. Elsevier Health Sciences, 2009. ISBN 978-1-4160-4059-0.
- Dongfeng Tan, Gregory Lauwers: Advances in Surgical Pathology: Gastric Cancer. Lippincott Williams & Wilkins, 2012. ISBN 978-1-4511-5378-1.
- Derek Raghavan, Martin L. Brecher, David H. Johnson, Neal J. Meropol, Paul L. Moots, Peter G. Rose: Textbook of Uncommon Cancer. John Wiley & Sons, 2006, s. 352. ISBN 978-0-470-03055-4.
- Stephen Hauser: Mayo Clinic Gastroenterology and Hepatology Board Review. Oxford University Press, 2014. ISBN 978-0-19-937333-8.
- Stephen J. Withrow, David M. Vail, Rodney Page: Withrow and MacEwen’s Small Animal Clinical Oncology. Elsevier Health Sciences, 2013. ISBN 978-0-323-24197-7.
- Donald J. Meuten: Tumors in Domestic Animals. John Wiley & Sons, 2008. ISBN 978-0-470-37670-6.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.