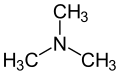
Trimetyloamina
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
C3H9N |
||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
N(CH3)3, NMe3 |
||||||||||||||||||||||
| Masa molowa |
59,11 g/mol |
||||||||||||||||||||||
| Wygląd |
bezbarwny gaz |
||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Trimetyloamina, N(CH3)3 – organiczny związek chemiczny z grupy amin. Najprostsza amina trzeciorzędowa o właściwościach silnie higroskopijnych i zapachu zbliżonym do amoniaku w wyższych stężeniach. Dobrze rozpuszczalna w wodzie, jest stosunkowo silną zasadą (pKa 9,87), zgodnie z reakcją:
- (CH3)3N + H2O ⇌ (CH3)3NH+ + OH−
W handlu dostępna w postaci czystej w butlach pod ciśnieniem lub w postaci roztworów, zwykle jako 40% roztwór wodny lub 33% roztwór w etanolu.
Powstaje podczas rozkładu roślin i zwierząt, odpowiedzialna jest za zapach nieświeżych ryb, niektórych zakażeń oraz nieświeżego oddechu. Jest bezpośrednią przyczyną nieprzyjemnego, rybiego zapachu ciała w trimetyloaminurii (jedno z rzadkich wrodzonych zaburzeń metabolizmu).
Otrzymywanie
Trimetyloaminę otrzymuje się w reakcji amoniaku z alkoholem metylowym przeprowadzanej w fazie gazowej w temperaturze 370–430 °C pod ciśnieniem 20–30 barów z użyciem tlenków glinu i krzemu jako katalizatora kwasowego:
- 3 CH3OH + NH3 → (CH3)3N + 3 H2O
Produktami w/w reakcji są też niższe metyloaminy, (CH3)2NH i CH3NH2 oraz woda. Produkt oczyszcza się poprzez destylację pod ciśnieniem.
W warunkach laboratoryjnych trimetyloaminę można otrzymać w reakcji chlorku amonu z paraformaldehydem:
- 9 (CH2=O)n + 2n NH4Cl → 2n (CH3)3N•HCl + 3n H2O + 3n CO2↑
W drugim etapie wolną aminę wydziela się z chlorowodorku działaniem NaOH.
Zastosowanie
Trimetyloamina stosowana jest jako substrat w produkcji choliny, hormonów roślinnych, wodorotlenku tetrametyloamoniowego, katalizator i zasada w syntezie organicznej. Gazowe czujniki świeżości ryb wykrywają trimetyloaminę powstającą podczas psucia się produktu.
Linki zewnętrzne
- Simon Cotton: Molecule of the Month: Trimethylamine. School of Chemistry, University of Bristol, 08.2004. [dostęp 2012-04-30]. (ang.).
- NIST Webbook data