
Mięsak jasnokomórkowy
 Mięsak jasnokomórkowy, obraz mikroskopowy | |
| Klasyfikacje | |
| ICD-10 |
C49 |
|---|---|
| C49.0 |
Tkanka łączna i inne tkanki miękkie głowy, twarzy i szyi |
| C49.1 |
Tkanka łączna i inne tkanki miękkie kończyny górnej, łącznie z barkiem |
| C49.2 |
Tkanka łączna i inne tkanki miękkie kończyny dolnej, łącznie z biodrem |
| C49.3 |
Tkanka łączna i inne tkanki miękkie klatki piersiowej |
| C49.4 |
Tkanka łączna i inne tkanki miękkie brzucha |
| C49.5 |
Tkanka łączna i inne tkanki miękkie miednicy |
| C49.6 |
Tkanka łączna i inne tkanki miękkie tułowia, umiejscowienie nieokreślone |
| C49.8 |
Zmiana przekraczająca granice jednego umiejscowienia w obrębie tkanki łącznej i tkanek miękkich |
| C49.9 |
Tkanka łączna i inne tkanki miękkie, umiejscowienie nieokreślone |
| ICDO |
9044/3 |
{{Choroba infobox}}
|
Mięsak jasnokomórkowy, CCS (od ang. clear cell sarcoma) – bardzo rzadki nowotwór złośliwy należący do grupy mięsaków tkanek miękkich o nieznanym kierunku różnicowania. Mięsak jasnokomórkowy najczęściej występuje wśród młodych dorosłych pomiędzy 20. a 40. rokiem życia. Klinicznie nowotwór nie daje żadnych charakterystycznych objawów, często manifestując się jako powoli powiększający się guz w głębokich tkankach miękkich, czasem powodując ból lub tkliwość w badaniu palpacyjnym. Guz najczęściej jest zlokalizowany w obrębie kończyny dolnej, szczególnie w zakresie stopy i okolicy stawu skokowego. Rozpoznanie mięsaka jest stawiane na podstawie badania histopatologicznego materiału uzyskanego drogą biopsji gruboigłowej. Leczenie choroby bez przerzutów polega na chirurgicznej resekcji guza w zakresie zdrowych tkanek z zachowaniem odpowiedniego marginesu chirurgicznego tkanek wolnych od nacieku nowotworowego. Leczenie nieoperacyjnego guza lub choroby z przerzutami wymaga leczenia ogólnoustrojowego, jednak mięsak jasnokomórkowy wykazuje znaczną oporność na klasyczną chemioterapię.
Epidemiologia
Mięsak jasnokomórkowy jest bardzo rzadkim nowotworem, stanowi poniżej 1% mięsaków. Roczna zapadalność jest oceniana na 0,08 przypadków na 1 milion. Mięsak jasnokomórkowy dotyczy przede wszystkim osób młodych pomiędzy 20. a 40. rokiem życia z medianą przypadającą na około 30. rok życia. Występowanie nowotworu poniżej 10. roku życia lub powyżej 50. jest rzadkie. Nieznacznie częściej chorują kobiety.
Obraz kliniczny
Mięsak jasnokomórkowy nie daje charakterystycznych objawów. Nowotwór objawia się jako twardy, powoli powiększający się guz w głębokich tkankach miękkich, czasem dający dolegliwości bólowe lub tkliwość w badaniu palpacyjnym. Najczęściej mięsak jest zlokalizowany w obrębie dystalnych części kończyny dolnej (75% przypadków), szczególnie w zakresie stopy i okolicy stawu skokowego (40% chorych), a także stawu kolanowego (20%) i kończyny górnej (30%), bardzo rzadko pojawia się w obrębie tułowia oraz głowy i szyi. Mięsak jasnokomórkowy zwykle jest połączony ze ścięgnem, powięzią lub rozcięgnem. Skóra nad guzem zwykle jest niezmieniona.
Historia naturalna
Mięsak jasnokomórkowy cechuje się charakterystyczną historią naturalną, w której obserwuje się typowe cechy kliniczne mięsaków tkanek miękkich, takie jak lokalizacja w głębokich tkankach miękkich i tendencja do wytwarzania przerzutów w płucach, a także cechy przebiegu choroby charakteryzujące czerniaka jak lokalizacja w dystalnych częściach kończyn, wysoka zdolność do tworzenia przerzutów w lokalnych węzłach chłonnych i przerzutów in transit. Zwykle mięsak jasnokomórkowy początkowo wykazuje powolny, indolentny wzór wzrostu, który następnie przybiera agresywny przebieg z wczesnym pojawieniem się przerzutów odległych. Często stwierdza się kilkunastomiesięczny wywiad powoli powiększającego się guza. Zwykle w momencie rozpoznania guz osiąga wielkość kilku centymetrów, jednak czasem rozmiar guza przekracza 15 cm. Podstępny przebieg choroby często jest powodem opóźnienia rozpoznania choroby nowotworowej i wdrożenia leczenia. U jednej trzeciej chorych choroba jest rozpoznawana w stadium znacznego zaawansowania miejscowego lub obecności synchronicznych przerzutów.
Większość mięsaków tkanek miękkich szerzy się drogą krwionośną, jednak w przeciwieństwie do innych tego typu nowotworów mięsak jasnokomórkowy wykazuje znaczną zdolność do wytwarzania przerzutów do lokalnych węzłów chłonnych, które w różnym okresie choroby pojawiają się u blisko połowy chorych. Pojawienie się przerzutów do węzłów chłonnych często poprzedza rozwój przerzutów odległych. Przerzuty odległe występują u około połowy chorych, najczęściej się lokalizują w płucach i kościach. Mięsak jasnokomórkowy wykazuje wysoką tendencję do nawrotów pod postacią wznów miejscowych lub przerzutów odległych. Nierzadko obserwuje się bardzo późne przerzuty po 10–20 latach od leczenia, szczególnie u chorych z kilkoma nawrotami miejscowymi.
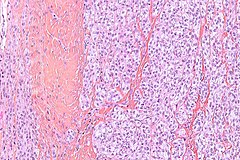
Histopatologia
Makroskopowo guz stanowi drobnoguzkową lub zrazikową spoistą masę ściśle związaną ze ścięgnem, rozcięgnem lub powięzią, koloru szarobiałego. Na przekroju mogą być obecne ogniska martwicy, krwotoków lub zwyrodnienia torbielowatego. Rzadko mogą być obecne brązowe lub czarne ogniska odpowiadające nagromadzeniu melaniny.
W obrazie mikroskopowym utkanie guza tworzą gęste gniazda lub pęczki komórek wrzecionowatych lub poligonalnych pooddzielane przegrodami łącznotkankowymi. Komórki o wrzecionowatym lub wielobocznym kształcie są wyraźnie odgraniczone, posiadają obfitą jasną lub słabo eozynofilną cytoplazmę z pęcherzykowym jądrem i wydatnym bazofilnym jąderkiem. Aktywność mitotyczna jest niska, podobnie stopień pleomorfizmu jest niewielki. W około połowie guzów obecne są wielojądrowe komórki olbrzymie oraz ogniska melaniny.
Etiologia
Rola translokacji t(12;22)
W większości przypadków mięsaka jasnokomórkowego obserwuje się zrównoważoną translokację t(12;22)(q13;q12). Mutacja powstaje na bardzo wczesnym etapie procesu nowotworzenia i nie znajduje się jej w innych nowotworach złośliwych. W wyniku mutacji dochodzi do połączenia genu EWSR1 położonego na chromosomie 22q12 z genem ATF1 położonym w chromosomie 12q13 i powstania genu fuzyjnego EWSR1-ATF1. Rzadziej obserwuje się translokację t(2;22)(q34;q12) z połączeniem genu CREB1 położonego na chromosomie 2q34 z genem EWSR1 i powstaniem genu fuzyjnego EWSR1-CREB1.
EWSR1 poza rolą w patogenezie mięsaka jasnokomórkowego jest zaangażowany w powstawanie guzów z rodziny mięsaka Ewinga, guza włóknistohistiocytarnego naczyniakowatego, guza desmoplastycznego drobnookrągłokomórkowego, pozakostnego chrzęstniakomięsaka śluzowatego. Rearanżację genu EWSRI obserwuje się w 70–90% przypadków mięsaka jasnokomórkowego. ATF1 i CREB1 są czynnikami transkrypcyjnymi typu suwak leucynowy.
W genie fuzyjnym gen EWSR1 zastępuje domenę aktywacyjną ATF kontrolując jego aktywność, co w konsekwencji prowadzi do stałej (konstytutywnej) aktywności ATF. Białko fuzyjne EWSR1-ATF1 wpływa na aktywność wielu genów, jednak najważniejsza jest aktywacja MiTF. W warunkach fizjologicznych MiTF jest aktywowany przez melanotropinę (MSH) i jest kluczowym regulatorem różnicowania melanocytów oraz kontroluje produkcję melaniny. W wyniku aktywacji promotora genu MiTF przez EWSR1-ATF1 dochodzi do stymulacji proliferacji i oporności na apoptozę komórek nowotworowych i przybrania przez nie fenotypu melanocytów, czego konsekwencją są trudności z różnicowaniem z czerniakiem. Podobna mutacja z powstaniem genu fuzyjnego EWSR1-CREB1 występuje w guzie włóknistohistiocytarnym naczyniakowatym, jednak nie prowadzi ona do wytworzenia fenotypu melanocytów. Sugeruje to, że niezbędnym elementem koniecznym do powstania mięsaka jasnokomórkowego poza mutacją kierunkową EWSR1-ATF1 mogą być dodatkowe czynniki wiążące się z samym pochodzeniem nowotworu lub dodatkowymi mutacjami.
Pochodzenie nowotworu
Nie ustalono pochodzenia i linii różnicowania mięsaka jasnokomórkowego. W konsekwencji powstania genu fuzyjnego EWS-ATF1 i aktywacji MiTF dochodzi do powstania fenotypu i ekspresji markerów typowych dla melanocytów, jednak można zidentyfikować przypadki mięsaka jasnokomórkowego z obecnością genu fuzyjnego EWS-ATF1 bez ekspresji markerów melanocytów. Badanie na komórkach mysich z indukowaną ekspresją EWSR1-ATF1 w mezenchymalnych komórkach macierzystych powodowało powstawanie nowotworu przypominającego mięsaka jasnokomórkowego.
Rozpoznanie
Kliniczne podejrzenie mięsaka tkanek miękkich jest stawiane na podstawie obrazu klinicznego oraz wyników badań obrazowych. Ostateczne rozpoznanie wymaga badania histopatologicznego materiału uzyskanego drogą biopsji gruboigłowej.
Badania obrazowe
Badania obrazowe pozwalają na postawienie podejrzenia mięsaka tkanek miękkich, ocenę zaawansowania choroby oraz zaplanowanie biopsji, która umożliwia wykonanie badania histopatologicznego i ostateczne rozpoznanie.
W zdjęciu rentgenowskim (RTG) mięsak jasnokomórkowy może dawać niecharakterystyczny obraz guza, przy czym małe zmiany mogą nie być uwidocznione tą metodą. Ultrasonografia (USG) pozwala uwidocznić guza położonego w tkankach miękkich, metoda często jest stosowana we wstępnej diagnostyce, ale wymaga późniejszego przeprowadzenia dokładniejszych badań, takich jak rezonans magnetyczny czy tomografia komputerowa.
Tomografia komputerowa (TK) wykazuje obecność izodensyjnego guza w tkankach miękkich ulegającego intensywnemu wzmocnieniu kontrastowemu.
Rezonans magnetyczny (MRI) jest podstawową metodą diagnostyczną mięsaków położonych w obrębie kończyn i tułowia. Większość guzów uwidacznia się jako policykliczny dobrze odgraniczony guz, który w obrazach T1-zależnych daje homogenny obraz, a w obrazach T2-zależnych nieznacznie bardziej heterogenny. W obrazach T1-zależnych guz ma nieco hiperintensywny sygnał w stosunku do mięśni szkieletowych, co jest związane z paramagnetycznymi właściwościami zawartej w guzie melaniny. Hiperintensywny sygnał w obrazach T1-zależnych nie jest częstym zjawiskiem w mięsakach tkanek miękkich, co ma pewne znaczenie w diagnostyce różnicowej. W obrazach T2-zależnych większość guzów daje hiperintensywny sygnał, a w mniejszej części izointensywny sygnał. Po podaniu kontrastu gadolinowego większość guzów ulega silnemu wzmocnieniu kontrastowemu.
Biopsja
Podejrzenie rozpoznania mięsaka tkanek miękkich wymaga uzyskania materiału tkankowego do badania histopatologicznego, który uzyskuje się podczas biopsji. Zabieg można wykonać metodą biopsji gruboigłowej lub otwartej biopsji nacinającej, choć preferuje się technikę biopsji gruboigłowej. Przed wykonaniem biopsji konieczne jest dokładne zaplanowanie zabiegu, by nie utrudniał on późniejszego wykonania radykalnego zabiegu chirurgicznego, w którym usuwa się miejsce wykonania biopsji.
Badanie histopatologiczne
Materiał pobrany podczas biopsji lub preparat pooperacyjny jest barwiony i oceniany pod mikroskopem. W obrazie mikroskopowym obecne są komórki wrzecionowate lub poligonalne o jasnej cytoplazmie ułożone w gęste gniazda lub tworzące pęczki.
Badanie immunohistochemiczne wykazuje obecność antygenów związanych z produkcją melaniny, w tym rozlaną reakcję cytoplazmatyczną dla HMB-45, jądrową i cytoplazmatyczną reakcję dla S-100 oraz MiFT. Rzadziej stwierdza się dodatnią reakcję dla Melan-A, CD99, NSE i wimentyny. Reakcje dla cytokeratyn, antygenu rakowo-płodowego, desminy, SMA zwykle są ujemne.
W zdecydowanej większości przypadków mięsaka jasnokomórkowego obecna jest translokacja t(12;22)(q13;q12). Oznaczenie translokacji ma znaczenie diagnostyczne, szczególnie w diagnostyce różnicowej. W praktyce klinicznej w tym celu wykonuje się RT-PCR lub FISH. FISH wykazuje czułość około 70%, a RT-PCR powyżej 90% w wykrywaniu genu fuzyjnego EWSR1-ATF1, jednak metoda wymaga dobrej jakości materiału biologicznego.
Mięsak jasnokomórkowy różnicuje się z czerniakiem, mięśniakomięsakiem prążkowanokomórkowym, złośliwym nowotworem osłonek nerwów obwodowych, mięsakiem maziówkowym oraz włókniakomięsakiem. Czerniak prezentuje podobny obraz mikroskopowy oraz cechy immunohistochemiczne, przez co różnicowanie z tym nowotworem jest trudne, szczególnie w przypadku przerzutów o nieznanym punkcie wyjścia. Mięsak jasnokomórkowy od czerniaka guzkowego odróżnia lokalizacja w głębokich tkankach miękkich, rzadkie zajmowanie skóry oraz wrzecionowaty kształt komórek. W różnicowaniu obu nowotworów przydatne są badania genetyczne i potwierdzenie obecności translokacji t(12;22).
Leczenie
Leczenie mięsaka jasnokomórkowego bez przerzutów polega na chirurgicznej resekcji guza w zakresie zdrowych tkanek z zachowaniem odpowiedniego marginesu chirurgicznego tkanek wolnych od nacieku nowotworowego. Leczenie nieoperacyjnego guza lub choroby z przerzutami wymaga leczenia ogólnoustrojowego, jednak mięsak jasnokomórkowy wykazuje znaczną oporność na klasyczną chemioterapię.
Leczenie choroby bez przerzutów
Podstawową metodą leczenia mięsaka jasnokomórkowego jest chirurgiczna resekcja guza w zakresie zdrowych tkanek z zachowaniem odpowiedniego marginesu chirurgicznego tkanek wolnych od nacieku nowotworowego (resekcja R0). Operacja polega na szerokiej resekcji mięśnia lub przedziałowej resekcji grupy mięśni według Ennekinga. Osiągnięcie kilkucentymetrowego marginesu zdrowych tkanek jest trudne i margines w pobliżu struktur stanowiących barierę dla szerzenia się mięsaka takich jak powięź, onerwie, przydanka naczynia czy okostna, może być węższy, a szerszy margines w innych tkankach, szczególnie tych położonych wzdłuż osi długiej kończyny. Guz jest wycinany w jednym bloku tkankowym ze zdrowymi tkankami (en block) razem z miejscem wykonania biopsji diagnostycznej.
Mięsak jasnokomórkowy stosunkowo często wytwarza przerzuty do regionalnych węzłów chłonnych, ale rola limfadenektomii w uzyskiwaniu lokalnej kontroli choroby jest niejasna. Limfadenektomia zwykle jest wykonywana w przypadku klinicznego podejrzenia rozsiewu do lokalnych węzłów chłonnych lub potwierdzenia cytologicznego zajęcia węzłów chłonnych w biopsji cienkoigłowej. W niektórych ośrodkach wykonuje się biopsję węzła wartowniczego i w przypadku wykrycia w nim przerzutów przeprowadza się limfadenktomię.
Według zaleceń ESMO radioterapia adiuwantowa jest elementem leczenia skojarzonego mięsaków tkanek miękkich o wysokiej złośliwości (G2 i G3) i wielkości powyżej 5 cm. Choć w mięsaku jasnokomórkowym nie zaleca się określania jego stopnia złośliwości według FNCLCC, to jednak ze względu na przebieg kliniczny zwykle przyjmuje się postępowanie jak dla mięsaka o wysokim stopniu złośliwości (G3). Część autorów zaleca adiuwantową radioterapię jako rutynowe postępowanie po radykalnym leczeniu chirurgicznym. Z kolei inni autorzy sugerują wykorzystanie radioterapii przy wąskich marginesach resekcji lub braku osiągnięcia marginesów wolnych od nacieku nowotworowego.
Leczenie choroby z przerzutami
Mięsak jasnokomórkowy jest mięsakiem opornym na klasyczną chemioterapię. Większość danych opiera się na seriach przypadków z dużych ośrodków onkologicznych. Stosowane w leczeniu mięsaków tkanek miękkich schematy oparte o doksorubicynę wykazują niewielką skuteczność. W badaniu na 24 chorych leczonych programami opartych na doksorubicynie w połączeniu z ifosfamidem lub cisplatyną albo innymi cytostatykami uzyskano jedynie 4% odsetek odpowiedzi obiektywnych, tylko jeden chory uzyskał częściową odpowiedź. We włoskim badaniu na 11 chorych leczonym doksorubicyną z dakarbazyną z lub bez ifosfamidu dwaj chorzy uzyskali częściową odpowiedź, a trzej stabilizację choroby. W innym badaniu retrospektywnym u chorych leczonych różnymi schematami, w tym zawierających doksorubicynę, ifosfamid, cisplatynę, dakarbazynę, cyklofosfamid, winkrystynę i bleomycynę, u 7 chorych uzyskano częściową odpowiedź, a u 17 chorych stabilizację choroby, przy czym u łącznie 7 chorych leczonych programami opartymi na cisplatynie zaobserwowano odpowiedź obiektywną.
W dużej proporcji zaawansowanych mięsaków jasnokomórkowych obserwuje się ekspresję PDGF. Uzasadnia to badania nad inhibitorami kinazy tyrozynowej obejmujących w swoim spektrum PDGF takimi jak sunitynib czy sorafenib. Istnieją doniesienia o odpowiedziach obiektywnych podczas leczenia za pomocą sunitynibu oraz sorafenibu. Spektrum działania pazopanibu uzasadnia dalsze badania nad jego skutecznością w leczeniu mięsaka jasnokomórkowego.
W konsekwencji powstania genu fuzyjnego EWSR1-ATF1 i aktywacji MiTF dochodzi do nadmiernej ekspresji MET i następnie aktywacji szlaków PI3K/AKT i ERK. W badaniach przedklinicznych inhibitory MET powodowały zahamowanie proliferacji mięsaka jasnokomórkowego. W badaniu II fazy oceniającej skuteczność selektywnego inhibitora MET tywantynibu (ARQ197) w leczeniu nowotworów związanych z MiTF, w tym raka nerki związanego z translokacją Xp11.2, mięsaka pęcherzykowego oraz mięsaka jasnokomórkowego, 9% chorych z mięsakiem jasnokomórkowym leczonych tywantynibem osiągnęło częściową odpowiedź, a 27% stabilizację choroby. W trakcie badań II fazy pozostaje inhibitor MET/ALK kryzotynib.
Ze względu na agresywny przebieg kliniczny rutynowo nie wykonuje się metastazektomii.
Rokowanie
Rokowanie w mięsaku jasnokomórkowym jest złe. Ocenia się, że przeżycie pięcioletnie osiąga około 60–70%, a dziesięcioletnie 40–50%. Około 84% chorych doświadcza wznowy miejscowej, u 63% pojawiają się przerzuty synchroniczne i u 30% przerzuty metachroniczne.
Historia
Nowotwór po raz pierwszy opisał w 1965 roku Franz Enzinger.
Bibliografia
- John R. Goldblum, Sharon W. Weiss, Andrew L. Folpe: Enzinger and Weiss's Soft Tissue Tumors. Wyd. 6. Elsevier Health Sciences, 2013. ISBN 978-0-323-08834-3.
- Christopher D.M. Fletcher, K. Krishnan Unni, Fredrik Mertens: Pathology and Genetics of Tumours of Soft Tissue and Bone. Lyon: IARC Press, 2002.
- Piotr Rutkowski: Biblioteka chirurga onkologa. Mięsaki tkanek miękkich. Via Medica, 2015. ISBN 978-83-7599-864-1.
- Margaret von Mehren, R. Lor Randall, Robert S. Benjamin, Sarah Boles i inni. Soft Tissue Sarcoma Version 1.2016. „J Natl Compr Canc Netw”, 2016.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Murray F. Brennan, Cristina R. Antonescu, Robert G. Maki: Management of Soft Tissue Sarcoma. Springer Science & Business Media, 2012.
- Piotr Rutkowski, Zbigniew Nowecki: Mięsaki tkanek miękkich u dorosłych. Medical Tribune, 2009. ISBN 978-83-60135-69-3.
- PG. Casali, JY. Blay, A. Bertuzzi, S. Bielack i inni. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 25 Suppl 3, s. iii102-12, Sep 2014. DOI: 10.1093/annonc/mdu254. PMID: 25210080.

