
Rak nerki
| carcinoma renis | |
 Rak nerki | |
| Klasyfikacje | |
| ICD-10 |
C64 |
|---|---|
{{Choroba infobox}}
|
Rak nerki (łac. carcinoma renis), rak nerkowokomórkowy, RCC (od ang. renal cell carcinoma) – grupa nowotworów złośliwych wywodzących się z nabłonka kanalików nerkowych. Dawniej nazywany guzem Grawitza lub nadnerczakiem, jest najczęstszym nowotworem złośliwym nerek, stanowiąc 90% zmian złośliwych dotyczących tego narządu. Histologicznie 80% guzów to rak jasnokomórkowy.
Choroba początkowo jest bezobjawowa (rzadko występuje klasyczna triada objawów, czyli guz wyczuwalny w okolicy lędźwiowej, ból w okolicy lędźwiowej i krwiomocz). Nowotwór coraz częściej jest wykrywany przypadkowo w badaniach obrazowych wykonanych z innych powodów. Chorobie często towarzyszą zespoły paranowotworowe, które mogą być pierwszym objawem procesu rozrostowego.
W diagnostyce największe znaczenie mają badania obrazowe, szczególnie tomografia komputerowa. Badania obrazowe pozwalają postawić radiologiczne rozpoznanie choroby, ocenić wielkość guza, naciekanie okolicznych struktur, zajęcie węzłów chłonnych i stwierdzić obecność przerzutów. Umożliwia to ocenę zaawansowania choroby w klasyfikacji TNM. Podstawą ostatecznego rozpoznania jest badanie histopatologiczne próbek uzyskanych drogą biopsji lub preparatu po nefrektomii. Umożliwia ono odróżnienie postaci histologicznej i ocenę złośliwości w skali Fuhrman.
Zarówno typ histologiczny, złośliwość w skali Fuhrman, jak i zaawansowanie choroby w klasyfikacji TNM, są ważnymi czynnikami rokowniczymi oraz mają istotny wpływ na wybór strategii leczenia. W postaci ograniczonej podstawowym leczeniem jest nefrektomia. Operacja ta może być wykonana w sposób oszczędny (usunięcie guza wraz z pewnym marginesem zdrowej nerki) lub radykalny (wycięcie całej nerki). Zabieg nefrektomii coraz częściej jest przeprowadzany laparoskopowo. Podstawą leczenia stadium zaawansowanego są inhibitory angiogenezy i kinazy mTOR. Immunoterapia opiera się na interferonie alfa, którego zastosowanie ograniczono do pacjentów spełniających kryteria określone przez MSKCC. Radioterapia ma niewielkie zastosowanie, ograniczone do leczenia uzupełniającego u niektórych pacjentów po operacji oraz terapii paliatywnej. Chemioterapia jest na ogół nieskuteczna.
Historia
Pierwszego opisu zmiany mogącej odpowiadać rakowi nerki dokonał Daniel Sennert w 1613 roku. W 1810 roku Miril opisał przypadek 35-letniej kobiety w ciąży cierpiącej na tę chorobę. Pierwszy dokładny opis guza i wstępną klasyfikację guzów nerki ogłosił Koenig w 1826 roku. Charles Phillippe Robin w 1855 roku stwierdził, że rak nerki powstaje z nabłonka kanalików nerkowych, co również stwierdził Waldyer 1867. W 1886 Paul Grawitz zauważył, że zawartość elementów tłuszczowych w komórkach nowotworowych jest podobna do komórek kory nadnerczy, i stwierdził, że guz powstał z pozostałości nadnerczy. Zmiana odkryta przez Grawitza została określona przez Feliksa Victora Bircha-Hirschfelda mianem hipernephroma. Od tamtej pory ten niepoprawny termin często był używany do określania wszystkich guzów nerek, a kontrowersje co do prawdziwości teorii Grawitza trwały dekady. Teoria ta została ostatecznie obalona w 1960 roku przy pomocy mikroskopu elektronowego.
Przełomem w leczeniu choroby było odkrycie, że człowiek może żyć z jedną nerką, oraz pierwsze operacje usunięcia całej nerki (nefrektomia) wykonane niezależnie w 1861 przez Eractusa B. Wallcotta i w 1869 roku przez Gustava Simona. Otwarło to drogę do wdrażania terapii chirurgicznej. W 1875 roku Bernhard von Langenbeck wykonał nefrektomię w celu wyleczenia przypadku raka nerki. Vincenz Czerny w 1887 roku wykonał częściowe wycięcie nerki.
W 1943 roku ustalono pierwszą klasyfikację TNM, jednak dla raka nerki ustalono kryteria TNM dopiero w 1978. Do tego czasu posługiwano się różnymi klasyfikacjami zaawansowania klinicznego (tzw. staging). W 1958 roku Flocks i Kadesky stworzyli klasyfikację opartą na cechach anatomopatologicznych i wzorcu rozsiewu. W 1978 roku Międzynarodowa Unia Walki z Rakiem (UICC) sformułowała pierwszą klasyfikację zaawansowania opartą na systemie TNM, którą następnie wielokrotnie modyfikowano (ostatnia modyfikacja w 2010 roku).
Etiologia
Etiologia raka nerki nie jest znana, a w jego rozwoju postuluje się następujące czynniki:
- predyspozycja genetyczna (np. zespół von Hippla i Lindaua),
- palenie papierosów,
- nadciśnienie tętnicze,
- otyłość współistniejąca z nadciśnieniem tętniczym (szczególnie u kobiet),
- zawodowe narażenie na wielopierścieniowe węglowodory aromatyczne, kadm, azbest,
- nabyta torbielowatość nerek wymagająca dializy.
Otyłość i palenie papierosów jest stwierdzane w 20–30% przypadków raka nerki. Występowanie raka nerki w rodzinie zwiększa od dwóch do trzech razy ryzyko zachorowania. Dziedziczne postacie zachorowania stanowią 2% przypadków raka.
Zwiększone ryzyko występowania raka nerki obserwuje się w zespole von Hippla-Lindaua, zespole Birt-Hogg-Dube, dziedzicznej mięśniakowatości gładkokomórkowej, zespole nadczynności przytarczyc i guza szczęki lub żuchwy, dziedzicznym raku brodawkowatym nerki, rodzinnym raku brodawkowatym tarczycy.
Nie ma przekonujących dowodów na związek paracetamolu i innych leków przeciwbólowych z rakiem nerki. Istnieją doniesienia o wzroście ryzyka zachorowania u kobiet po histerektomii.
Epidemiologia
Rak nerkowokomórkowy stanowi około 2–3% nowotworów złośliwych. Szczyt zachorowań przypada między 60 a 70 rokiem życia. Mężczyźni chorują częściej od kobiet (1,5:1). Pokrewieństwo pierwszego stopnia wiąże się ze zwiększonym ryzykiem zachorowania.
Na świecie co roku rozpoznaje się około 270 tys. nowych przypadków choroby, jednocześnie co roku 116 000 osób umiera z tego powodu. Częstość występowania na świecie jest zróżnicowana pod względem geograficznym. Najwyższe wskaźniki zachorowań obserwuje się w Europie (poza Portugalią, Hiszpanią), Ameryce Północnej i Australii, a najniższe w Indiach, Chinach, Japonii i Afryce. Częstość występowania raka nerki jest niższa wśród Azjatów. Sugeruje to wyższe ryzyko zachorowania dla rasy białej w porównaniu z rasą żółtą. Najniższą częstość występowania zaobserwowano w Afryce, jednak częstość występowania tej choroby wśród Afroamerykanów należy do najwyższych. Tę rozbieżność tłumaczy się różnicami w dostępie do diagnostyki obrazowej, dostępem do służby zdrowia, podłożem genetycznym oraz środowiskowymi czynnikami ryzyka.
W Europie wskaźnik zapadalności u mężczyzn wynosi 14,5/100 000, a u kobiet 6,9/100 000. W Polsce pod względem zachorowalności rak nerki jest na szóstym miejscu u mężczyzn i dziewiątym u kobiet, a pod względem umieralności zajmuje szóste miejsce u mężczyzn, u kobiet plasuje się w drugiej dziesiątce. Szacuje się, że w 2013 roku na raka nerki zachorowało około 2800 mężczyzn i 1900 kobiet; z tego powodu zmarło około 1500 mężczyzn i 1000 kobiet. Śmiertelność choroby systematycznie spada, tendencja jest wiązana ze wczesnym wykrywaniem niemych klinicznie postaci choroby.
Patomorfologia
Według klasyfikacji WHO (2004 r.) wyróżnia się następujące postacie raka nerkowokomórkowego:
- rak jasnokomórkowy (łac. carcinoma clarocellulare),
- rak brodawkowaty (łac. carcinoma papillare),
- rak chromofobowy (chromofobny) (łac. carcinoma chromophobicum),
- rak z cewek (kanalików) zbiorczych (ang. collecting duct carcinoma),
- rak sarkomatoidalny nerki (łac. carcinoma sarcomatoides),
- niesklasyfikowany rak nerkowokomórkowy,
- pozostałe postacie.
Rak jasnokomórkowy
Jest to najczęstszy typ raka nerki i stanowi około 70–80% przypadków. Występuje w korze nerki, najczęściej w pojedynczych ogniskach. Występowanie obustronne lub wieloogniskowe stanowi poniżej 5% przypadków i zwykle wiąże się z predyspozycją dziedziczną (np. zespołem von Hippla-Lindaua). Makroskopowo guz wielobarwny, żółty do pomarańczowego, często są obecne ogniska martwicy, zmiany krwotoczne, zwapnienia i torbiele. Zazwyczaj granice guza są wyraźne. Rozmiar zmiany nie jest wyznacznikiem złośliwości, jednak większy rozmiar guza wiąże się z większym ryzykiem obecności przerzutów. Powiększając się, zajmuje układ kielichowo-miedniczkowy i może wnikać do moczowodu. Stosunkowo często wrasta w żyłę nerkową, sięgając żyły głównej dolnej, a sporadycznie nawet do prawego przedsionka. Przerzuty daje głównie drogą krwionośną poprzez żyłę główną dolną do płuc. Możliwe jest również szerzenie się przerzutów poprzez żyły przykręgosłupowe, żyły jądrowe/jajnikowe, poprzez moczowód i drogą naczyń limfatycznych. Zdarzają się późne przerzuty rozpoznawane nawet po dziesięciu latach choroby. Mikroskopowo nowotwór składa się z komórek o jasnej lub ziarnistej kwasochłonnej cytoplazmie. Jasny wygląd cytoplazmy wynika z nagromadzenia się w niej lipidów i glikogenu, które zostają usunięte na skutek rozpuszczenia w alkoholu podczas rutynowego odwadniania preparatu. Jądra są ułożone centralnie; cechują się zróżnicowanym wyglądem i mogą być od małych, drobnych, bez jąderek do dużych, nadbarwliwych i nieregularnych. Podścielisko jest skąpe z siatką cienkościennych naczyń włosowatych, charakterystyczną dla tego typu nowotworu. Komórki tworzą poronne cewki, sznury, wyścielają torbiele lub są chaotycznie ułożone.
Rak brodawkowaty
Jest to drugi co do częstości guz nerki, stanowi około 10–15% przypadków choroby. Makroskopowo zwykle to pojedynczy guz z gruboziarnistą i kruchą powierzchnią utworzoną przez brodawki. Często występują torbiele, ogniska martwicy oraz zmiany krwotoczne. Możliwe jest występowanie wieloogniskowe i obustronne guza, które spotyka się częściej niż w raku jasnokomórkowym i innych typach raka nerki. Nowotwór jest zbudowany z drobnych sześciennych komórek ze skąpą cytoplazmą tworzących struktury brodawkowate z centralnie położonym naczyniem i luźną tkanką łączną. W podścielisku występują nacieki z makrofagów i neutrofilów.
Rak chromofobowy
Stanowi około 5% raków nerki, rokuje lepiej w porównaniu z rakami jasnokomórkowym i brodawkowatym. Po raz pierwszy opisano go w 1985 roku. Występuje w podobnym odsetku u kobiet i u mężczyzn. Makroskopowo jest to pojedynczy, dobrze odgraniczony guz o szarym lub brązowym zabarwieniu. Cechuje się litą strukturą i poza nielicznymi przypadkami nie występują ogniska martwicy ani wylewy krwawe. Mikroskopowo wyróżnia się postać typową i eozynochłonną. Postać typową guza budują duże, wieloboczne komórki o dużej różnorodności kształtu i wielkości. Cytoplazma jest drobnopęcherzykowa lub drobnoziarnista, błona komórkowa ze względu na zagęszczenie cytoplazmy na obwodzie wydaje się pogrubiała. Komórki tworzą lite pola z cienkościennymi naczyniami. Postać eozynochłonną tworzą komórki o obfitej i intensywnie różowej cytoplazmie po wybarwieniu. Komórki są mniejsze niż w postaci typowej. Rak chromofobowy mikroskopowo i makroskopowo może przypominać onkocytomę (łagodny guz nerki, o bardzo dobrym rokowaniu, zbudowany z onkocytów).
Rak z cewek zbiorczych
Stanowi około 1–2% raków nerki. Komórki nowotworowe różnicują w kierunku komórek cewek (kanalików) zbiorczych. Makroskopowo jest to szarobiały guz z nieregularnymi granicami zlokalizowany w rdzeniu nerki zniekształcający kielichy i miedniczkę nerkową, typowo bez zmian krwotocznych i martwicy. Mikroskopowo jest zbudowany ze struktur cewkowo-brodawkowatych we włóknistym podścielisku. Rokowanie jest gorsze niż w raku jasnokomórkowym.
Rak sarkomatoidalny (mięsakopodobny)
Stanowi około 1% raków nerki. Jest to agresywny, niskozróżnicowany i anaplastyczny nowotwór. Często dotyka młodych ludzi, średnia wieku zachorowania wynosi około 22 lat. Makroskopowo jest to duży, słabo odgraniczony guz, zwykle z ogniskami krwotocznymi i martwicy, któremu towarzyszy obecność przerzutów. Mikroskopowo zbudowany z wielokształtnych, wrzecionowatych komórek, które zawierają cytokeratyny i desmosomy typowe dla różnicowania nabłonkowego, co jest istotne w różnicowaniu z mięsakiem.
Objawy kliniczne
Rak nerki we wczesnych stadiach nie powoduje objawów. Obecnie ponad 50% przypadków choroby udaje się wykryć przypadkowo, podczas badań obrazowych wykonanych z powodu niespecyficznych objawów towarzyszących chorobie. Rakowi nerki często towarzyszą zespoły paranowotworowe (u około 30–40% chorych), mogą one być pierwszym objawem choroby lub świadczyć o wznowie guza. Występowanie zespołów paranowotworowych nie wiąże się z obecnością przerzutów i gorszym rokowaniem.
- we wczesnych stadiach przebiega bezobjawowo
- krwiomocz bez towarzyszącego bólu, zwykle okresowy (u 40–60% chorych pierwszy objaw choroby), mogą występować cylindryczne skrzepy będące „odlewami” moczowodu
- ból zlokalizowany w okolicy lędźwiowej lub podbrzuszu
- zgrubienie wyczuwalne przez powłoki brzuszne (u 40% chorych w momencie rozpoznania)
- objawy ogólne pod postacią osłabienia, spadku masy ciała, gorączki lub stanu podgorączkowego, wyniszczenia (kacheksja), niedokrwistości
- żylaki powrózka nasiennego, zwłaszcza po lewej stronie
- obrzęki kończyn dolnych
-
zespoły paranowotworowe:
- hiperkalcemia – występuje u 20% chorych, najczęstszy zespół paranowotworowy, związany z wydzielaniem peptydu PTH-podobnego (PTHrP)
- spadek masy ciała, gorączka lub stany podgorączkowe – gorączka występuje u 20–30% pacjentów, u niewielkiego odsetka może być jedynym objawem choroby (2%)
- niedokrwistość
- poliglobulia – rozwija się w wyniku nadmiernego wydzielania erytropoetyny przez komórki nowotworu w sposób niezależny od występowania miejscowej hipoksji. Występuje u 1–8% chorych, rak nerki jest najczęstszą przyczyną ektopowego wydzielania erytropoetyny
- nadciśnienie tętnicze – występuje u 20–40% chorych, rozwija się wskutek wydzielania reniny przez komórki guza, ucisku miąższu nerek lub moczowodów, obecności przetoki tętniczo-żylnej, policytemii
- przyspieszony OB
- zaburzenie czynności wątroby (zespół Stauffera) – przyczyna zaburzeń jest nieznana, charakteryzuje się podwyższeniem stężenia aminotransferazy alaninowej, aminotransferazy asparaginianowej, fosfatazy alkalicznej, wydłużeniem czasu protrombinowego
- zaburzenia endokrynologiczne:
- podwyższony poziom hCG – klinicznie objawia się jako mlekotok
- podwyższony poziom ACTH – klinicznie objawia się jako zespół Cushinga
- skrobiawica – obecna u 3–8% chorych
- neuropatia – rzadka, opisywana w przypadku przerzutów
-
objawy związane z obecnością przerzutów:
- powiększenie szyjnych lub nadobojczykowych węzłów chłonnych wskutek przerzutów
- kości: ból, złamania patologiczne
- hiperkalcemia – związana z przerzutami lub wydzielaniem białka PTH-podobnego
- płuca: kaszel, krwioplucie, duszność
- wątroba: ból pod prawym łukiem żebrowym
W 5–10% przypadków stwierdza się klasyczne objawy, zwane niekiedy triadą Virchowa:
- zgrubienie wyczuwalne w okolicy lędźwiowej,
- ból zlokalizowany w okolicy lędźwiowej,
- krwiomocz.
W badaniach dodatkowych stwierdza się następujące odchylenia:
- niedokrwistość – ale może też wystąpić czerwienica spowodowana nadprodukcją przez guz erytropoetyny,
- hiperkalcemia,
- zwiększenie stężeń AlAT, AspAT, fosfatazy alkalicznej, mimo braku przerzutów do wątroby (zespół Stauffera), oraz kreatyniny i mocznika.
Diagnostyka
Biopsja gruboigłowa
Biopsja jest coraz częściej stosowana w diagnostyce. Celem biopsji jest uzyskanie próbki do badania histopatologicznego, które umożliwia postawienie ostatecznego rozpoznania nowotworu, ocenę typu histologicznego guza oraz stopnia złośliwości. Biopsja gruboigłowa odznacza się dużą czułością i swoistością w wykrywaniu guza. Jednak w 10–20% przypadków uzyskuje się niejednoznaczny wynik. Nie obserwuje się rozsiewu guza po wykonaniu biopsji. Wobec dużej wartości predykcyjnej badań obrazowych ujemny wynik biopsji nie zmienia planu leczenia.
Biopsja cienkoigłowa
Biopsja cienkoigłowa nie jest metodą zalecaną do rozpoznania, ponieważ cechuje się niską czułością.
Badania obrazowe
40–60% guzów nerek jest rozpoznawanych przypadkowo podczas badania wykonanego z innego powodu niż podejrzenie raka nerki. Większość guzów nerek może być rozpoznana za pomocą badań obrazowych. Najważniejszym kryterium diagnostycznym jest obecność wzmocnienia sygnału. W diagnostyce największe znaczenie mają: tomografia komputerowa, rezonans magnetyczny oraz USG z kontrastem.
Tomografia komputerowa
Tomografia komputerowa jest podstawową metodą oceny stopnia zaawansowania guza nerki. W TK wzmocnienie kontrastowe jest oceniane za pomocą porównania obrazu zmiany przed i po podaniu kontrastu. Wzmocnienie sygnału >20 j.H. (jednostek Hounsfielda) wskazuje na wzmocnienie kontrastowe, które przemawia za obrazem guza nerki.
Tomografia pozwala ocenić:
- wielkość guza i jego ewentualne naciekanie sąsiadujących tkanek,
- naciekanie lub przerzuty do nadnerczy,
- rozpoznanie obecności czopu nowotworowego w żyle nerkowej,
- rozpoznanie zajęcia okolicznych węzłów chłonnych,
- rozpoznanie obecności przerzutów.
Niektóre badania wskazują na niewielkie przeszacowanie wielkości mniejszych guzów i niedoszacowanie wielkości dużych guzów.
Rezonans magnetyczny
Rezonans magnetyczny jest przydatny w sytuacji, gdy tomografia komputerowa nie daje rozstrzygającego wyniku, gdy występują przeciwwskazania do stosowania jodowych środków cieniujących lub w przypadku ciąży. Rezonans jest szczególnie przydatny w ocenie wykrywania przerzutów do nadnercza i diagnostyki czopa nowotworowego w żyle nerkowej. Pozwala na dokładną ocenę zaawansowania miejscowego oraz różnicowania zmian zapalnych w węzłach od zmian rozrostowych. Dokładność badania jest opisywana na około 90%.
Ultrasonografia
Pozwala na wstępne rozpoznanie. Badanie USG z kontrastem może być przydatne w szczególnych przypadkach, gdy występują przeciwwskazania do zastosowania środków kontrastowych opartych na jodzie i gadolinie (np. w przewlekłej niewydolności nerek). Ultrasonografia z kontrastem może być przydatna w diagnostyce różnicowej pomiędzy zmianami łagodnymi i złośliwymi.
Angiografia nerkowa
Angiografia uwidacznia unaczynienie guza, co może być przydatne przy planowaniu resekcji guza lub embolizacji tętnicy nerkowej.
Inne badania obrazowe
- scyntygrafia – wykonywana w przypadku podejrzeń przerzutów do kości, jednak nie powinna być zalecana rutynowo
- pozytonowa tomografia emisyjna – wartość tej metody nie została ustalona i obecnie nie jest to standard diagnostyczny. Może być ona przydatna do wykrywania przerzutów raka nerki, jej przydatność w wykrywaniu guzów pierwotnych jest ograniczona.
Badanie histopatologiczne
Rozpoznanie histopatologiczne jest stawiane na podstawie oceny próbek uzyskanych drogą biopsji lub preparatu po nefrektomii. Badanie umożliwia ustalenie ostatecznego rozpoznania nowotworu, ocenę stopnia złośliwości według czterostopniowej skali Fuhrman, która jest niezależnym ważnym czynnikiem rokowniczym. Poszczególne typy nowotworów rozróżnia się na podstawie typowych cech histologicznych i genetycznych.
| Typ histologiczny | Odsetek zachorowań | Zmiany cytogenetyczne |
| jasnokomórkowy | 80–90% | delecja chromosomu 3p (60%) i mutacja genu VHL; inne zmiany: duplikacja 5q22 (33%), trisomia 7, delecja 6q (17%), 8p (20%), 9p (16%), 14q (22%), utrata chromosomu Y (55% u mężczyzn) |
| brodawkowaty | 10–15% | trisomie chromosomów 3q, 7, 8, 12, 16, 17, delecja Y |
| chromofobny | 5% | delecja chromosomów 1, 2, 6, 10, 13 i 17 |
Leczenie
Podstawową metodą leczenia raka nerki w postaci ograniczonej jest postępowanie chirurgiczne, które polega na usunięciu guza wraz z częścią (operacja oszczędzająca) lub całą nerką (operacja radykalna). Coraz częściej zabiegi są wykonywane metodą laparoskopową, nawet w guzach o wyższych stopniach zaawansowania. W stadium zaawansowanym terapia ogólnoustrojowa opiera się na lekach celowanych, czyli lekach wybiórczo blokujących wzrost guza, jednocześnie nie zakłócając wzrostu innych szybko dzielących się komórek. Takimi lekami celowanymi w leczeniu raka nerki są inhibitory kinazy tyrozynowej blokujące angiogenezę oraz inhibitory kinazy mTOR.
Stosuje się również immunoterapię za pomocą INF-α. Radioterapia może być użyta u niektórych pacjentów po wykonanym zabiegu chirurgicznym. W zaawansowanej chorobie nowotworowej radioterapia może łagodzić dolegliwości związane z obecnością przerzutów. Szczepionki przeciwnowotworowe są na etapie eksperymentalnym i nie są stosowane poza badaniami naukowymi. Chemioterapia ma niewielkie znaczenie w terapii raka nerki, ze względu na dużą oporność nowotworu na wiele leków.
Leczenie chirurgiczne w chorobie ograniczonej
Leczenie nerkooszczędzające
Operacja oszczędzająca w raku nerki ograniczonym do narządu wiąże się z rokowaniem onkologicznym podobnym do operacji radykalnej. W sytuacji niekorzystnej lokalizacji guza lub jego dużego zaawansowania leczeniem z wyboru jest radykalna nefrektomia. Dla guzów w zaawansowaniu T1 zaleca się leczenie oszczędzające zawsze, gdy jest to możliwe.
Wskazania do operacji oszczędzającej:
- bezwzględne:
- jedyna nerka w sensie anatomicznym lub czynnościowym,
- względne:
- druga nerka jest zajęta przez proces chorobowy, który w przyszłości upośledzi jej funkcję,
- elektywne (uznaniowe) – w guzie nerki ograniczonym do narządu, gdy druga nerka nie jest objęta procesem chorobowym.
Operacja nerkooszczędzająca w przypadku guzów T1a zapewnia odsetek przeżyć długoterminowych i wolnych od choroby porównywalny z operacją radykalną. W guzach T1b ma podobną skuteczność u wybranych pacjentów. Prawdopodobnie zwiększa przeżywalność, dzięki zachowanej lepszej funkcji nerek. Odsetek powikłań w leczeniu oszczędzającym jest wyższy niż w radykalnej nefrektomii.
Nefrektomia radykalna
Nefrektomia radykalna jest operacją obejmującą wycięcie nerki wraz z powięzią Geroty, nadnerczem, okolicznymi węzłami chłonnymi oraz górną częścią moczowodu. Umożliwia całkowite wyleczenie, gdy guz zostanie usunięty w całości. Nefrektomia radykalna metodą laparoskopową jest standardowym postępowaniem w leczeniu guzów w zaawansowaniu T2 oraz guzów w mniejszym zaawansowaniu niekwalifikujących się do nefrektomii częściowej. Nefrektomia radykalna metodą laparoskopową daje podobne wyniki przeżycia wolnego od nowotworu jak nefrektomia metodą otwartą. Rozszerzona limfadenektomia (usunięcie węzłów chłonnych) prawdopodobnie nie poprawia długotrwałego przeżycia po nefrektomii, dlatego limfadenektomia może zostać ograniczona tylko do węzłów wnęki w celu dokonania oceny zaawansowania (tzw. staging). Powiększone węzły chłonne wykryte śródoperacyjnie lub w tomografii komputerowej również należy pobrać w celu oceny zaawansowania.
Embolizacja
Embolizacja jest to metoda leczenia polegająca na podaniu materiału zatorowego do dużego naczynia zaopatrującego guz w celu spowodowania zatoru tego naczynia i doprowadzenia do martwicy tkanek w obszarze unaczynienia tej tętnicy. Nie ma korzyści wynikających z embolizacji guza wykonanej przed nefrektomią. U pacjentów, u których niemożliwe jest wykonanie operacji radykalnej z powodu zaawansowania guza lub ogólnych przeciwwskazań do zabiegu, embolizacja zmniejsza krwiomocz oraz ból. Embolizacja bogato unaczynionych przerzutów pozwala zmniejszyć krwawienie podczas ich usuwania.
Leczenie chirurgiczne w stanie uogólnionym
Nefrektomia paliatywna
Usunięcie nerki pozwala na wyleczenie jedynie wtedy, gdy guz zostanie usunięty w całości. W przypadku choroby uogólnionej nefrektomia jest leczeniem paliatywnym i jest konieczne stosowanie innych metod leczenia ogólnoustrojowego. Nefrektomia paliatywna jest zalecana u pacjentów w dobrym stanie ogólnym kwalifikujących się do zabiegu. W badaniach randomizowanych wykazano dłuższe przeżycia pacjentów poddanych paliatywnej nefrektomii w porównaniu do samej immunoterapii. Obecnie nie ma pełnych danych dotyczących korzyści wykonania nefrektomii cytoredukcyjnej z jednoczesnym leczeniem celowanym, wiadomo, że immunoterapia po leczeniu cytoredukcyjnym nie zwiększa przeżycia.
Metastazektomia
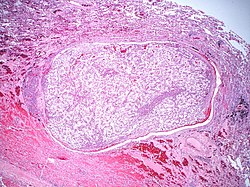
Całkowite usunięcie przerzutów (metastazektomia) poprawia rokowanie. Z tego powodu zawsze należy rozważyć zabieg usunięcia przerzutów. Jednak tylko całkowite usunięcie przerzutów pozwala na wyleczenie. Metastazektomię należy wykonać u pacjentów z przerzutem synchronicznym (przerzut jest rozpoznawany jednocześnie z chorobą), jeśli jest on technicznie możliwy do usunięcia, a pacjent jest w dobrym stanie ogólnym. W przypadku stwierdzenia przerzutów metachronicznych (rozpoznane w pewnym odstępie od rozpoznania choroby) rokowanie jest gorsze. Wówczas metastazektomia powinna być wykonana w dwóch sytuacjach: u pacjentów ze zmianami możliwymi do usunięcia, które wcześniej odpowiedziały na immunoterapię, lub w przypadku pojedynczych przerzutów metachronicznych u pacjentów w dobrym stanie ogólnym.
Leczenie adiuwantowe
Obecnie nie ma wskazań do leczenia adiuwantowego. Trwają badania nad szczepionką przeciwnowotworową stosowaną u wybranych pacjentów z guzem w stopniu zaanwansowania T3 w ramach leczenia adiuwantowego. Dane sugerują zwiększenie okresu przeżycia wolnego od choroby (PFS), jednak szczepionki wymagają badań nad wpływem na zwiększenie całkowitego przeżycia chorych (OS). Obecnie nie ma dowodów na zasadność leczenia adiuwantowego inhibitorami VEGF i mTOR.
Radioterapia
Radioterapia jest to metoda leczenia, która wykorzystuje promieniowanie o wysokiej energii do zabijania lub zatrzymania wzrostu komórek nowotworowych. Rak nerki jest zaliczany do nowotworów umiarkowanie promieniowrażliwych. Terapia znalazła zastosowanie głównie w leczeniu uzupełniającym zabieg operacyjny u pacjentów z guzem przechodzącym poza torebkę nerki (stadium T3), w kontrolowaniu objawów zaawansowanego miejscowo guza oraz leczeniu paliatywnym przerzutów.
Radioterapia przedoperacyjna
Celem stosowania radioterapii przedoperacyjnej jest zmniejszenie masy guza i umożliwienie radykalnego zabiegu usunięcia nerki. Badania wykazały zmniejszenie masy guza w wyniku napromieniowania przedoperacyjnego, jednak nie potwierdziły poprawy wyników leczenia raka nerki. Radioterapia przedoperacyjna nie jest postępowaniem rutynowym, ale może być stosowana w przypadku guzów nieoperacyjnych.
Radioterapia pooperacyjna
Celem radioterapii pooperacyjnej jest zmniejszenie ryzyka uogólnienia się choroby miejscowej po przeprowadzonym nieradykalnym zabiegu chirurgicznym. Jednak uzupełniające napromienianie po zabiegu niedoszczętnym onkologicznie nie jest postępowaniem rutynowym. Nie udowodniono, że taka terapia zwiększa przeżycie w porównaniu z samodzielną nefrektomią. W niektórych badaniach wykazano, że takie postępowanie wydłuża okres wolny od choroby, ale bez zwiększenia przeżywalności. Potencjalnymi wskazaniami do radioterapii pooperacyjnej mogą być:
- nieradykalność zabiegu chirurgicznego makroskopowa i mikroskopowa
- uszkodzenie guza podczas operacji
- przechodzenie nacieku poza torebkę nerki
- przerzuty do okolicznych węzłów chłonnych.
Konieczne jest dobre zaplanowanie radioterapii z ochroną wątroby oraz rdzenia kręgowego. Nie wolno przekraczać maksymalnych dawek tolerowanych: dla wątroby 40 Gy, dla rdzenia kręgowego 45 Gy i dla przeciwnej nerki 20 Gy. Wczesne odczyny popromienne dotyczą 70% poddanych terapii i są to głównie nudności i ból brzucha. Późne odczyny występują u 20% poddanych leczeniu, najczęściej są to bóle brzucha, biegunki i zaparcia.
Radioterapia paliatywna
Celem radioterapii paliatywnej jest złagodzenie dolegliwości związanych z zaawansowaną chorobą nowotworową. Rak nerki wykazuje duży potencjał do tworzenia przerzutów, które lokalizują się głównie w płucach, kośćcu i mózgu. Radioterapię można wykorzystać do leczenia dolegliwości bólowych związanych z nieresekcyjnymi przerzutami w mózgu lub kościach, które nie odpowiadają na ukierunkowane leczenie ogólnoustrojowe.
Kości są drugim najczęstszym miejscem tworzenia przerzutów. W zaawansowanej chorobie nowotworowej przerzuty do kości stwierdza się nawet u 30% pacjentów. Najczęściej umiejscawiają się w miednicy, częściach kostnych żeber i kręgach. Mogą być przyczyną bólu, złamań patologicznych, hiperkalcemii oraz ucisku rdzenia kręgowego. Radioterapia może spowodować znaczne złagodzenie objawów przerzutów do kości i poprawić komfort życia chorych.
Inhibitory angiogenezy
Ważną rolę w patogenezie raka nerki pełni gen supresorowy VHL i kodowane przez niego białko VHL (Von Hippel-Lindau), które ulega inaktywacji w 80% przypadków postaci sporadycznej oraz w postaci wrodzonej (zespół von Hippla-Lindaua). Jedną z funkcji białka VHL jest regulacja odpowiedzi komórek na białko HIF-1a (czynnik indukowany hipoksją) wydzielanego w reakcji na niedotlenienie, które w warunkach prawidłowych ulega degradacji. Białka HIF są głównymi czynnikami transkrypcyjnymi w komórce w warunkach hipoksji. Przyczyniają się między innymi do transkrypcji genów kodujących czynniki wzrostu – VEGF, PDGF czy TGFα. W wyniku mutacji genu VHL dochodzi do akumulacji czynnika HIF i wydzielania czynników proangiogennych. Ligandy rodziny VEGF poprzez aktywację receptora czynnika wzrostu śródbłonka naczyniowego (VEGFR) promują wzrost i proliferację komórek śródbłonka oraz zwiększenie przepuszczalności naczyń. Receptor odgrywa centralną rolę w angiogenezie nowotworowej.
Hamowanie VEGF jest ważną strategią terapeutyczną w leczeniu zaawansowanego raka nerki. Inhibitory kinaz tyrozynowych blokują działanie VEGFR poprzez zablokowanie wewnątrzkomórkowego przekazania sygnału, w którym biorą udział kinazy tyrozynowe. W efekcie zablokowania kinaz mimo związania VEGF z VEGFR nie dochodzi do zmian regulowanych przez to białko. Odmiennie działa bewacyzumab, który bezpośrednio wiąże izoformy VEGF-A, jednak musi być stosowany w połączeniu z IFN-α.
Inhibitory angiogenezy są skuteczniejszą metodą terapeutyczną niż INF-α. Inhibitory kinazy tyrozynowej (TKI) zwiększają czas przeżycia wolny od progresji choroby (PFS) lub całkowity czas przeżycia (OS) jako leki pierwszego i drugiego rzutu. Obecnie w leczeniu stosowane są inhibitory kinaz tyrozynowych blokujące działanie VEGF – sunitynib, sorafenib, pazopanib, aksytynib – oraz humanizowane przeciwciało monoklonalne bewacyzumab (stosowane łącznie z IFN-α). Próby zwiększenia skuteczności tych środków poprzez łączenie ich ze sobą, kojarzenie z chemioterapią lub immunoterapią nie dawały lepszych rezultatów w porównaniu z monoterapią. Również połączenie inhibitorów kinazy tyrozynowej i inhibitora VEGF (bewacyzumab) nie daje większych korzyści. Stosowanie inhibitorów angiogenezy wiąże się z wysokim wskaźnikiem działań niepożądanych i częstą koniecznością modyfikacji leczenia (u około 50% chorych).
Terapia ogólnoustrojowa powinna opierać się na lekach celowanych. Sunitynib i pazopanib są zalecane jako leki pierwszego rzutu w zaawansowanym raku nerki, bewacyzumab z INF-α jest zalecany jako leczenie pierwszego rzutu u pacjentów z zaawansowanym rakiem nerki o niskim lub średnim ryzyku.
| Typ histologiczny | Grupa ryzyka | I rzut | II rzut | III rzut |
| jasnokomórkowy | niska średnia wysoka |
sunitynib pazopanib bewacyzumab + INF-α |
po inhibitorach VEGF: aksytynib sorafenib ewerolimus po cytokinach: sorafenib aksytynib pazopanib |
po inhibitorach VEGF: everolimus po inhibitorach mTOR: sorafenib |
| jasnokomórkowy | wysoka | temsirolimus | każdy lek celowany | – |
| niejaskomórkowy | każda grupa | sunitynib ewerolimus temsirolimus |
każdy lek celowany | – |
Sunitynib
Sunitynib jest inhibitorem angiogenezy, działa poprzez selektywne blokowanie receptora PDGF, receptora VEGF, białka C-KIT, FLT-3. Jest zalecany jako leczenie pierwszego rzutu w IV stadium zaawansowania. W badaniach klinicznych wykazano, że średni czas przeżycia wolny od progresji choroby u pacjentów leczonych sunitynibem wynosił 9,5 miesięcy, a średni czas przeżycia 26 miesięcy. Wskaźnik odpowiedzi obiektywnych wynosił do 33%.
Sunitynib jest skuteczniejszy niż INF-α u pacjentów wcześniej nieleczonych. W 2009 przeprowadzono badanie III fazy obejmujące 750 pacjentów z rakiem nerki z przerzutami, u których losowo zastosowano leczenie sunitynibem lub IFN-α. Całkowity czas przeżycia leczonych sunitynibem okazał się znacznie dłuższy i wynosił 26,4 miesiąca, podczas gdy u pacjentów leczonych INF wynosił on 21,4 miesięcy.
Sorafenib
Sorafenib jest doustnym inhibitorem angiogenezy, działa poprzez blokadę licznych kinaz – grupy białek biorących udział w regulacji licznych procesów biochemicznych. Lek jest aktywny wobec kinazy Raf, receptora PDGFβ (PDGFRβ), receptorów VEGF, kinazy tyrozynowej podobnej do białka FMS (kinazy Flt-3) oraz białka C-KIT, C-RAF, B-RAF i kinazy tyrozynowej RET. Randomizowane badanie kliniczne z podwójną ślepą próbą pacjentów z zaawansowanym rakiem nerkowokomórkowym wykazało, że średni czas przeżycia wolny od progresji choroby pacjentów leczonych sorafenibem wyniósł około 5,5 miesiąca w porównaniu z 2,8 miesiąca u pacjentów, którzy otrzymywali placebo. Lek prawdopodobnie zwiększa przeżycie w porównaniu do placebo.
Pazopanib
Pazopanib jest doustnym inhibitorem angiogenezy, blokuje receptory PDGFβ (PDGFRβ) oraz VEGF (VEGFR). Lek wykazuje większą selektywność w porównaniu do innych inhibitorów kinaz i wybitną zdolność do inhibicji VEGFR. W badaniu na małej grupie pacjentów lek powodował zwiększenie okresu przeżycia wolnego od choroby do 11,1 miesiąca, podczas gdy placebo wydłużało ten okres do 2,8 miesiąca. W innym badaniu po dłuższej obserwacji średni czas przeżycia bez postępu choroby wynosił 9,3 miesiąca. Odsetek obiektywnej odpowiedzi na lek wynosi od 35% do 20%.
Aksytynib
Aksytynib jest to selektywny inhibitor receptora VEGF, może być stosowany jako leczenie II rzutu pacjentów z rakiem nerki po nieskuteczności sorafenibu lub sunitynibu. Lek wywołuje obiektywną odpowiedź u 19% pacjentów, a okres przeżycia wolny od progresji choroby wynosi około 6,7 miesięcy. W leczeniu II rzutu nie wykazano różnicy pomiędzy aksytynibem a sorefenibem w przeżyciu chorych. Ten pierwszy wykazuje aktywność u pacjentów z rozsianym rakiem opornym na cytokiny.
Bewacyzumab
Bewacyzumab jest humanizowanym przeciwciałem monoklonalnym, które wiąże izoformy VEGF-A. Bewacyzumab w połączeniu z IFN-α może być użyty w leczeniu I rzutu po nieskuteczności inhibitorów kinazy tyrozynowej. Połączenie bewacyzumabu z IFN-α jest skuteczniejsze od monoterapii IFN-α i osiągało wyższy wskaźnik obiektywnych odpowiedzi (ok. 25–30%) w porównaniu z monoterapią IFN-α (około 13%). Bewacyzumab z IFN-α przedłuża przeżycie tylko w grupach o dobrym lub pośrednim ryzyku.
Inhibitory kinazy mTOR
Jest to grupa leków blokująca kinazę białkową treoninowo-serynową mTOR, która reguluje wzrost, proliferację i ruch komórki, a także procesy translacji i transkrypcji. W porównaniu do inhibitorów angiogenezy cechują się całkowicie odmiennym mechanizmem działania. Hamują one angiogenezę poprzez związanie się z receptorem FKBP12, tworząc kompleks, który hamuje aktywację kinazy mTOR 1 – kluczowego czynnika w regulacji wzrostu i proliferacji komórek. Kinaza mTOR kontroluje replikacje poprzez dwa szlaki: 4E-BP (białko wiążące czynnik inicjacji translacji 4E) oraz kinazę rybosomalną p70S6. W wyniku aktywacji białka 4EBP1 dochodzi do translacji mRNA kodującego c-Myc, cyklinę D1 i czynnika indukowanego hipoksją (HIF), co prowadzi do regulacji w górę wielu czynników wzrostu, w tym VEGF, PDGF i TGF. Dochodzi do zatrzymywania cyklu komórkowego w fazie G1, a także hamuje angiogenezę nowotworów przez zmniejszenie syntezy VEGF. Kinaza mTOR w komórkach nowotworowych jest aktywowana w wyniku różnych mechanizmów, w wyniku aktywacji onkogenów i utraty genów supresorowych. mTOR jest szczególnie ważny w patogenezie raka nerki z uwagi na jego funkcje w regulacji stężenia HIF-1a, szczególnie, że w większości przypadków raka nerki występuje utrata genu supresorowego VHL i zmniejszenie degradacji HIF-1a, a w rezultacie do większej produkcji czynników angiogennych.
Jedynymi zarejestrowanymi inhibitorami mTOR w leczeniu mRCC są obecnie temsirolimus i ewerolimus. Leki można łączyć z interferonem, również z lekami cytostatycznymi.
Terapia ogólnoustrojowa powinna opierać się na lekach celowanych. Temsirolimus jest zalecany jako leczenie pierwszego rzutu u pacjentów z rakiem nerki o dużym ryzyku. Ewerolimus jest zalecany u pacjentów, u których inhibitory VEGF okazały się nieskuteczne.
Temsirolimus
Temsirolimus to specyficzny dożylny inhibitor mTOR. W badaniach klinicznych wykazano, że u pacjentów leczonych temsirolimusem całkowite przeżycie wynosiło 10,9 miesiąca, podczas gdy INF-α w monoterapii 7,3 miesiąca, a INF w połączeniu z temsirolimusem 8,4 miesiąca. Temsirolimus porównano również z sorafenibem – nie stwierdzono znaczących różnic między okresami przeżycia bez postępu choroby, ale wykazano istotną różnicę w całkowitym przeżyciu, które wynosiło dla temsirolimusu 16,6 miesiąca i dla sorafenibu 12,3. Temsirolimus nie jest zalecany w przypadku raka opornego na inhibitory kinazy tyrozynowej.
Ewerolimus
Ewerolimus to doustny inhibitor mTOR stosowany u pacjentów opornych na leczenie inhibitorami angiogenezy. Wykazano, że u pacjentów nieskutecznie leczonych inhibitorami VEGF w porównaniu do placebo wydłuża czas przeżycia wolny od progresji choroby o 2 miesiące, ale nie przedłużał przeżycia całkowitego. Jednak w porównaniu ewerolimusu z sunitynibem jako leczenie I rzutu sunitymib jest wyraźnie skuteczniejszy – okres przeżycia bez progresji choroby pacjentów leczonych ewerolimusem wynosił 7,9 miesiąca, a sunitynibem 10,7 miesiąca.
Immunoterapia
Interferon α
Interferon α jest to cytokina, która znalazła zastosowanie w leczeniu niektórych chorób wirusowych i niektórych nowotworów, w tym raka nerki. Stosowany jest w leczeniu choroby w stadium zaawansowanym. Na terapię interferonem odpowiada od 6 do 15% pacjentów z zaawansowanym rakiem nerki. Jednak mimo obiektywnej odpowiedzi na leczenie nie wydłuża ono znacząco przeżycia (o około 3-5 miesięcy). Jednak w badaniach u pacjentów o pośrednim ryzyku nie udało się potwierdzić tej korzyści. Wykazano, że terapia interferonem lub interleukiną 2 jest związana z przeżyciem podobnym do terapii hormonalnej za pomocą medroksyprogesteronu (leczenie objawowe kacheksji). Pozytywny wpływ immunoterapii może wystąpić tylko w niektórych grupach pacjentów z guzem o typie raka jasnokomórkowego i spełniające kryteria MSKCC (Memorial Sloan-Kettering Cancer Center), znane również jako kryteria Motzera, oraz z przerzutami wyłącznie ograniczonymi do płuc.
| Czynnik ryzyka | Punkt odcięcia |
| skala Karnofsky’ego | <80 |
| czas od rozpoznania do podjęcia leczenia | <12 miesięcy |
| hemoglobina | poniżej normy |
| dehydrogenaza mleczanowa | >1,5 powyżej wartości referencyjnej |
| skorygowane stężenie wapnia | >10 mg/dl |
IFN-α w połączeniu z bewacyzumabem wiąże się z większą częstością odpowiedzi i zwiększeniem okresu przeżycia bez choroby (PFS) w porównaniu z IFN-α stosowanym w monoterapii.
Interferon α podawany w monoterapii jest równie skuteczny jak połączenie interferonu α, interleukiny 2 i fluorouracylu.
Interleukina 2
Interleukina 2 (IL-2) jest cytokiną stosowaną w immunoterapii raka nerki. Tylko rak jasnokomórkowy nerki odpowiada na to leczenie, odsetek odpowiedzi waha się od 7 do 27%. Optymalny schemat leczenia za pomocą IL-2 nie jest jeszcze ustalony, jednak wieloletnie odpowiedzi na lek osiągnięto przy dużych dawkach, choć w randomizowanych prospektywnych badaniach nie wykazano, by pojedynczy kurs IL-2 powodował istotne klinicznie korzyści. Interleukina 2 jest znacznie bardziej toksyczna od interferonu α.
Szczepionka przeciwnowotworowa
Rak nerki należy do najbardziej czułych immunologicznie nowotworów. Ta właściwość jest podstawą teoretyczną do prób stworzenia celowanych szczepionek przeciw określonym antygenom raka, które mogłyby pomóc w leczeniu adiuwantowym lub w terapii stadia zaawansowanego. Główną techniczną przeszkodą jest brak specyficznych antygenów nowotworowych, które mogłyby być celem tych preparatów. Szczepionki stanowią przedmiot intensywnych badań naukowych i klinicznych, jednak obecnie nie ma żadnego zarejestrowanego preparatu. Badane są trzy potencjalne typy szczepionek: preparat z autologicznych komórek nowotworowych, preparat z komórek dendrytycznych oraz preparaty skierowane przeciw antygenom związanym z komórkami nowotworowymi np. anhydraza węglanowa IX, surwiwina, telomeraza. Obecnie nie rekomenduje się szczepionek jako standardowej terapii.
Szczepionki oparte na autologicznych komórkach nowotworowych zasadniczo składają się z zabitych własnych komórek nowotworowych oraz preparatu, który dostarcza antygeny, które wyindukują i nasilą odpowiedź immunologiczną. Szczepionka jest oparta na założeniu, że nowotwór posiada antygeny, które mogą wywołać odpowiedź limfocytów Tc, dodatkowa obróbka jest konieczna do nasilenia odpowiedzi immunologicznej. W tym celu stosowane są substancje pomocnicze takie jak adiuwant Freunda, IL-2, IL-12, GM-CSF, szczepionka BCG. Toksyczność tych preparatów jest relatywnie łagodna. Niektóre badania sugerują skuteczność szczepionek w leczeniu adiuwantowym raka nerki. Nie wykazano istotnej skuteczności szczepionek w leczeniu rozsianego raka nerki.
Innym rodzajem szczepionek przeciwnowotworowych są szczepionki oparte na komórkach dendrytycznych. Komórki dendrytyczne należą do układu APC, odgrywają ważną rolę w prezentacji antygenu oraz w pobudzaniu limfocytów Th i Tc, inicjując tym samym odpowiedź przeciwnowotworową. Szczepionki wykorzystują komórki dendrytyczne pochodzące z lizatu komórek guza lub uzyskane drogą hodowli z jednoczesną obecnością antygenów związanych z guzem. Poszczególne metody mocno się różnią pod względem izolacji komórek z krwi obwodowej, różnicowania i dojrzewania tych komórek. W badaniach na małych grupach pacjentów wykazano skuteczność takiego postępowania; w metaanalizie 37% pacjentów osiągało poprawę kliniczną. Obecnie nie opublikowano badań przeprowadzonych na dużej grupie pacjentów, dlatego do tych wyników należy podchodzić z ostrożnością.
Trzecim rodzajem szczepionek są preparaty skierowane przeciw konkretnym antygenom raka (tzw. ang. peptide-based vaccines). Ich przewagą jest wywoływanie odpowiedzi immunologicznej przeciwko ograniczonej liczbie antygenów, co stanowi przeciwieństwo preparatów opartych na lizatach komórek guza. Lizaty zawierają liczne nieznane antygeny, w tym również, obok białek związanych z nowotworem, białka prawidłowe (niezwiązane z nowotworem), co może być przyczyną nieoczekiwanej odpowiedzi odpornościowej. Preparaty skierowane przeciw konkretnym antygenom powinny być łatwiejsze w produkcji, bezpieczniejsze i tańsze od innych rodzajów szczepionek przeciwnowotworowych. Natomiast wadą jest możliwość utraty przez klony nowotworowe docelowego antygenu, a tym samym uzyskanie oporności na ten typ szczepionki. Konieczne jest stosowanie szczepionek skierowanych przeciwko wielu typom antygenów, co może zmniejszyć ryzyko nabycia oporności. Pomimo swoich zalet wciąż nie ma wielu badań klinicznych z zastosowaniem tych preparatów. Eksperymentowano z wieloma potencjalnymi antygenami. Wiele badań poświęcono szczepionkom przeciw anhydrazie węglanowej IX, która ulega nadekspresji w 90% przypadków raka nerki. Badanie na małej grupie pacjentów wykazało jego potencjalną skuteczność. Innym kierunkiem badań jest wykorzystanie białek szoku cieplnego. Są to białka wydzielane przez komórki w odpowiedzi na czynniki uszkadzające. Białka szoku cieplnego biorą również udział w prezentacji antygenu, co czyni je potencjalnie przydatnymi adiuwantami stymulującymi odpowiedź na szczepionkę. Jednak w badaniach klinicznych nie wykazano wyższej skuteczności w porównaniu do placebo.
Chemioterapia
Jest to metoda leczenia wykorzystująca leki cytostatyczne do niszczenia komórek nowotworowych. Chemioterapia w raku nerki jest mało skuteczna i ma ograniczone zastosowanie do leczenia choroby w stadium rozsianym. Nowotwór wywodzi się z kanalików proksymalnych i wykazuje wysoki poziom ekspresji białek oporności wielolekowej (glikoproteina P). Przyczynia się to do oporności wobec wielu form chemioterapii. Niestety aż 25% pacjentów wykazuje chorobę oporną na leki już przy pierwszej ocenie leczenia, a większość uzyskuje oporność w dalszym etapie leczenia. Chemioterapia w monoterapii nie jest uważana za skuteczną.
W terapii obecnie stosuje się 5-fluorouracyl w połączeniu z interferonem α (INF-α); stosowany samodzielnie nie jest on uważany za skuteczny. W monoterapii największym odsetkiem odpowiedzi na leczenie wykazują się winblastyna (6,67%), fluorouracyl (6,57%) oraz floksurydyna (9,66%). W wyniku łączenia różnych cytostatyków (polichemioterapia) nie uzyskano lepszego działania przeciwnowotworowego przy jednoczesnym zwiększeniu toksyczności leczenia.
W leczeniu obok fluorouracylu bywają również stosowane kapecytabina, gemcytabina, floksurydyna, winblastyna.
Fluorouracyl jest cytostatykiem należącym do antymetabolitów pirymidynowych. W połączeniu z interferonem α (INF-α) wykazuje działanie synergistycznie. Terapia taka stanowi umiarkowanie skuteczny sposób leczenia raka nerki z przerzutami. Synergizm interferonu i fluorouracylu wymaga aktywności białka p53, dlatego obecność tego białka może być istotnym czynnikiem predykcyjnym tego typu leczenia. Łączenie fluorouracylu, interferonu α i interleukiny 2 (IL-2) nie poprawia przeżycia.
Kapecytabina jest doustnym lekiem aktywowanym do fluorouracylu. Może być stosowana w połączeniu z immunoterapią. Częściową odpowiedź obserwowano u około 8–10% pacjentów, a stabilizację choroby u około 60% pacjentów.
Gemcytabina wykazuje niewielką aktywność wobec raka nerki, wywołuje odpowiedź u około 6% pacjentów. Może być łączona z kapecytybiną jako leczenie II rzutu.
Fluoksurydyna jest cytostatykiem należącym do grupy antymetabolitów. Może być łączona z lekami biologicznymi. Możliwe jest również łączenie fluoksurydyny (FUDR) z fluorouracylem.
Winblastyna jest cytostatykiem hamującym podziały mitotyczne komórek. Bywa stosowana w połączeniu z interferonem α w celu zmniejszenia jego toksyczności oraz kosztów leczenia. Wykazano, że dla obu grup pacjentów przeżycie krótkoterminowe może być podobne przy lepszej tolerancji małej dawki interferonu z winblastyną. Wykazano również nieznacznie wyższą przeżywalność i mniej działań niepożądanych u pacjentów leczonych połączeniem interferonu α z winblastyną w porównaniu do połączenia interferonu α, interleukiny 2 i fluorouracylu.
Taksany (paklitaksel, docetaksel) nie wykazują znaczącej aktywności w raku nerki.
Ocena rokowania
Czynniki anatomiczne
Czynnikami rokowniczymi są: wielkość guza, inwazja torebki nerki, inwazja żyły nerkowej i głównej dolnej, zajęcie nadnercza, węzłów chłonnych i obecność przerzutów. Czynniki anatomiczne są zebrane w klasyfikację TNM. Używane są również inne systemy klasyfikacyjne, takie jak PADUA (preoperative aspects and dimensions used for an anatomical) classification, R.E.N.A.L. nephrometry score, C-index, które obejmują dodatkowe cechy guza. Anatomiczne systemy klasyfikacji są pomocne w ustaleniu metody leczenia, szczególnie chirurgicznego, i wyborze pomiędzy operacją nerkooszczędzającą a radykalną.
Klasyfikacja TNM
Obecnie obowiązuje klasyfikacja TNM według AJCC.
| T | Opis |
| Tx | Nie można ocenić guza pierwotnego. |
| T0 | Nie stwierdza się guza pierwotnego. |
| T1 | Guz o największym wymiarze ≤7 cm, ograniczony do nerki. |
| T1a | Guz o największym wymiarze ≤4 cm, ograniczony do nerki. |
| T1b | Guz o największym wymiarze >4 cm, ale ≤7 cm, ograniczony do nerki. |
| T2 | Guz o największym wymiarze >7 cm, ograniczony do nerki. |
| T2a | Guz o największym wymiarze >7 cm, ale ≤10 cm, ograniczony do nerki. |
| T2b | Guz o największym wymiarze >10 cm, ograniczony do nerki. |
| T3 | Guz z zajęciem dużych naczyń żylnych, z przerzutami do nadnercza lub naciekający tkanki okołonerkowe, z wyjątkiem naciekania nadnercza po stronie zajętej nerki, jednocześnie nie przekracza powięzi Geroty. |
| T3a | Nowotwór z makroskopowo stwierdzanym zajęciem światła żyły nerkowej lub jej dopływów segmentarnych (zawierających w ścianie mięśniówkę) lub naciekający tkankę tłuszczową okołonerkową albo wnęki, ale bez przekraczania powięzi Geroty. |
| T3b | Nowotwór z makroskopowo stwierdzanym zajęciem światła żyły głównej dolnej poniżej przepony. |
| T3c | Nowotwór z makroskopowo stwierdzanym zajęciem światła żyły głównej dolnej powyżej przepony lub naciekający ścianę żyły głównej dolnej. |
| T4 | Guz przekracza powięź Geroty (w tym naciekanie przez ciągłość nadnercza po stronie guza). |
| N | Opis |
| Nx | Nie można ocenić okolicznych węzłów chłonnych. |
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych. |
| N1 | Przerzut lub przerzuty w węźle chłonnym. |
| N2 | Przerzuty w więcej niż jednym węźle chłonnym. |
| M | Opis |
| Mx | Nie można określić obecności przerzutów odległych. |
| M0 | Nie stwierdza się przerzutów odległych. |
| M1 | Przerzuty odległe obecne. |
| stopień | T | N | M |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| T1, T2, T3 | N1 | M0 | |
| IV | T4 | N1, N2 | M0 |
| T1, T2, T3, T4 | N2 | M0 | |
| T1, T2, T3, T4 | N1, N2 | M1 |
Czynniki histologiczne
Histologiczne czynniki rokownicze obejmują stopień złośliwości oceniany w skali Fuhrman, typ histologiczny nowotworu, martwicę guza, inwazję mikrokrążenia i układu zbiorczego. Skala Fuhrman jest niezależnym czynnikiem rokowniczym. W niektórych badaniach sugeruje się, że uproszczony system oceniania może być równie dokładny jak klasyczna skala. Kolejnym czynnikiem rokowniczym jest typ histologiczny guza. Guz chromofobowy i brodawkowaty rokują lepiej od guza jasnokomórkowego. W guzie chromofobowym istotny jest również podział na podtypy. Typ klasyczny (typ I) jest guzem dobrze rokującym, a typ eozynochłonny (typ II) jest związany z gorszym rokowaniem. Również rak nerki z translokacją Xp jest związany ze złym rokowaniem. Klasyfikacja histologiczna raka nerki ma potwierdzenie na poziomie molekularnym, w którym są obecne specyficzne zmiany cytogenetyczne.
Czynniki kliniczne
Klinicznymi czynnikami rokowniczymi są: skale sprawności (np. skala Karnofsky’ego, skala ECOG), występowanie objawów miejscowych nowotworu, ocena kacheksji, niedokrwistości, liczby płytek.
Czynniki molekularne
Do tej pory liczne markery molekularne były badane pod kątem wykorzystania jako czynnika predykcyjnego. Jako potencjalne markery prognostyczne oceniano: anhydrazę węglanową IX, VEGF, HIF-1, Ki-67, p53, fofatazy PTEN i angiotensyny, E-kadheryny, osteopontynę, CRP, CD44.
Systemy prognostyczne
Systemy prognostyczne łączą niezależne czynniki prognostyczne. Systemy te mogą być bardziej precyzyjne niż skala TNM lub Fuhrman.
| Czynnik prognostyczny | TNM | ECOG | Skala Karnofsky’ego | Zespoły para- nowotworowe |
Skala Fuhrman | Martwica guza | Wielkość guza | Czas od rozpoznania do podjęcia leczenia | LDH | Skorygowane stężenie wapnia | Hemoglobina | Neutrofile | Trombocyty | |
| bez przerzutów | UISS | + | + | + | ||||||||||
| SSIGN | + | + | + | + | ||||||||||
| nomogram Karakiewicza | + | + | + | + | ||||||||||
| z przerzutami | MSKCC | + | + | + | + | + | ||||||||
| model Henga | + | + | + | + | + | + | ||||||||
Rokowanie
Rokowanie w raku nerki jest w dużym stopniu uwarunkowane różnymi czynnikami, w tym wielkością guza (cecha T), stopniem inwazji (cecha N), obecnością przerzutów (cecha M), typem histologicznym nowotworu oraz stopniem jego złośliwości i innych czynników rokowniczych ujętych w różnych systemach prognostycznych. Ogólne przeżycie (czas przeżycia zależnego od nowotworu – ang. disease-specific survival, DSS) 5-letnie wynosi 55%, 10-letnie 40% oraz 15-letnie 29%. Mediana przeżycia wynosi około 82 miesiące.
| Stan kliniczny | Grupa ryzyka | Czas | Średnie przeżycie (%) | Mediana przeżycia (miesiące) |
| bez przerzutów | niskie | 5 lat | 97 ± 1 | bez wpływu |
| 10 lat | 92 ± 3 | |||
| 15 lat | 92 ± 3 | |||
| pośrednie | 5 lat | 81 ± 2 | 174 ± 19 | |
| 10 lat | 61 ± 4 | |||
| 15 lat | 45 ± 6 | |||
| wysokie | 5 lat | 62 ± 5 | 95 ± 20 | |
| 10 lat | 41 ± 7 | |||
| 15 lat | 20 ± 10 | |||
| z przerzutami | niskie | 1 rok | 86 ± 4 | 45 ± 4 |
| 5 lat | 41 ± 7 | |||
| 10 lat | 31 ± 8 | |||
| pośrednie | 1 rok | 59 ± 3 | 17 ± 2 | |
| 5 lat | 18 ± 2 | |||
| 10 lat | 7 ± 2 | |||
| wysokie | 1 rok | 19 ± 7 | 6 ± 3 | |
| 5 lat | 8 ± 5 |
| Stadium zaawansowania klinicznego | Odsetek przeżyć pięcioletnich |
| I | 91% |
| II | 74% |
| III | 67% |
| IV | 32% |
| Przeżycie (%) | 5-letnie | 10-letnie | 15-letnie | 20-letnie |
| rak jasnokomórkowy | 71 (63–73) | 62 (60–64) | 56 (53–58) | 52 (49–55) |
| rak brodawkowaty | 91 (88–94) | 86 (82–89) | 85 (81–89) | 83 (78–88) |
| rak chromofobowy | 88 (83–94) | 86 (80–94) | 84 (77–91) | 81 (72–90) |
Zapobieganie
Zapobieganie rakowi nerki polega na modyfikacji czynników ryzyka. Ważnym czynnikiem ryzyka jest palenie tytoniu. Ocenia się, że nawet 30% przypadków raka nerki jest związanych z paleniem. Również zapobieganie otyłości i nadciśnieniu tętniczemu może zmniejszyć ryzyko zachorowania. Istotne jest unikanie zawodowego narażenia na niektóre substancje szkodliwe (wielopierścieniowe węglowodory aromatyczne, kadm, azbest).
Uwagi
Bibliografia
- Radzisław Kordek (red.): Onkologia. Podręcznik dla studentów i lekarzy. Gdańsk: Via Medica, 2007, s. 147–158. ISBN 978-83-7555-016-0.







