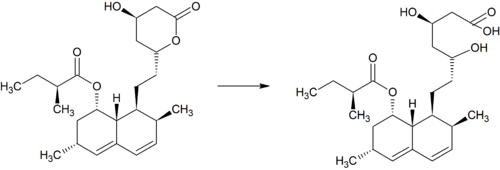Simwastatyna
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C25H38O5 |
||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
418,57 g/mol |
||||||||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek |
||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Simwastatyna, symwastatyna (łac. simvastatinum) – wielofunkcyjny organiczny związek chemiczny, pochodna naturalnej lowastatyny, prolek mający w swojej cząsteczce strukturę pierścienia laktonowego, który ulega hydrolizie do wspólnej z innymi statynami w formie aktywnej grupy farmakoforowej – łańcucha β-hydroksykwasu karboksylowego.
Stosowana jest jako lek zmniejszający stężenie lipidów, ma także dodatkowe działanie plejotropowe na układ krążenia poprzez wpływ na czynność śródbłonka, stabilizację blaszek miażdżycowych, hamowanie układu krzepnięcia, stymulację układu fibrynolizy, hamowanie reakcji zapalnych oraz działanie immunomodulacyjne.
Działa przez hamowanie enzymu reduktazy 3-hydroksy-3-metylo-glutarylokoenzymu A (HMG-CoA).
Znajduje zastosowanie w leczeniu hiperlipidemii, zarówno w monoterapii, jak i leczeniu skojarzonym. Zmniejsza liczbę incydentów wieńcowych, zgonów spowodowanych chorobą wieńcową, udarów mózgu i zabiegów rewaskularyzacyjnych. Jest dobrze tolerowana, a jej najpoważniejszym działaniem niepożądanym jest rabdomioliza.
Występowanie
Półsyntetyczna simwastatyna, zaliczana do statyn naturalnych, oryginalnie była syntetyzowana w wielostopniowym procesie syntezy chemicznej z lowastatyny, lecz może być produkowana przez szczep Escherichia coli z nadekspresją acylotransferazy lovD w obecności tioestru zdolnego do przenikania przez błonę komórkową.
Historia

|
W 1959 w Instytucie Molekularnej Biologii Komórki i Genetyki Maxa Plancka odkryto enzym reduktazę HMG-CoA pełniący kluczową rolę w szlaku metabolicznym syntezy cholesterolu. W latach 60. XX wieku ustalono, iż wątroba nawet przy diecie bezcholesterolowej jest w stanie zwiększyć swoją zdolność do syntezy cholesterolu w stopniu wystarczającym na pokrycie potrzeb całego organizmu. W 1973 roku zespół Akira Endō po przebadaniu ponad 6 tys. szczepów bakteryjnych wykazał, że substancja ML-236B (mewastatyna) wydzielana przez Penicillium citrinum ma właściwości obniżania poziomu cholesterolu oraz lipoproteiny niskiej gęstości (LDL) w surowicy zwierząt laboratoryjnych i ludzi, jednakże badania na zwierzętach wykazały jej potencjalną toksyczność. W 1978 zespół Alfreda Albertsa wyizolował z produktów fermentacji Aspergillus terreus nowy związek o zbliżonej budowie, lowastatynę. Podczas badań nad lowastatyną równolegle prowadzono badania nad jej syntetyczną pochodną MK-733, którą pod nazwą simwastatyna opatentowała firma Merck & Co. Simwastatyna została dopuszczona w 1991 przez FDA do stosowania klinicznego.
Badania kliniczne
Największe badania kliniczne z zastosowaniem simwastatyny:
| Akronim badania |
Nazwa badania |
Czas obserwacji |
Wskazania | Miejsce publikacji |
Liczba przebadanych pacjentów |
Wyniki badania |
|---|---|---|---|---|---|---|
| 4S |
Scandinavian Simvastatin Survival Study |
5 lat |
|
Lancet | 4444 |
|
| CIS |
The multicenter Coronary Intervention Study |
2 lata |
|
European Heart Journal | 254 |
|
| ASAP |
The effects of Atorvastatin versus Simvastatin on Atherosclerosis Study |
2 lata | Lancet | 325 |
|
|
| HPS |
Heart Protection Study of cholesterol lowering with Simvastatin |
5 lat |
|
Lancet | 20 536 |
|
| SCAT |
The Simvastatin/Enalapril Coronary Atherosclerosis Trial |
2 lata |
|
Circulation | 460 |
|
| A to Z |
The Simvastatin/Enalapril Coronary Atherosclerosis Trial |
2 lata |
|
JAMA | 4497 |
|
| IDEAL |
High-Dose Atorvastatin vs Usual-Dose Simvastatin for Secondary Prevention After Myocardial Infarction |
5 lat |
|
JAMA | 8888 |
|
Budowa
Podstawą struktury simwastatyny jest częściowo uwodorowany naftalen, z grupą hydroksylową estryfikowaną resztą kwasu 2,2–dwumetylomasłowego w położeniu 1, grupą metylową w położeniu 7 oraz grupą farmakoforową – sześcioczłonowym pierścieniem laktonowym z grupą hydroksylową w położeniu 4 (w postaci czynnej simwastatyny jest zhydrolizowany do β-hydroksykwasu karboksylowego).
Budowa cząsteczki wszystkich statyn nie tylko wykazuje podobieństwo do cząsteczki 3–hydroksy-3-metyloglutarylo-koenzymu A, lecz także wykazuje tysiąc razy większe powinowactwo do reduktazy 3–hydroksy-3-metyloglutarylo-koenzymu A (HMG-CoA), z którą wiążą się odwracalnie i kompetycyjnie.
Otrzymywanie
Simwastatynę można otrzymać poprzez wprowadzenie dodatkowej grupy metylowej do dostępnej ze źródeł naturalnych lowastatyny. W tym celu opracowano i opatentowano szereg metod syntetycznych, które wykorzystują dwie ogólne strategie chemiczne. W pierwszej zabezpiecza się układ hydroksylaktonowy lowastatyny, a następnie przeprowadza się metylowanie pozycji C2' łańcucha bocznego za pomocą jodku metylu. Syntezę kończy usunięcie grupy blokującej i odtworzenie układu laktonowego (szczegółowy opis poniżej).
W drugim podejściu lowastatyna jest hydrolizowana do monakoliny J zawierającej trzy grupy hydroksylowe. Po zabezpieczeniu dwóch z nich, znajdujących się w łańcuchu bocznym, poprzez selektywne sililowanie, przeprowadzana jest estryfikacja trzeciej, znajdującej się w układzie zredukowanego 1-naftolu, za pomocą chlorku 2,2-dimetylobutyrylu (CH3CH2CMe2COCl). Ostatnim etapem jest usunięcie sililowej grupy zabezpieczającej.
W nowszym, wydajniejszym wariancie tej metody do estryfikacji wykorzystuje się acylotransferazę uzyskaną ze zmutowanego szczepu E. coli, dzięki czemu unika się konieczności blokowania i odblokowywania grup funkcyjnych. Dodatkowym ułatwieniem jest fakt, że sól amonowa monakoliny J jest rozpuszczalna w wodzie, a produkt estryfikacji nie, dzięki czemu wypada on ze środowiska reakcji w postaci ciała stałego. Wydajność procesu estryfikacji monakoliny J wynosi ponad 97%.
Synteza poprzez metylowanie lowastatyny
Znanych jest szereg wariantów syntezy simwastatyny poprzez metylowanie pozycji 2' lowastatyny. Jednym z nich jest trójetapowy proces opracowany latach 90. w firmie Brantford Chemicals Inc. Przykładowa procedura rozpoczyna się od zablokowania układu hydroksylaktonowego za pomocą kwasu fenyloboronowego, PhB(OH)2, by rozbił pierścień laktonowy i utworzył nowy sześcioczłonowy ester cykliczny. Reakcję prowadzono w ochronnej atmosferze azotu w zawiesinie w toluenie ogrzewanym do wrzenia (100–105 °C) przez ok. 1 h, usuwając powstającą wodę. Po odparowaniu rozpuszczalnika pod zmniejszonym ciśnieniem i przemyciu heksanem uzyskiwano produkt o czystości >99% z umiarkowaną wydajnością (37%):
W drugim etapie uzyskany fenyloboran lowastatyny poddawano reakcji z solą litową pirolidyny (czas reakcji: 4 h w ok. −50 °C) i jodkiem metylu (13 h w ok. −20 °C), stosując THF jako rozpuszczalnik. Następnie mieszaninę zakwaszano rozcieńczonym kwasem solnym i przerabiano, stosując ekstrakcję fazami wodnymi, co pozwalało uzyskać produkt – fenyloboran simwastatyny – o czystości >95% z bardzo dobrą wydajnością >98%. Dodatkowa krystalizacja w acetonitrylu podwyższyła czystość do >99% (wydajność 87%):
W ostatnim etapie procedury ochronna grupa fenyloboranowa została usunięta za pomocą propano-1,3-diolu, oddestylowując produkty uboczne w 105–107 °C/0,2 mmHg przez 1 h. Produkt przerabiano w układzie toluen-woda, fazę organiczną osuszano, zatężano pod zmniejszonym ciśnieniem i uzyskaną simwastatynę oczyszczano, przemywając heptanem. Wydajność 88%:
Mechanizm działania

Proces syntezy cholesterolu przebiega w wielu etapach. Pierwszy z nich to biosynteza mewalonianu. Na początku dzięki tiolazie i syntazie HMG-CoA z reszt acetylowych przenoszonych przez koenzym A powstaje 3-hydroksy-3-metyloglutarylo-koenzym A (HMG-CoA). Związek ten jest substratem reduktazy HMG-CoA, która, wykorzystując zredukowaną postać fosforanu dinukleotydu nikotynoamidoadeninowego (NADPH+H+), redukuje go do mewalonianu (stanowiącego substrat kolejnego etapu syntezy cholesterolu). Aktywność tego enzymu hamują w warunkach naturalnych kwasy żółciowe, cholesterol i sam mewalonian. Jest to kluczowy w tym procesie enzym, którego aktywność ogranicza szybkość biosyntezy cholesterolu.
Mechanizm działania statyn opiera się właśnie na specyficznym, kompetytywnym i odwracalnym hamowaniu reduktazy HMG-CoA, co następuje natychmiast po wniknięciu do komórki wątrobowej. Blokowanie syntezy cholesterolu powoduje spadek jego stężenia. Cholesterol uczestniczy w regulacji ekspresji wielu genów poprzez łączenie się z białkami wiążącymi sterolowe elementy regulacyjne, SREBP. Skutkiem tego jest nasilenie transkrypcji genu kodującego receptor dla lipoprotein niskiej gęstości (LDL), wzrost liczby receptorów kodowanych przez ten gen na powierzchni błony komórkowej i zwiększenie wychwytu z krwi lipoprotein niskiej oraz pośredniej gęstości. Biologicznym efektem tego mechanizmu, pod postacią zmian w lipidogramie, jest rozpoczęcie działania statyn po dwóch tygodniach, natomiast pełny efekt występuje po sześciu tygodniach od pierwszej dawki.
Właściwości
Właściwości fizyczne
Simwastatyna jest niehigroskopijnym proszkiem słabo rozpuszczalnym w wodzie (0,03 mg/ml), natomiast dobrze rozpuszczalnym w metanolu, etanolu oraz chloroformie.
Właściwości chemiczne
Podczas ekspozycji na promieniowanie słoneczne (lub naświetlaniu światłem sztucznym o zbliżonej charakterystyce) nie zostały wykryte produkty ewentualnej fotodegradacji (podobnie odporna okazała się (lowastatyna), jednak zachodzi odwracalna hydroliza pierścienia laktonowego. Nie jest natomiast odporna na naświetlanie twardszym ultrafioletem o λ = 254 nm, pod wpływem którego ulega stopniowej degradacji (ok. 10%/h). W wodzie nawet bez naświetlania i w warunkach obojętnych ulega powolnej hydrolizie, której szybkość znacząco wzrasta w środowisku zasadowym.
Rodnik hydroksylowy, HO• (generowany w wodzie poprzez naświetlanie światłem UV w obecności TiO2 jako katalizatora), powoduje dość szybką degradację simwastatyny.
Badania nad degradacją statyn prowadzone były w kontekście ich eliminacji ze ścieków komunalnych i przemysłowych, w których mogą stanowić poważne źródło zanieczyszczenia środowiska z powodu ich masowej produkcji i stosowania.
Farmakokinetyka
Podana doustnie wchłania się z przewodu pokarmowego w 85% i podlega efektowi pierwszego przejścia. W wyniku intensywnego metabolizmu wątrobowego simwastatyny wynoszącego powyżej 60% dostępność biologiczna wynosi 5% pod postacią aktywnych metabolitów, głównie w formie β-hydroksykwasu, który jest właściwym inhibitorem reduktazy HMG-CoA. Maksymalne stężenie we krwi osiąga po 1,3–2,4 godzinach. W około 95% wiąże się z albuminami. Czas półtrwania T0,5 wynosi 2–3 godziny. Simwastatyna jest związkiem lipofilnym, dlatego jest bardziej podatna na metabolizm z udziałem cytochromu P450 i przenika do komórki wątrobowej na drodze dyfuzji biernej. Lipofilność cząsteczki ułatwia przenikanie simwastatyny do ośrodkowego układu nerwowego oraz innych narządów, co może powodować większa liczbę działań niepożądanych. Simwastatyna jest metabolizowana w wątrobie, głównie poprzez cytochrom P450 3A4. Simwastatyna nie jest inhibitorem cytochromu P450, natomiast jest jego induktorem.
Metabolizm
Simwastatyna jest intensywnie metabolizowana w ścianie jelita oraz wątrobie przez izoenzymy CYP3A4, CYP3A5 oraz CYP2C8 cytochromu P450 przed dostaniem się do krążenia ogólnoustrojowego (efekt pierwszego przejścia). Simwastyna, które jest podawana w formie nieczynnego proleku, może wchodzić w jeden z dwóch szlaków metabolicznych – hydrolizy pierścienia laktonowego przez esterazy i peroksydazy do aktywnej pochodnej zawierającej ugrupowanie hydroksykwasowe i następnie przez CYP3A4 do nieaktywnych metabolitów, lub też bezpośrednio do nieaktywnych metabolitów przez CYP3A4 oraz w mniejszym stopniu przez CYP3A5. Głównymi metabolitami simwastatyny są β-hydroksykwas i jego 6-hydroksy-, 6-hydroksymetylo- oraz 6-metylenopochodne.
Metabolity simwastatyny
Metabolity M1, M2, M5, M6 wydalane są w żółci ludzkiej i stanowią odpowiednio M1 łącznie z M2 – 10%, M5 – 5% oraz M6 – 20% przyjętej dawki simwastatyny. Ponieważ w trakcie przekształcenia M4 do M5 i M6 centrum stereogeniczne znajdujące się pozycji 6' w cząsteczce simwastatyny ulega przekształceniu z α do β, sugeruje to istnienie przejściowego metabolitu M4-OH.
| SVA | M1 | M2 | M3 | M4 |
|---|---|---|---|---|
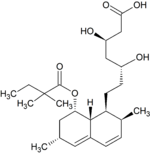
|
width="15%" 
|
|
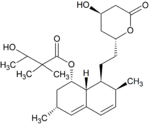
|
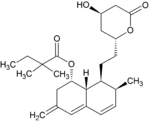
|
| M4-OH | M5 | M6 | M7 | |
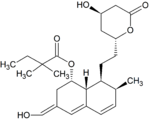
|
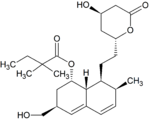
|
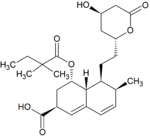
|
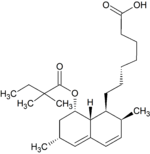
|
| Metabolit | Wzór chemiczny | Obecność w żółci |
Opis |
|---|---|---|---|
| SVA |
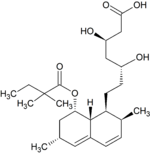
|
brak | ma aktywność terapeutyczną, jedyny istotny metabolit obecny w surowicy, powstaje z simwastatyny w wyniku hydroksylowania pierścienia fenylowego |
| M1 |
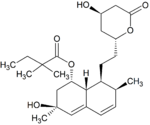
|
brak | |
| M2 |
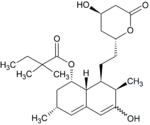
|
10% | |
| M3 |
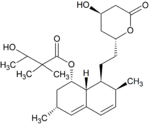
|
brak | |
| M4 |
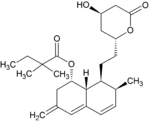
|
brak | |
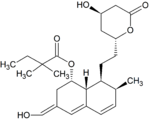
|
brak | postulowany metabolit pośredni pomiędzy M4 a M5 i M6 | |
| M5 |
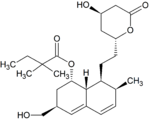
|
5% | |
| M6 |
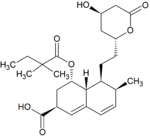
|
20% | |
| M7 |
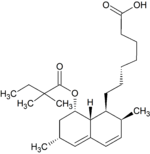
|
brak |
Zastosowania
Simwastatyna jest jedyną statyną, która posiada zarejestrowane wskazanie w celu zmniejszenia śmiertelności całkowitej u pacjentów w grupie ryzyka sercowo-naczyniowego i której przedłużona 10-letnia obserwacja w badaniu 4S jest najdłuższą opublikowaną do tej pory odległą obserwacją zastosowania statyny.
Wskazania
Hipercholesterolemia
- Leczenie pierwotnej hipercholesterolemii lub mieszanej dyslipidemii, jako uzupełnienie diety, kiedy reakcja na dietę lub inne niefarmakologiczne leczenie (np. ćwiczenia fizyczne, zmniejszenie masy ciała) jest niewystarczająca.
- Leczenie rodzinnej homozygotycznej hipercholesterolemii jako uzupełnienie diety i innego leczenia obniżającego stężenie lipidów (np. afereza LDL) lub jeśli takie leczenie jest niewłaściwe lub niedostępne.
Zapobieganie zdarzeniom ze strony układu sercowo naczyniowego
Zmniejszenie zachorowań i umieralności na choroby układu sercowo-naczyniowego u pacjentów z jawną miażdżycą naczyń serca lub cukrzycą, z prawidłowym lub podwyższonym stężeniem cholesterolu, jako leczenie wspomagające, mające na celu skorygowanie innych czynników ryzyka lub uzupełnienie innej terapii zapobiegającej chorobom serca.
Wskazania pozarejestracyjne
- Ciężka wtórna hipercholesterolemia u dzieci w wieku od 10 do 18 roku życia (z wysokim ryzykiem powikłań sercowo-naczyniowych oraz przy braku skuteczności leczenia niefarmakologicznego) w następujących stanach klinicznych:
- niewydolności nerek lub zespołu nerczycowego
- cukrzycy typu I (z towarzyszącą mikroalbuminurią lub niewydolnością nerek)
- otrzymujących terapię antyretrowirusową
- po przeszczepianiu narządów
- W marskości wątroby simwastatyna w dawce 20–40 mg zmniejsza nadciśnienie wrotne.
Wytyczne amerykańskie ACC/AHA 2013
American College of Cardiology (ACC) i American Heart Association (AHA) wydały w 2013 wytyczne postępowania wpływającego na stężenie cholesterolu we krwi. W dwóch grupach pacjentów zalecono leczenie o umiarkowanej intensywności (docelowe zmniejszenie LDL-C o 30–49%), do którego zaliczono także kurację simwastatyną w dawce 20–40 mg:
- chorzy z cukrzycą w wieku 40–75 lat ze stężeniem LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) bez dowodów na chorobę sercowo-naczyniową (jeżeli jednak u takiego chorego wyliczone według kalkulatora ryzyka będącego integralną częścią tych wytycznych 10-letnie ryzyko choroby układu krążenia na tle miażdżycy jest wyższe niż 7,5%, należy rozważyć leczenie intensywne);
- osoby bez choroby sercowo-naczyniowej i bez cukrzycy, w wieku 40–79 lat, ze stężeniem LDL-C 70–189 mg/dl (1,8–4,9 mmol/l) i 10-letnim ryzykiem choroby sercowo-naczyniowej na tle miażdżycy wyliczonego według kalkulatora ryzyka będącego integralną częścią tych wytycznych ≥ 7,5% – należy stosować leczenie umiarkowane lub intensywne.
Zastosowania w trakcie badań
Działanie przeciwnowotworowe
- prowadzone są badania oceniające skuteczność simwastatyny w zapobieganiu progresji raka jelita grubego.
Działanie przeciwzapalne
- prowadzone są badania oceniające skuteczność simwastatyny w leczeniu przewlekłego zapalenia zatok opornego na standardowe metody zachowawcze oraz chirurgiczne.
Interakcje
Jednoczesne leczenie simwastatyną, która jest metabolizowana przez izoenzym CYP3A4 cytochromu P450), i jego silnymi inhibitorami powoduje wzrost jej stężenia w osoczu oraz zwiększa ryzyko wystąpienia miopatii i rabdomiolizy. Badania dotyczące interakcji leków przeprowadzono wyłącznie u dorosłych:
- Acenokumarol – jednoczesne leczenie acenokumarolem i simwastatyną może podwyższać INR, należy oznaczyć INR przed rozpoczęciem leczenia simwastatyną oraz przy każdej zmianie dawki simwastatyny, po ustaleniu się stabilnego poziomu INR można powrócić do rytmu kontroli INR ustalonego przed włączeniem lub zmianą dawki simwastatyny,
- Amiodaron – nie należy stosować simwastatyny w dawce wyższej niż 20 mg/dobę, poza przypadkami, w których korzyść kliniczna może przewyższać zwiększone ryzyko wystąpienia miopatii i rabdomiolizy,
- Amlodypina – przy stosowaniu simwastatyny w dawce 40 mg/dobę nie ma zwiększonego ryzyka miopatii i rabdomiolizy, przy dawce 80 mg/dobę jest w niewielkim stopniu zwiększone,
- Amprenawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Atazanawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Bezafibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Cyprofibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Cyklosporyna – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę, podczas leczenia należy monitorować poziom kinazy kreatynowej oraz poziomu cyklosporyny,
- Danazol – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Digoksyna – jednoczesne stosowanie digoksyny i simwastatyny może powodować niewielki wzrost poziomu digoksyny (poniżej 0,3 ng/ml), jednoczesne leczenie digoksyną i simwastatyną wymaga zachowania szczególnej ostrożności,
- Diltiazem – nie należy stosować simwastatyny w dawce wyższej niż 40 mg/dobę, poza przypadkami, w których korzyść kliniczna może przewyższać zwiększone ryzyko wystąpienia miopatii i rabdomiolizy,
- Efawirenz – stosowanie z simwastyną powoduje zmniejszenie osoczowej aktywności hamującej reduktazę HMG-CoA
- Erytromycyna – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Etofibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Fenofibrat – nie stwierdzono interakcji farmakokinetycznych i farmakodynamicznych,
- Fenytoina – jednoczesne podawanie simwastatyny i fenytoiny może osłabiać działanie simwastatyny
- Gemfibrozyl – powoduje zwiększenie poziomu simwastatyny we krwi, nie ma dowodów, iż stosowanie simwastatyny i gemibrozylu razem powoduje wyższe ryzyko miopatii, niż przy stosowaniu każdego z tych preparatów osobno, jednak nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Indinawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Itrakonazol – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4), jednoczesne podawanie powodowało 10-krotny wzrost poziomu β-hydroksykwasu, będącego aktywnym metabolitem simwastatyny,
- Ketokonazol – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Klarytromycyna – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Klofibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Klofibryd – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Klopidogrel – jednoczesne stosowanie klopidogrelu i simwastatyny powoduje osłabienie antyagregacyjnego działania klopigorelu,
- Kolchicyna – opisano pojedyncze przypadki występowania miopatii przy jednoczesnym stosowaniu simwastatyny i kolchicyny,
- Kwas fusydowy – należy dokładnie monitorować pacjentów i rozważyć czasowe przerwanie stosowania simwastatyny,
- Lopinawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Nefazodon – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Nelfinawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Niacyna – jednoczesne leczenie niacyną w dawce ≥ 1 g/dobę i simwastatyną może powodować rozwój miopatii lub rabdomiolizy,
- Propranolol – przy jednoczesnym stosowaniu simwastatyny i propranololu stwierdzano istotne zmniejszenie maksymalnego osoczowego stężenia simwastatyny i jej metabolitów, przy braku zmiany AUC, bez zmian w farmakokinetyce propranololu, kliniczne znaczenie tego zjawiska nie jest jasne,
- Ryfampicyna – przy jednoczesnym stosowaniu rifampicyny i simwastatyny stężenie simwastatyny zmniejsza się o 93%, podczas długotrwałego stosowania należy monitorować poziom cholesterolu w osoczu i odpowiednio dostosowywać dawkowanie simwastatyny,
- Ritonawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Ronifibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Sakwinawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Sok grejpfrutowy – podczas stosowania simwastatyny należy unikać picia soku grejpfrutowego (ryzyko miopatii i rabdomiolizy po wypiciu 240 ml soku w godzinach porannych wzrasta 1,9 razy, natomiast po wypiciu ponad 1000 ml soku dziennie wzrasta 7 razy),
- Symfibrat – nie należy stosować simwastatyny w dawce wyższej niż 10 mg/dobę,
- Tipranawir – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4),
- Telitromycyna – stosowanie z simwastatyną jest przeciwwskazane w związku ze zwiększonym ryzykiem miopatii i rabdomiolizy (silny inhibitor CYP3A4), jednoczesne podawanie powodowało 11-krotny wzrost poziomu β-hydroksykwasu, będącego aktywnym metabolitem simwastatyny,
- Warfaryna – jednoczesne leczenie warfaryną i simwastatyną może podwyższać INR, należy oznaczyć INR przed rozpoczęciem leczenia simwastatyną oraz przy każdej zmianie dawki simwastatyny; po ustaleniu się stabilnego poziomu INR można powrócić do rytmu kontroli INR ustalonego przed włączeniem lub zmianą dawki simwastatyny,
- Werapamil – nie należy stosować simwastatyny w dawce wyższej niż 20 mg/dobę, poza przypadkami, w których korzyść kliniczna może przewyższać zwiększone ryzyko wystąpienia miopatii i rabdomiolizy.
Przeciwwskazania i środki ostrożności
Przeciwwskazania
Istnieją następujące przeciwwskazania stosowania leku:
- znana nadwrażliwość na simwastatynę lub którykolwiek ze składników pomocniczych,
- czynna choroba wątroby lub utrzymujące się, niewyjaśnione zwiększenie aktywności aminotransferaz w surowicy,
- ciąża i okres karmienia piersią,
- jednoczesne podawanie silnych inhibitorów izoenzymu CYP3A4 cytochromu P450 (itrakonazol, ketokonazol, erytromycyna, klarytromycyna, telitromycyna, amprenawir, atazanawir, indinawir, lopinawir, nelfinawir, ritonawir, sakwinawir, tipranawir i nefazodon)
Środki ostrożności
Należy zachować ostrożność u pacjentów z czynnikami predysponującymi do rabdomiolizy
- wiek ≥ 65 lat
- płeć żeńska
- zaburzenia czynności nerek
- niekontrolowana niedoczynność tarczycy
- hipoalbuminemia
- indywidualny lub rodzinny wywiad świadczący o dziedzicznych miopatiach
- wcześniejsze występowanie objawów toksycznych w zakresie układu mięśniowego za zastosowaniu leków z grupy inhibitorów reduktazy HMG-CoA lub fibratów
- nadużywanie alkoholu
Przed leczeniem
Istnieją następujące sytuacje kliniczne w jakich należy zachować ostrożność przed leczeniem:
| Sytuacja kliniczna | Zalecane postępowanie |
|---|---|
| obecność czynników predysponujących do rabdomiolizy |
|
| wcześniejsze występowanie objawów toksycznych w zakresie układu mięśniowego za zastosowaniu leków z grupy inhibitorów reduktazy HMG-CoA lub fibratów |
|
Podczas leczenia
Istnieją następujące sytuacje kliniczne w jakich należy zachować ostrożność podczas leczenia:
| Sytuacja kliniczna | Zalecane postępowanie |
|---|---|
| aktywność kinazy kreatynowej ponad pięciokrotnie przekraczająca normę |
|
| podejrzenie miopatii z dowolnej przyczyny |
|
| planowany duży zabieg chirurgiczny |
|
| poważne pogorszenie stanu ogólnego pacjenta |
|
Działania niepożądane
Działania niepożądane stwierdzone podczas badań klinicznych:
| Układ | Działanie niepożądane |
Częstość występowania |
|---|---|---|
| Układ pokarmowy | bóle brzucha | 2,2% |
| zgaga | 0,5% | |
| zaparcia | 2,5% | |
| dyspepsja | 0,6% | |
| biegunka | 0,8% | |
| wzdęcia | 2,0% | |
| nudności | 1,1% | |
| Układ nerwowy | ból głowy | 1,0% |
| Skóra | wysypka | 0,7% |
| Badania diagnostyczne | Zwiększenie aktywności CPK | 5,0% |
| Zwiększenie aktywności AspAT | obserwowane | |
| Zwiększenie aktywności AlAT | obserwowane | |
| Inne | astenia | 0,8% |
Miopatia i rabdomioliza
Miopatia jest rzadkim (w badaniu Scandinavian Simvastatin Survival Study (4S) na 4444 pacjentach stwierdzono tylko jeden taki przypadek) powikłaniem leczenia wszystkimi inhibitorami reduktazy HMG-CoA, objawiającą się bólem mięśniowym, tkliwością mięśni lub osłabieniem ich siły z towarzyszącym ponad dziesięciokrotnym zwiększeniem aktywności kinazy kreatynowej. Miopatia czasem przechodzi w rabdomiolizę, której może towarzyszyć ostra niewydolność nerek, spowodowana wydalaniem mioglobiny w moczu.
Ryzyko miopatii w zależności od dawki jest następujące:
| dawka simawastatyny |
częstość występowania |
|---|---|
| 20 mg | 0,03% |
| 40 mg | 0,08% |
| 80 mg | 0,61% |
W pierwszym roku leczenia występuje 50% z obserwowanych przypadków miopatii, natomiast 60% z obserwowanych przypadków miopatii występuje u pacjentów z polimorfizmem pojedynczego nukleotydu w zakresie genu SLCO1B1 położonego na chromosomie 12 typu rs4149056 C.
Dawkowanie
Dawkowanie w różnych sytuacjach klinicznych przestawia się następująco:
Osoby dorosłe
| dawka początkowa | maksymalna dawka | korekta dawki |
|---|---|---|
| 5–80 mg | 80 mg | co > 4 tygodnie |
Hipercholesterolemia
| Obniżenie LDL | Początkowe dawkowanie w mg |
Uwagi |
|---|---|---|
| <45% | 10–20 |
|
| >45% | 20–40 |
Homozygotyczna hipercholesterolemia rodzinna
| Dawka dobowa w mg |
Dawkowanie w mg | Uwagi | ||
|---|---|---|---|---|
| rano | południe | wieczór | ||
| 40 | 0 | 0 | 40 |
|
| 80 | 20 | 20 | 40 | |
Zapobieganie zdarzeniom ze strony układu sercowo-naczyniowego
| Początkowe dawkowanie w mg |
Uwagi |
|---|---|
| 20-40 |
|
Pacjenci w podeszłym wieku
Nie ma konieczności dostosowywania dawki leku.
Dzieci i młodzież
- chłopcy powyżej I fazy dojrzewania według skali Tannera
- dziewczęta, u których minął co najmniej 1 rok od menarche
| dawka początkowa | maksymalna dawka | korekta dawki |
|---|---|---|
| 10 mg | 40 mg | co > 4 tygodnie |
Zaburzenia czynności nerek
Nie ma konieczności dostosowywania dawki simwastatyny u pacjentów z niewielką i umiarkowaną niewydolnością nerek:
| Klirens kreatyniny | Dawkowanie |
|---|---|
| 30–80 ml/min |
dawka bez zmian |
| <30 ml/min |
10 mg w razie konieczności |
Zaburzenia czynności wątroby
Simwastatyna jest przeciwwskazana u chorych z:
- aktywną chorobą wątroby
- utrzymujące się, niewyjaśnione zwiększenie aktywności aminotransferaz w surowicy, trzykrotnie przewyższające normę
Sposób zażywania
Simwastatyna jest podawana raz na dobę, doustnie, wieczorem razem z posiłkiem.
Przedawkowanie
Brakuje specyficznych danych dotyczących postępowania w przedawkowaniu simwastatyny. W opisanych przypadkach przedawkowania simwastatyny maksymalna przyjęta dawka wynosiła 3600 mg i żaden z pacjentów nie doznał trwałego uszczerbku na zdrowiu.
Leczenie przedawkowania simwastatyny jest jedynie objawowe i podtrzymujące, ze szczególnym monitorowaniem funkcji wątroby. Nie ma danych dotyczących skuteczności dializoterapii w zakresie simwastatyny i jej metabolitów u ludzi.
Preparaty
Unia Europejska
- Preparaty proste zarejestrowane w Polsce
Angiolip, Apo-Simva, Corr, Egilipid, Simcovas, Simgal, Simorion, Simratio, Simvacard, Simvachol, Simvacor, Simvagamma, Simvagen, SimvaHexal, Simvastatin (różne wersje), Simvastatin Genoptim, Simvasterol, SimvaTeva, Symwastatyna (różne wersje), Vasilip, Vastan, Ximve, Zifam, Zocor
Preparaty te mają postać tabletek zawierających 5–80 mg simwastatyny.
- Preparaty złożone zarejestrowane w Polsce
Inegy: ezetymib 10 mg + simwastatyna 10–40 mg
- Preparaty zarejestrowane w innych krajach Unii Europejskiej
Bozara, Colemin, Corolin, Denan, Lipocard, Liponorm, Lodales, Medipo, Pantok, Sinvacor, Sivastin, Simvastatin Vale, Simvastatin Krka, Vacolest, Zemox, Zoco, Zocor, Zocord
Bibliografia
- Maciej Banach, Jacek Rysz, Krzysztof J. Filipiak: Simwastatyna. Gdańsk: Via Medica, 2009. ISBN 978-83-7599-118-5.
- Maciej Banach, Krzysztof J. Filipiak, Grzegorz Opolski: Aktualny stan wiedzy na temat statyn. Poznań: 2013. ISBN 978-83-63622-21-3.
Linki zewnętrzne
| C10A – Leki zmniejszające stężenie lipidów we krwi |
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| C10B – Leki zmniejszające stężenie lipidów w połączeniach |
|