Rak jelita grubego
| carcinoma intestini crassi | |
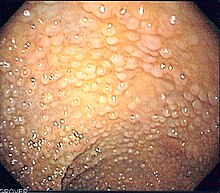
 Rak jelita grubego (preparat pooperacyjny) | |
| Klasyfikacje | |
| ICD-10 |
C18 |
|---|---|
| C18.0 |
jelito ślepe |
| C18.1 |
wyrostek robaczkowy |
| C18.2 |
okrężnica wstępująca |
| C18.3 |
zgięcie wątrobowe |
| C18.4 |
okrężnica poprzeczna |
| C18.5 |
zgięcie śledzionowe |
| C18.6 |
okrężnica zstępująca |
| C18.7 |
esica |
| C18.8 |
zmiana przekraczająca granice jednego umiejscowienia w obrębie jelita grubego |
| C18.9 |
okrężnica, umiejscowienie nieokreślone |
| ICD-10 |
C19 |
| ICD-10 |
C20 |
{{Choroba infobox}}
|
Rak jelita grubego (łac. carcinoma intestini crassi) – pierwotny nowotwór złośliwy jelita grubego wywodzący się z nabłonka błony śluzowej jelita grubego. Do raka jelita grubego zaliczany jest rak okrężnicy, rak zgięcia esiczo-odbytniczego i rak odbytnicy. Klinicznie bywa dzielony na raka okrężnicy i odbytnicy. Rak kanału i brzegu odbytu jest osobną jednostką kliniczną.
Pod względem zapadalności na świecie stanowi drugi co do częstości nowotwór złośliwy u kobiet i trzeci u mężczyzn. W 2012 roku rozpoznano 1 340 000 przypadków raka jelita grubego i 690 000 zgonów z jego powodu. Histopatologicznie zdecydowaną większość nowotworów jelita grubego u ludzi stanowi gruczolakorak. Objawy choroby zależą od lokalizacji guza oraz jej zaawansowania. Początkowo nowotwór pozostaje bezobjawowy lub skąpoobjawowy. Typowym objawem raka jelita grubego jest krwawienie, które przy dalszej lokalizacji guza jest obserwowane jako jawna obecność krwi zmieszanej ze stolcem lub krwi na stolcu, a w przypadku bliższej lokalizacji guza krew ulega degradacji i świeża krew nie jest widoczna, a krwawienie objawia się obecnością ciemno zabarwionych stolców i niedokrwistości z niedoboru żelaza. Anemia manifestuje się przede wszystkim osłabieniem, ciągłym zmęczeniem oraz bladością skóry i błon śluzowych. Ból brzucha występujący przy raku jelita grubego jest niecharakterystyczny, jego lokalizacja i typ zależą od lokalizacji guza. Mogą występować naprzemienne biegunki i zaparcia, a także spadek masy ciała. W zaawansowanej chorobie w badaniu fizykalnym może być wyczuwalny guz, powiększenie wątroby lub węzłów chłonnych.
Duże znaczenie w powstawaniu choroby mają modyfikowalne czynniki ryzyka, z których największe znaczenie ma nieprawidłowa dieta ze zbyt dużą ilością czerwonego mięsa, tłuszczów nasyconych i zbyt małą ilością warzyw, owoców i błonnika. Istotne znaczenie mają palenie tytoniu, otyłość, cukrzyca i nieswoiste zapalenia jelit. W 20–30% przypadków raka zachorowania mają tło dziedziczne, które zwykle pozostaje niezidentyfikowane.
Podstawowym badaniem pozwalającym rozpoznać raka jelita grubego jest kolonoskopia, która umożliwia uwidocznienie guza i pobranie próbek do badania histopatologicznego. Pomocniczo stosuje się wirtualną kolonoskopię TK lub MRI, endoskopię kapsułkową oraz radiologiczne badanie dwukontrastowe. W ocenie zaawansowania stosuje się tomografię komputerową, rezonans magnetyczny, ultrasonografię endoskopową oraz pozytonową tomografię emisyjną. Zaawansowanie choroby klasyfikuje się w klasyfikacji TNM.
Leczenie raka jelita grubego warunkuje zaawansowanie choroby oraz stan chorego. Wykonuje się zabieg operacyjny, który ma na celu usunięcie guza wraz z marginesem zdrowych tkanek. Rodzaj zabiegu zależy od lokalizacji guza i zwykle polega na resekcji części jelita z usunięciem regionalnych węzłów chłonnych w jednym bloku tkankowym z odtworzeniem ciągłości przewodu pokarmowego. W przypadku guza położonego w odbytnicy, dąży się również do odtworzenia ciągłości przewodu pokarmowego z zachowaniem zwieraczy odbytnicy, jednakże w przypadku zbyt niskiego położenia guza, konieczna jest amputacja odbytnicy i wytworzenie stałej kolostomii. Leczenie operacyjne w zaawansowanych przypadkach raka odbytnicy jest poprzedzone leczeniem neoadiuwantowym, a w zaawansowanych przypadkach raka okrężnicy jest uzupełnione leczeniem adiuwantowym. Leczenie choroby z przerzutami jest oparte na chemioterapii, której charakter zależy od założonych celów terapeutycznych i stanu chorego. U niewielkiej części chorych możliwe jest chirurgiczne usunięcie pojedynczych przerzutów do wątroby lub płuc. W chemioterapii wielolekowej stosuje się programy składające się z fluoropirymidyn (5-fluorouracylu, kapecytabiny) w połączeniu z oksaliplatyną lub irynotekanem.
Objawy
Objawy raka jelita grubego zależą od lokalizacji guza i stopnia zaawansowania choroby. Objawy wynikają z miejscowego wzrostu guza w obrębie światła jelita, nacieku sąsiednich struktur oraz obecności przerzutów odległych. Przebieg choroby może być przez długi czas bezobjawowy.
Przewlekłe krwawienie z przewodu pokarmowego jest jednym z najczęstszych objawów raka jelita grubego i jest stwierdzane u większości chorych. Jawna obecność krwi występuje przy guzach położonych w dalszej części jelita grubego. Rak odbytnicy może powodować obecność świeżej krwi na stolcu, z kolei rak zstępnicy i esicy może być przyczyną obecności krwi zmieszanej ze stolcem lub na stolcu (hematochezja). Krew w stolcu stwierdza się u około 80% chorych z rakiem odbytnicy, 45% chorych z rakiem w lewej połowie okrężnicy i 20% prawej połowy okrężnicy. W przypadku guzów położonych w prawej części jelita grubego zwykle nie stwierdza się jawnej obecności krwi w stolcu, co jest związane z degradacją i wymieszaniem krwi ze stolcem podczas pasażu przez dalszą część jelita grubego. Obecność utajonego krwawienia skutkuje niedokrwistością z niedoboru żelaza objawiającą się osłabieniem, łatwą męczliwością, dusznością, bladością skóry i błon śluzowych oraz przyspieszeniem akcji serca, a także obniżeniem stężenia hemoglobiny stwierdzanym w morfologii krwi. Utajone krwawienie jest stwierdzane aż u 80% chorych na raka jelita grubego, a obniżenie stężenia hemoglobiny u 60% chorych. Domieszka krwi z bliższej części okrężnicy, poddanej rozkładowi przez bakterie, skutkuje obecnością smolistego stolca (stolec o ciemnym zabarwieniu).
Ból brzucha lub dyskomfort w brzuchu jest częstym objawem raka jelita grubego i występuje u około połowy chorych. Ból brzucha towarzyszący rakowi jelita grubego może być kurczowy, kolkowy lub stały. Lokalizacja bólu jest różna w zależności od lokalizacji choroby i może występować w okolicy podbrzusza, nadbrzusza, okolicy pępkowej oraz okolicy kroczowej, choć często ból jest trudny do zlokalizowania.
Zmiana rytmu wypróżnień z naprzemiennymi zaparciami i biegunkami z domieszką śluzu może być spowodowana rakiem, jednak jest to stosunkowo częsty objaw w populacji ogólnej. Rakowi odbytnicy może towarzyszyć uczucie niepełnego oddawania stolca, a także zmniejszenie szerokości oddanego stolca nazywane stolcami ołówkowatymi.
Niezamierzony spadek masy ciała występuje u około połowy chorych na raka jelita grubego. Częściowo jest on spowodowany lub nasilany uciążliwymi objawami ze strony jamy brzusznej, które prowadzą do zmniejszenia apetytu. U chorych z zaawansowaną chorobą za utratę masy ciała odpowiada zespół kacheksja-anoreksja.
Wzrost guza w kierunku światła jelita grubego może spowodować zwężenie światła i wywołać przepuszczającą lub całkowitą niedrożność jelit. Niedrożność częściej pojawia się w esicy i odbytnicy. Częściowa niedrożność jelita grubego objawia się kolkowym bólem brzucha, zatrzymaniem stolca, wzdęciem i nudnościami. Ból kolkowy pojawia się z mniejszą częstością i mniejszą intensywnością niż w niedrożności jelita cienkiego. Brzuch podczas badania palpacyjnego jest nieco bolesny, w osłuchiwaniu jamy brzusznej mogą być słyszalne dźwięki perystaltyki, jednak w późniejszym etapie perystaltyka zanika. W niedrożności całkowitej pojawiają się ból brzucha, zatrzymanie stolca i gazów, nudności oraz wymioty. Masywny krwotok do przewodu pokarmowego lub perforacja zdarzają się stosunkowo rzadko.
W badaniu palpacyjnym brzucha w zaawansowanym stadium choroby bywa wykrywany guz. Częściej jednak stwierdza się powiększenie wątroby i wodobrzusze związane z obecnością przerzutów. Badanie per rectum (przez odbyt) często pozwala palpacyjnie rozpoznać obecność guza, obecność krwi, rzadziej próg Blumera związany z obecnością masy nowotworowej w zachyłku odbytniczo-pochwowym u kobiet lub zachyłku odbytniczo-pęcherzowym u mężczyzn. Bywają obecne powiększone węzły chłonne okolicy okołopępkowej (guzek siostry Mary Joseph) i powiększenie węzłów chłonnych nadobojczykowych (węzeł Virchowa).
Czynniki ryzyka
Do czynników ryzyka zachorowania na raka jelita grubego należą:
- nieprawidłowa dieta zbyt bogata w czerwone mięso, szczególnie smażone i grillowane, tłuszcze nasycone i zbyt uboga w świeże warzywa i owoce,
- nadwaga i otyłość,
- niska aktywność fizyczna,
- palenie tytoniu,
- cukrzyca,
- czynniki genetyczne:
- występowanie raka jelita grubego w rodzinie,
- zespół Lyncha,
- rodzinny rak jelita grubego typu X,
- zespół rodzinnej polipowatości gruczolakowatej,
- zespół Peutza-Jeghersa,
- polipowatość związana z mutacją MYH,
- nieswoiste zapalenia jelit,
- nadmierne spożywanie alkoholu,
- akromegalia,
- radioterapia w obrębie miednicy.
Ochronną rolę wykazują warzywa i owoce oraz prawdopodobnie spożycie błonnika i kwasów tłuszczowych omega-3.
Dieta
Nieprawidłowa dieta ma kluczowy wpływ na rozwój raka jelita grubego. Może ona odpowiadać za 70–90% wszystkich jego przypadków. Nadmierne spożywanie czerwonego mięsa i tłuszczów zwierzęcych sprzyja rozwinięciu raka jelita grubego. Prawdopodobnie spożycie warzyw i owoców wykazuje działanie chroniące przed rakiem jelita grubego. Ochronna rola kwasów tłuszczowych omega-3 i błonnika jest niejasna.
- Nadmierne spożycie czerwonego mięsa
Nadmierne spożycie czerwonego mięsa, szczególnie poddanego smażeniu lub grillowaniu jest czynnikiem ryzyka rozwoju raka jelita grubego. Metaanaliza wykazała, że nadmierne spożycie czerwonego mięsa zwiększa ryzyko rozwoju raka jelita grubego o 33%. Zwiększenie dziennej konsumpcji czerwonego mięsa o 100 g zwiększa ryzyko rozwoju raka o 12–17%. Wykazano, że ryzyko rozwoju raka jest większe w przypadku smażenia lub grillowania czerwonego mięsa.
Jednak kilka badań podważa związek spożycia czerwonego mięsa ze zwiększonym ryzykiem zachorowania ze względu na trudności z oddzieleniem wpływu innych czynników ryzyka związanych ze stylem życia oraz samym sposobem obróbki cieplnej mięsa (w tym smażeniem i grillowaniem mięsa).
- Nadmierne spożycie tłuszczów pochodzenia zwierzęcego
Prawdopodobnie nadmierne spożycie tłuszczów nasyconych, które są obecne głównie w produktach pochodzenia zwierzęcego, jest czynnikiem zwiększonego ryzyka zachorowania na raka jelita grubego. Kilka badań wskazuje na wzrost ryzyka zachorowania spowodowany wysokim spożyciem tłuszczów pochodzenia zwierzęcego. Na ryzyko związane z tłuszczami nasyconymi wskazały dwa duże badania. Badanie przeprowadzone na grupie 80 000 kobiet potwierdziło ryzyko związane z nadmiernym spożyciem tłuszczów pochodzenia zwierzęcego i wspiera zalecenie zastąpienia czerwonego mięsa drobiem i rybami. Badanie przeprowadzone na grupie 130 000 osób wskazało na 20% obniżenie ryzyka zachorowania na raka u osób, które zmniejszyły spożycie tłuszczów pochodzenia zwierzęcego. Z drugiej strony jedna metaanaliza kilku badań nie wykazała związku pomiędzy spożyciem tłuszczów pochodzenia zwierzęcego a ryzykiem rozwoju raka jelita grubego.
- Kwasy tłuszczowe omega-3
Prawdopodobnie kwasy tłuszczowe omega-3 mogą zapobiegać zachorowaniu na raka jelita grubego, choć liczba dowodów naukowych jest ograniczona. Kilka badań wskazało na zmniejszone ryzyko rozwoju raka u osób o zwiększonym spożyciu kwasów tłuszczowych omega-3. W chińskiej metaanalizie spożycie tłustych ryb, które są bogatym źródłem kwasów tłuszczowych omega-3, zmniejsza ryzyko pojawienia się raka jelita grubego o 12%.
Z drugiej strony są badania zaprzeczające lub niewspierające korelacji spożycia kwasów omega-3 i redukcji ryzyka zachorowania na raka jelita grubego. Prawdopodobnie sztuczna suplementacja kwasów tłuszczowych omega-3 nie zmniejsza ryzyka rozwinięcia raka jelita grubego.
- Warzywa i owoce
Prawdopodobnie ryzyko zachorowania na raka jelita grubego zmniejsza spożycie warzyw i owoców. Ochronne działanie może być rezultatem obecności antyoksydantów, błonnika, witamin, w tym kwasu foliowego, mikroelementów i flawonów. Dieta bogata w warzywa, owoce i otręby pszenne zmniejsza ryzyko powstania gruczolaków, które są prekursorem większości przypadków raka jelita grubego.
- Błonnik
Rola błonnika w zapobieganiu zachorowaniu na raka jelita grubego jest niejasna. Starsze badania wskazywały na ochronne działanie błonnika. Jednak kilka późniejszych badań nie potwierdzało tego efektu lub wykazywało niewielki efekt ochronny. Metaanaliza z 2005 roku nie udowodniła ochronnego wpływu błonnika, ale późniejsza metaanaliza z 2011 roku wskazała, że spożycie błonnika redukuje ryzyko raka jelita grubego i zwiększenie spożycia błonnika o 10 g dziennie zmniejsza ryzyko raka o 10%.
- Witamina D3 i wapń
Dane dotyczące ochronnego wpływu witaminy D3 i wapnia są niespójne, choć niektóre badania sugerują ich korzystne działanie. Ochronne działanie witaminy D3 może wynikać ze stymulacji różnicowania się komórek i hamowania ich podziałów. Przesłanką do ochronnej roli witaminy D3 jest wyższa śmiertelność na raka jelita grubego w regionach o wyższej szerokości geograficznej, gdzie z powodu mniejszego nasłonecznienia synteza witaminy jest słabsza oraz niższa częstość występowania raka w populacjach o wysokim spożyciu świeżych ryb, skorupiaków i witaminy D.
Wyniki badań roli witaminy D3 są niespójne. Jedno badanie wskazuje na odwrotny stosunek stężenia witaminy D3 i ryzyka raka oraz redukcję ryzyka raka o 50% przy suplementacji witaminy w dawce 1000 IU dziennie, z kolei inne nie wykazują ochronnego działania witaminy D3.
Podobnie niejasna jest rola wapnia. Kilka badań wskazuje na działanie ochronne przy spożyciu 700–800 mg dziennie, a kilka nie stwierdza tego efektu. Jednak metaanaliza 10 badań wskazuje na 22% redukcję ryzyka zachorowania na raka jelita grubego.
Otyłość
Nadwaga i otyłość są niezależnymi czynnikami ryzyka wystąpienia raka jelita grubego. W dużym badaniu wskaźnik BMI 30 jest związany z 1,19-krotnie zwiększonym ryzykiem zachorowania na raka. Ryzyko rozwoju raka jest proporcjonalne do stopnia otyłości. Wzrost wskaźnika BMI o 2 zwiększa ryzyko o 7%, a wzrost obwodu talii o 2 cm zwiększa ryzyko o 4%. Nadwaga i otyłość jest związana z 11% przypadków raka jelita grubego. Ryzyko raka może być zwiększone o 30–70%. Otyłość jest czynnikiem wpływającym na zwiększenie ryzyka rozwoju raka okrężnicy u mężczyzn i kobiet, przy czym ryzyko jest znacząco większe u mężczyzn. Ryzyko rozwoju raka odbytnicy jest większe u mężczyzn, ale u kobiet nie zaobserwowano korelacji otyłości z ryzykiem wystąpienia raka odbytnicy. Wykazano, że otyłość brzuszna zwiększa ryzyko pojawienia się gruczolaka w porównaniu do osób bez otyłości.
Cukrzyca
Cukrzyca jest czynnikiem zwiększającym ryzyko zachorowania na raka jelita grubego. Ryzyko dotyczy obu płci i lokalizacji w okrężnicy oraz odbytnicy. Zwiększone ryzyko prawdopodobnie jest rezultatem stymulacji wzrostu komórek przez insulinę i IGF oraz ułatwienia wykorzystania glukozy przez komórki nowotworowe. Ponadto wykazano, że chorzy z cukrzycą mają gorsze rokowanie i wyższe ryzyko zgonu z powodu raka jelita grubego niż chorzy bez cukrzycy.
Niska aktywność fizyczna
Niska aktywność fizyczna wiąże się ze zwiększonym ryzykiem wystąpienia raka jelita grubego. U 25–33% chorych na raka jelita grubego stwierdza się powiązane modyfikowalne czynniki ryzyka: otyłość i brak aktywności fizycznej.
Istnieją dowody sugerujące, że wzrost aktywności fizycznej zmniejsza ryzyko zachorowania. Zaobserwowano relację dawka–odpowiedź, a zatem większa częstość i intensywność aktywności fizycznej przekłada się na zmniejszenie ryzyka zachorowania. Aktywność fizyczna redukuje ryzyko prawdopodobnie poprzez przyspieszenie tempa metabolizmu, obniżenie masy ciała i insulinooporności oraz przyspieszenie perystaltyki jelit.
Palenie tytoniu
Palenie tytoniu zwiększa ryzyko zachorowania na raka jelita grubego. Zwiększa ono 1,25-krotnie względne ryzyko zachorowania, a także zwiększa ryzyko zgonu z powodu raka jelita grubego. Ryzyko jest proporcjonalne do dziennej ilości wypalanych papierosów, lat trwania nałogu, paczkolat, a także w mniejszym stopniu niższego wieku rozpoczęcia palenia. Palenie wykazuje większy związek z rakiem okrężnicy niż odbytnicy. Zaobserwowano związek palenia z większym ryzykiem powstawania polipów w jelicie grubym. Po zaprzestaniu palenia spadek ryzyka zachorowania do ryzyka populacyjnego obserwuje się dopiero po 30 latach od porzucenia nałogu.
Nieswoiste zapalenia jelit
Do nieswoistych zapaleń jelita związanych ze zwiększonym ryzykiem zachorowania na raka jelita grubego należą wrzodziejące zapalenie jelita grubego i choroba Leśniowskiego-Crohna. Ryzyko jest uzależnione od typu zapalenia jelita, długości trwania choroby i jej rozległości. Metaanaliza długoterminowych badań z 2001 roku wykazała, że ryzyko rozwoju raka u osób chorujących na wrzodziejące zapalenie jelita grubego wynosi po 10 latach choroby 1,6%, po 20 latach już 8,3%, a po 30 latach choroby 18,4%. Późniejsze wyniki europejskich badań wskazały na niższe ryzyko rozwoju raka. Z kolei metaanaliza badań oceniających ryzyko rozwoju raka u chorych z chorobą Leśniowskiego-Crohna wskazała na porównywalne, choć niższe ryzyko w stosunku do wrzodziejącego zapalenia jelita grubego. Ryzyko po 10 latach w chorobie Leśniowskiego-Crohna wynosi 2,9%, po 20 latach 5,6% i 8,3% po 30 latach choroby.
Ryzyko zachorowania na raka jest większe w przypadku rozległego zajęcia jelita grubego u chorych z wrzodziejącym zapaleniem jelita grubego. Niewielkie lub wręcz bez zwiększonego ryzyka dotyczy zajęcia odbytnicy lub esicy. Pośrednie ryzyko dotyczy zajęcia lewej połowy okrężnicy, a największe zajęcia całego jelita grubego (pancolitis). Pierwotne stwardniające zapalenie dróg żółciowych (PSC) jest pozajelitową manifestacją nieswoistych zapaleń jelit, częściej występujące przy wrzodziejącym zapaleniu jelita grubego. Pierwotne stwardniające zapalenie dróg żółciowych znacznie zwiększa ryzyko wystąpienia raka jelita grubego. Wykazano, że 21% chorych z pierwotnym stwardniającym zapaleniem dróg żółciowych i nieswoistym zapaleniem jelit rozwija raka jelita grubego. Występowanie sporadycznego raka jelita grubego w rodzinie chorego na nieswoiste zapalenie jelit dodatkowo zwiększa ryzyko zachorowania na raka.
Alkohol
Nadmierne spożywanie alkoholu etylowego niesie ze sobą zwiększone ryzyko raka jelita grubego. Ryzyko jest proporcjonalne do ilości spożywanego alkoholu. Wykazano, że u osób spożywających ponad 45 g etanolu dziennie występuje 1,4-krotnie zwiększone ryzyko zachorowania. Zwiększone ryzyko, choć mniejsze, jest obserwowane również przy spożyciu 30–40 g alkoholu.
Napromieniowywanie miednicy
Prawdopodobnie wcześniejsza radioterapia w obrębie miednicy wiąże się ze zwiększonym ryzykiem zachorowania.
Akromegalia
Chorzy na akromegalię są bardziej narażeni na pojawienie się gruczolaków jelita grubego oraz raka jelita grubego.
Występowanie rodzinne i czynniki genetyczne
W 20–30% przypadków raka jelita grubego obserwuje się jego rodzinne występowanie. W 3–5% przypadków jest ono spowodowane definiowalnymi zespołami zwiększonej predyspozycji do nowotworów.
- Zespół Lyncha (dziedziczny rak jelita grubego niezwiązany z polipowatością, HNPCC)
Zespół Lyncha jest zespołem zwiększonej predyspozycji genetycznej do nowotworów złośliwych, jest dziedziczony autosomalnie dominująco i uwarunkowany mutacjami genów odpowiedzialnych za naprawę DNA, najczęściej genów MSH2 i MLH1. Zespół Lyncha stanowi około 2–3% wszystkich raków jelita grubego. Wiąże się z 80% ryzykiem zachorowania na raka jelita grubego. Rak wykazuje skłonność do pojawiania się w prawej (proksymalnej) części jelita grubego, cechowania się niższym stopniem zróżnicowania (wyższy stopień złośliwości histologicznej) oraz komponentem śluzowym. Zwykle rak jelita grubego pojawia się między 40. a 50. rokiem życia, średni wiek zachorowania wynosi 44 lata. U około jednej trzeciej chorych rozwijają się inne nowotwory niż rak jelita grubego. U kobiet najczęściej jest to rak trzonu macicy, którego ryzyko wystąpienia w ciągu życia wynosi 40–60%. Ryzyko zachorowania na raka żołądka w ciągu życia wynosi około 13%, a na raka jajnika około 12%. W zespole Lyncha obserwuje się również zwiększone ryzyko rozwoju raka jelita cienkiego, raka nerki, raka moczowodu, a rzadziej raka podstawnokomórkowego skóry, raka dróg żółciowych i nowotworów centralnego układu nerwowego.
- Rodzinny rak jelita grubego typu X (Familial Colorectal Cancer Type X, FCCX)
Rodzinny rak jelita grubego typu X to zespół, w którym obserwuje się rodzinnie zwiększone ryzyko zachorowania na raka jelita grubego i spełnione są kryteria amsterdamskie, ale nie rozpoznaje się niedoborów lub defektu genów naprawy DNA. Zgodnie z kryteriami amsterdamskimi stwierdza się obecność co najmniej trzech członków rodziny chorych na raka jelita grubego, z czego jeden krewny wykazuje pokrewieństwo I stopnia w stosunku do pozostałych chorych, rak pojawia się w co najmniej dwóch pokoleniach i co najmniej jedno zachorowanie pojawia się przed 50. rokiem życia. Obserwuje się dziedziczenie autosomalne dominujące, jednak podłoże genetyczne pozostaje niepoznane. Kryteria amsterdamskie, ale bez rozpoznanej mutacji lub niedoborów genów naprawy DNA spełnia 40–50% rodzin.
Rak pojawia się w późniejszym wieku niż w zespole Lyncha i ryzyko pojawienia się raka u krewnych jest niższe niż zespole Lyncha. W zespole nie obserwuje się zwiększonego ryzyka występowania nowotworów innych niż rak jelita grubego.
- Rodzinna polipowatość gruczolakowata (FAP)
Rodzinna polipowatość gruczolakowata jest zespołem predyspozycji do nowotworów dziedziczonym autosomalnie dominująco, uwarunkowanym mutacją w genie APC. Zespół charakteryzuje się bardzo licznymi gruczolakami na całej długości jelita grubego oraz cienkiego, a także w żołądku. Gruczolaki predysponują do rozwoju raka jelita grubego, którego ryzyko jest bliskie 100%. Stanowi drugi pod względem częstości występowania zespół predyspozycji do raka jelita grubego, odpowiada za około 1% wszystkich przypadków raka w tej lokalizacji. Polipy są obecne u połowy chorych w wieku 15 lat i u 95% chorych w wieku 35 lat. Liczba polipów może się wahać od kilkuset do kilku tysięcy. Zwykle rak rozwija się około 35. roku życia, choć rzadko bywa obecny przed 20. rokiem życia. Zespołowi rodzinnej polipowatości gruczolakowatej towarzyszą również inne nowotwory złośliwe i łagodne. Należą do nich rak tarczycy, gruczolakorak jelita cienkiego, hepatoblastoma, rak trzustki, rak żołądka, rak nadnerczy i gruczolaki nadnerczy, guzy mózgu (głównie rdzeniak).
- Zespół Peutza-Jeghersa
Zespół Peutza-Jeghersa jest zespołem zwiększonej predyspozycji genetycznej do nowotworów złośliwych dziedziczonym autosomalnie dominująco i uwarunkowanym mutacją genu supresorowego LKB1 (STK11). W zespole Peutza-Jeghersa występują hamartomiczne polipy w przewodzie pokarmowym, melanoza skóry i błon śluzowych głównie okolicy warg ust, jamy ustnej, narządów płciowych, kończyn oraz odbytu. Zwiększona predyspozycja w różnym stopniu dotyczy wzrostu ryzyka zachorowania na raka jelita cienkiego, raka żołądka, raka jelita grubego, raka trzustki, raka przełyku, raka piersi, raka szyjki macicy, raka trzonu macicy, raka jajnika, raka płuca i raka jądra. Ryzyko pojawienia się złośliwego nowotworu przewodu pokarmowego w ciągu życia chorego wynosi 70%, a łącznie z pozostałymi nowotworami 90%. Ryzyko raka jelita grubego w wieku 40 lat wynosi 3%, w wieku 50 lat 5%, w wieku 60 lat 15% i 39% w wieku 70 lat. Zespół może odpowiadać za 0,01% wszystkich przypadków raka jelita grubego.
- Polipowatość młodzieńcza
Polipowatość młodzieńcza jest rzadkim zespołem predyspozycji do nowotworów dziedziczonym autosomalnie dominująco o niepełnej penetracji genu, najczęściej uwarunkowanym mutacjami w genach SMAD4 (MADH4) lub BMPR1A. W zespole występują hamartomiczne polipy najczęściej dotyczące jelita grubego (98% przypadków), ale również żołądka w 14% przypadków, jelita czczego i krętego w 7% i dwunastnicy w 2% przypadków. Ryzyko rozwinięcia raka jelita grubego w wieku 35 lat wynosi 17–22%, a ryzyko rozwoju raka żołądka w ciągu życia wynosi 10–21%.
- Polipowatość związana z mutacją MYH (MAP)
Polipowatość związana z mutacją MYH jest rzadkim zespołem predyspozycji do nowotworów dziedziczonym autosomalnie recesywnie, związanym z mutacją genu MYH naprawiającego DNA. Klinicznie naśladuje późno pojawiający się zespół polipowatości rodzinnej. Zwykle stwierdza się około 100 polipów. Zespół niesie ze sobą 70–80% ryzyko zachorowania na raka jelita grubego, który zwykle pojawia się około 50. roku życia. Prawdopodobnie nowotwory poza jelitem grubym nie są charakterystycznym elementem zespołu, jednak mogą one wystąpić.
Zapobieganie i badania przesiewowe
Profilaktyka raka jelita grubego jest oparta o walkę z modyfikowalnymi czynnikami ryzyka i program badań przesiewowych.
Profilaktyka pierwotna
Profilaktyka pierwotna obejmuje zwalczanie czynników ryzyka choroby. Profilaktyka pierwotna raka jelita grubego jest oparta na wpływie na modyfikowalne czynniki ryzyka. Kluczowa jest zmiana błędów dietetycznych polegających na zbyt wysokim spożyciu czerwonego mięsa i nasyconych kwasów tłuszczowych pochodzących głównie ze zwierzęcych produktów spożywczych oraz zbyt niskim spożyciu warzyw i owoców. Szczególnie smażone i grillowane czerwone mięso jest obarczone sprzyjaniem rozwojowi raka jelita grubego. Zaleca się redukcję spożycia czerwonego mięsa oraz tłuszczów pochodzenia zwierzęcego i zamianę ich na drób, ryby i tłuszcze roślinne. Warzywa i owoce wykazują działanie ochronne w raku jelita grubego i mogą w pewnym stopniu redukować ryzyko rozwoju raka.
Zaleca się zaprzestanie palenia tytoniu, które jest istotnym czynnikiem ryzyka rozwoju raka jelita grubego. Palenie nie tylko zwiększa ryzyko raka jelita grubego, ale również chorób układu krążenia, w tym zawału mięśnia sercowego i innych nowotworów złośliwych, w tym raka płuc, raka sutka, raka trzustki, raka pęcherza moczowego i nowotworów głowy i szyi. Szczególnie istotne jest zniechęcanie do palenia młodzieży i młodych dorosłych oraz zachęcanie do rzucenia palenia, ponieważ spadek ryzyka zachorowania obserwuje się dopiero po wielu latach od zaprzestania palenia tytoniu.
Ważna jest walka z otyłością, cukrzycą i zbyt niską aktywnością fizyczną. Otyłość typu centralnego, błędy dietetyczne, hiperinsulinemia związana z insulinoopornością oraz siedzący tryb życia sprzyjają rozwojowi raka jelita grubego. Zaleca się utrzymanie prawidłowej wagi i regularną aktywność fizyczną.
Profilaktyka wtórna
Profilaktyka wtórna obejmuje wczesne rozpoznawanie zmian przednowotworowych na podstawie badań przesiewowych. Rak jelita grubego rozwija się dość powoli na bazie łagodnych polipów, co daje możliwość wczesnego wykrycia i likwidacji zmian przednowotworowych lub wczesnego wykrycia i skutecznego leczenia niezaawansowanego raka. Podstawowym celem badania przesiewowego jest redukcja śmiertelności z powodu choroby nowotworowej. Badania przesiewowe w raku jelita grubego obejmują badanie na obecność krwi utajonej w kale lub kolonoskopię.
- Strategie badań przesiewowych
W różnych krajach przyjęto różne strategie badań przesiewowych raka jelita grubego. Polegają one na badaniu na obecność krwi utajonej w kale wykonywanym co 1–2 lata lub kolonoskopii wykonywanej co 10 lat. Badanie przesiewowe jest zalecane u chorych powyżej 50. roku życia. W większości krajów Europejskich badaniem przesiewowym jest badanie na obecność krwi utajonej w kale metodą immunochromatograficzną. W Stanach Zjednoczonych, Niemczech, Polsce i Włoszech w ramach badań przesiewowych wykonuje się kolonoskopię. W Polsce program badań przesiewowych obejmuje osoby w wieku 50–65, bez krwawienia z przewodu pokarmowego, biegunki, zaparć, anemii lub utraty masy bez znanej przyczyny w ciągu ostatnich miesięcy, które mogą być wskazaniami do diagnostycznej, a nie przesiewowej kolonoskopii. W przypadku występowania raka u członka rodziny w pierwszym stopniu pokrewieństwa badanie przesiewowe wykonuje się również u osób w wieku 40–49 lat.
- Kolonoskopia
Kolonoskopia jest badaniem endoskopowym umożliwiającym zobrazowanie całej śluzówki jelita grubego i wykonanie niektórych zabiegów, w tym pobranie biopsji i usunięcie polipa. Przesiewowa kolonoskopia powinna obejmować inspekcję całego jelita grubego aż do kątnicy. Kolonoskopia powinna być wykonana z wykonaniem dożylnej sedacji, która redukuje nieprzyjemne odczucia związane z zabiegiem. Konieczne jest dobre przygotowanie do badania poprzez podanie odpowiednich środków przeczyszczających i właściwe nawodnienie. Kolonoskopia pozwala oprócz wczesnego wykrycia raka na zmniejszenie częstości występowania tej choroby poprzez rozpoznawanie i usuwanie polipów, na bazie których może rozwinąć się rak inwazyjny. Wykazano, że usunięcie polipów redukuje częstość występowania raka o 75–90%.
- Badanie na obecność krwi utajonej w kale
Coroczne badanie na obecność krwi utajonej w kale jest jedną z możliwych strategii badań przesiewowych. Badanie pozwala na wykrycie obecności niewidocznej w kale krwi, która może być związana z obecnością krwawiącego guza w przewodzie pokarmowym, ale również innych patologii prowadzących do krwawienia. Stwierdzenie obecności krwi w kale skłania do pogłębienia diagnostyki, przede wszystkim do wykonania kolonoskopii, która może potwierdzić lub wykluczyć chorobę nowotworową. Podstawowym ograniczeniem badania jest konieczność występowania krwawienia z guza. Metaanaliza kilku badań wykazała, że badanie na obecność krwi utajonej w kale co roku lub co dwa lata o 16% zmniejsza śmiertelność na raka jelita grubego.
Badanie na obecność krwi w kale metodą gwajakolową cechuje się jednak stosunkowo niską czułością diagnostyczną dla wykrywania raka jelita grubego sięgającą 25–40% i również niską czułością w wykrywaniu zaawansowanych gruczolaków (16–30%). Konieczne jest pobranie trzech próbek i zastosowanie się do zaleceń niespożywania produktów spożywczych zawierających hemoglobinę. Badanie na obecność krwi w kale metodą gwajakolową daje fałszywe wyniki w przypadku krwawienia do przewodu pokarmowego z innych powodów niż rak.
Metoda immunochromatograficzna jest oparta na wykrywaniu ludzkiej hemoglobiny. Zatem metoda nie wymaga zachowania odpowiedniej diety przed badaniem i jest niewrażliwa na krwawienie z górnej części przewodu pokarmowego, ponieważ hemoglobina ulega tam rozkładowi. Metoda jest też bardziej czuła niż metoda gwajakolowa. Czułość metody immunochromatograficznej w wykrywaniu raka wynosi 60–90%, a dla wykrywania gruczolaków wynosi 30–70%.
Nadzór nad szczególnymi grupami ryzyka
- Zespół Lyncha
Zaleca się przeprowadzanie regularnej kolonoskopii co 1–2 lata od 20–25. roku życia. Badanie przesiewowe w kierunku raka endometrimu i raka jajnika rozpoczyna się 30–35. roku życia i polega na badaniu ginekologicznym, wykonaniu USG i badaniu CA 125. W profilaktyce raka żołądka zaleca się eradykację Helicobacter pylori i gastroskopię co 1–3 lata. Prawdopodobnie ryzyko rozwoju raka zmniejsza przyjmowanie kwasu acetylosalicylowego, choć dawka i długość leczenia nie zostały ustalone. Profilaktyczna kolektomia nie jest zalecana, ale w przypadku pojawienia się raka jelita grubego należy rozważyć rozszerzoną kolektomię ze względu na ryzyko wystąpienia nowotworów synchronicznych i metachronicznych.
- Rodzinny rak jelita grubego typu X
Zaleca się przeprowadzania regularnej kolonoskopii co 3–5 lat zaczynając je 5–10 lat wcześniej niż najwcześniejszy przypadek raka w rodzinie.
- Zespół rodzinnej polipowatości gruczolakowatej
W rodzinach z rozpoznaną mutacją genu APC zaleca się kolonoskopię co 2 lata od 18–20. roku życia. W rodzinach bez rozpoznanej mutacji genu APC wykonuje się sigmoidoskopię lub kolonoskopię co 2 lata aż do 40. roku życia, następnie co 3–5 lat do 50. roku życia i wówczas nadzór może być przerwany jeśli nie stwierdzono polipów. W przypadku wykrycia gruczolaków kolonoskopia jest wykonywana co roku aż do planowej kolektomii.
Badania przesiewowe w kierunku innych nowotworów niż rak jelita grubego są przeprowadzane od momentu rozpoznania polipów lub od 25–30. roku życia. Gastroskopia powinna być przeprowadzana co 5 lat. Niektórzy autorzy sugerują wykonywanie kontrastowego badania radiologicznego lub endoskopii kapsułkowej. Konieczne jest coroczne wykonywanie USG tarczycy i szyjki macicy u kobiet. Zaleca się wykonywanie TK lub MRI jamy brzusznej u chorych z wywiadem guza desmoidalnego. Zaleca się wykonanie profilaktycznej kolektomii z zachowaniem zwieraczy odbytu. Uzupełniająco mogą być stosowane niesteroidowe leki przeciwzapalne: sulindak i celekoksyb.
Chemioprofilaktyka raka jelita grubego
- Niesteroidowe leki przeciwzapalne
Kilka badań wskazuje, że regularne przyjmowanie kwasu acetylosalicylowego (aspiryna) przez pięć lat w dawce 300 mg dziennie zmniejsza ryzyko rozwoju łagodnych gruczolaków i ryzyko rozwoju na ich bazie raka jelita grubego, które jest mniejsze po 10-letnim stosowaniu leków. Związek kwasu acetylosalicylowego z zapobieganiem raka jest mniejszy jeśli jest stosowany w dawce niższej niż 300 mg dziennie. Selektywne inhibitory COX-2 (koksyby) celekoksyb i rofekoksyb zmniejszają ryzyko nawrotu gruczolaków, jednak ich użycie wiąże się ze znacznym wzrostem ryzyka sercowo-naczyniowego. Sulindak, niesteroidowy lek przeciwzapalny, zmniejsza ilość i wielkość polipów w zespole rodzinnej polipowatości gruczolakowatej.
Kwas acetylosalicylowy i inhibitory COX redukują ryzyko zachorowania na raka jelita grubego, jednak ich stosowanie w populacji ogólnej nie jest uzasadnione i jest niezalecane, ze względu na ryzyko niekorzystnego działania w postaci zwiększonego ryzyka udaru mózgu i krwawienia z przewodu pokarmowego w przypadku aspiryny i zwiększonego ryzyka sercowo-naczyniowego w przypadku koksybów, które przeważają nad ewentualnymi korzyściami. W niektórych niewielkich populacjach o szczególnie wysokim ryzyku raka korzyści z takiej profilaktyki przeważają nad ryzykiem związanym z działaniami niepożądanymi.
- Statyny
Wyniki metaanalizy nie potwierdzają by statyny stosowane w leczeniu hipercholesterolemii zmniejszały ryzyko rozwoju raka jelita grubego.
Epidemiologia
Rak jelita grubego jest jednym z najczęściej rozpoznawanych nowotworów. Pod względem zapadalności na świecie u kobiet stanowi drugi po raku piersi nowotwór złośliwy, a u mężczyzn trzeci po raku płuca i raku prostaty. Stanowi aż 10% wszystkich nowotworów złośliwych u ludzi. W 2012 roku na świecie rozpoznano 1 340 000 przypadków raka jelita grubego, co stanowiło około 10% wszystkich przypadków nowotworów złośliwych i 690 000 przypadków zgonów na świecie, co stanowi około 8% zgonów z powodu choroby nowotworowej. W 2012 roku w Europie rozpoznano 450 000 przypadków raka jelita grubego i 215 000 przypadków zgonów. W Stanach Zjednoczonych średnie ryzyko zachorowania w ciągu życia na raka jelita grubego ocenia się na 5% dla mężczyzn i 4,7% dla kobiet.
Zapadalność na świecie jest znacznie zróżnicowana i występują ponad dziesięciokrotne różnice w częstości zachorowań. Większość przypadków występuje w krajach rozwiniętych. Najwyższą zapadalność sięgającą 40 przypadków na 100 000 obserwuje się w Europie Zachodniej, Stanach Zjednoczonych, Australii i Nowej Zelandii, podczas gdy najniższą zapadalność stwierdza się w Azji, Afryce, Ameryce Południowej.
W Europie Zachodniej, Północnej i Stanach Zjednoczonych obserwuje się stabilizację częstości występowania. Z kolei w Europie Środkowej i Wschodniej oraz niektórych krajach azjatyckich obserwuje się wzrost zapadalności na raka jelita grubego, co jest związane ze wzrostem zamożności tych społeczeństw.
Zdecydowana większość (90–95% przypadków) zachorowań pojawia się po 50. roku życia. Średni wiek w momencie rozpoznania wynosi 64 lata. Na świecie częstość występowania raka jelita grubego u kobiet i mężczyzn jest porównywalna, choć choroba częściej dotyczy mężczyzn. U kobiet częściej obserwuje się prawostronne występowanie raka jelita grubego. Kobiety osiągają lepsze przeżycia całkowite niż mężczyźni. Większe ryzyko zachorowania na raka jelita grubego dotyczy osób rasy czarnej.
Polska jest krajem o średniowysokiej częstości zachorowań. Zapadalność u mężczyzn wynosi 30 przypadków na 100 000, a u kobiet 18 przypadków na 100 000. W Polsce w 2010 roku rozpoznano 15600 przypadków raka jelita grubego, z czego 8700 przypadków u mężczyzn i 7100 przypadków u kobiet. Obserwuje się tendencję wzrostową zapadalności i również umieralności na raka jelita grubego. Od 1980 roku stwierdzono czterokrotny wzrost zachorowań u mężczyzn i trzykrotny wzrost u kobiet.
Histopatologia
Raki jelita grubego w klasyfikacji WHO z 2010 roku są dzielone na:
-
gruczolakorak (ang. adenocarcinoma, ICD-O 8140/3),
- śluzowy (ang. mucinous adenocarcinoma, ICD-O 8480/3),
- sygnetowaty (ang. signet ring cell carcinoma, ICD-O 8490/3),
- rdzeniasty (ang. medullary carcinoma, ICD-O 8510/3),
- sitowaty typu czopiastego (ang. cribriform comedo-type adenocarcinoma, ICD-O 8201/3),
- drobnobrodawkowaty (ang. micropapillary carcinoma, ICD-O 8265/3),
- ząbkowany (ang. serrated adenocarcinoma, ICD-O 8213/3),
- rak płaskonabłonkowy (ang. squamous cell carcinoma, ICD-O 8070/3),
- rak gruczołowopłaskonabłonkowy (ang. adenosquamous carcinoma, ICD-O 8560/3),
- rak niezróżnicowany (ang. undifferentiated carcinoma, ICD-O 8020/3),
- rak wrzecionowatokomórkowy (ang. spindle cell carcinoma, ICD-O 8032/3),
-
rak neuroendokrynny o wysokiej złośliwości (ang. high grade neuroendocrine carcinoma, ICD-O 8246/3),
- wielkokomórkowy (ang. large cell, ICD-O 8013/3),
- drobnokomórkowy (ang. small cell, ICD-O 8041/3).
Gruczolakorak stanowi 90–95% wszystkich nowotworów złośliwych jelita grubego u człowieka. Zdecydowana większość guzów jest zlokalizowana w esicy i odbytnicy. Najczęściej jest zlokalizowany w odbytnicy (30–50% przypadków), esicy (15–20%), następnie we wstępnicy (14%), poprzecznicy (9%) i zstępnicy (6%). Obserwuje się wzrost częstości zachorowań na raka położonego po prawej połowie jelita grubego i zmniejszenie częstości zachorowań na raka dystalnej części jelita grubego. U osób poniżej 40. roku życia, u osób starszych oraz u kobiet częściej rozpoznaje się raka prawej połowy jelita grubego. W 3,5% przypadków w momencie rozpoznania stwierdza się drugi synchroniczny rak jelita grubego.
Makroskopowo guzy przyjmują różne formy morfologiczne. Guzy bliższej części okrężnicy wykazują tendencję do egzofitycznego/grzybiastego wzorca wzrostu z tworzeniem dużej polipowatej masy, często z owrzodzeniem. W dalszej części okrężnicy guzy wykazują tendencje do płaskiego, pierścieniowatego wzrostu prowadzącego do zwężenia światła jelita. Brzeg nacieku nowotworowego jest obwałowany. Guzy mogą być uszypułowane lub siedzące.
Makroskopowo rak jelita grubego przyjmuje formy (klasyfikacja endoskopowa):
- postać polipowata – egzofityczna masa wewnątrz światła jelita bez owrzodzenia,
- postać grzybiasta (wrzodziejąco-polipowata) – polipowata masa z wyraźnym owrzodzeniem,
- postać wrzodziejąca – powierzchnia zmiany jest owrzodziała, owrzodzenie sięga poniżej poziomu prawidłowej błony śluzowej,
- postać rozlana (linitis plastica) – rak jednolicie naciekający ścianę jelita, często prowadzący do jego zwężenia.
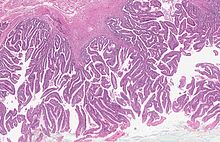
- Gruczolakorak
Typowo gruczolakoraki jelita grubego tworzą średniej wielkości struktury gruczołowe, zmienność wielkości, wzoru oraz ilość zrębu jest umiarkowana. Atypowe komórki wysokozróżnicowanego gruczolakoraka są walcowate, a w miarę spadku stopnia zróżnicowania komórki przyjmują kształt sześcienny. W świetle gruczołów mogą występować mucyny, komórki albo same jądra komórkowe. Figury mitotyczne zwykle są liczne.
Rak dobrze zróżnicowany w 95% zawiera gruczoły (stopień złośliwości histologicznej G1), rak średnio zróżnicowany zawiera 50–95% struktury gruczołowe (stopień złośliwości G2), rak słabo zróżnicowany zawiera 50–5% struktur gruczołowych (stopień złośliwości G3), a rak niezróżnicowany poniżej 5% struktur gruczołowych (stopień złośliwości G4). W systemie dwustopniowym niski stopień złośliwości obejmuje stopnie G1 i G2, a wysoki stopień złośliwości G3 i G4. W 70% przypadków gruczolakorak jelita grubego wykazuje średni stopień zróżnicowania, dobrze zróżnicowane gruczolaki stanowią 10% guzów, a nisko zróżnicowane 20% przypadków.
- Gruczolakorak śluzowy
Jest to podtyp gruczolakoraka o znacznej zawartości mucyn, których zawartość przekracza 50%. Stanowi około 10% wszystkich raków jelita grubego u ludzi. Makroskopowo jest miękkim, galaretowatym guzem. Mikroskopowo nowotwór zawiera duże struktury gruczołowe z dużymi pozakomórkowymi polami mucyny. Mogą występować pasma komórek lub pojedyncze komórki. Często stwierdza się niestabilność mikrosatelitarną. Może towarzyszyć zespołowi Lyncha.
- Gruczolakorak sygnetowaty
Jest to rzadki podtyp gruczolakoraka, stanowi tylko poniżej 1% przypadków raka jelita grubego u ludzi. 30% przypadków gruczolakoraka sygnetowatego dotyczy chorych na wrzodziejące zapalenie jelita grubego. Nowotwór zwykle wykazuje wrzodziejący lub naciekający typ wzrostu. Gruczolakorak sygnetowaty zawiera przynajmniej 50% komórek sygnetowatych, które cechują się obecnością dużej wakuoli zawierającej mucyny wypierającej jądro komórkowe na obwód komórki. Komórki mogą wykazywać rozlany, naciekający wzorzec wzrostu z minimalną ilością zewnątrzkomórkowej mucyny lub być obecne w dużych zewnątrzkomórkowych polach mucyny. Jest to nowotwór o słabym zróżnicowaniu i wysokim stopniu złośliwości.
- Gruczolakorak rdzeniasty
Jest to bardzo rzadki podtyp gruczolakoraka. Nowotwór wykazuje lity wzór utkania, jest zbudowany ze sznurów okrągłych komórek z pęcherzykowatym jądrem, wyraźnymi jąderkami i obfitą cytoplazmą. Zmienność wielkości i kształtu jąder komórkowych jest niewielka. Charakterystyczny jest naciek limfocytarny. Jest mocno związany z niestabilnością mikrosatelitarną. Mimo niskiego zróżnicowania zwykle charakteryzuje go dobre rokowanie.
- Rak gruczołowopłaskonabłonkowy
Jest to bardzo rzadki typ raka wykazujący cechy gruczolakoraka i raka płaskonabłonkowego, stanowi około 0,06% przypadków raka jelita grubego u ludzi. W obrębie guza mogą występować odrębne obszary z występowaniem przewagi gruczolakoraka lub raka płaskonabłonkowego albo oba typy są wymieszane.
- Rak płaskonabłonkowy
Czysty rak płaskonabłonkowy jest bardzo rzadką postacią raka jelita grubego. W nowotworze nie mogą występować ogniska raka gruczołowego i musi zostać wykluczony rak odbytu.
- Rak wrzecionowatokomórkowy
Jest to bardzo rzadka postać raka jelita grubego. Cechuje się obecnością elementów nabłonkowych i mezynchymalnych.
- Rak niezróżnicowany
Jest to rzadki podtyp raka jelita grubego wykazujący cechy różnicowania w kierunku raka, ale bez tworzenia struktur gruczołowych ani innych dowodów na różnicowanie. Wykazuje znaczną zmienność cech histologicznych. Nowotwór wykazuje znaczną komórkowość i dużą skłonność do rozległej martwicy.
Zmiany przednowotworowe
Zmiany przednowotworowe są ściśle związane z karcynogenezą raka jelita grubego. Istnieją dwie główne ścieżki karcynogenezy prowadzące do raka jelita grubego: ścieżka związana z niestabilnością chromosomalną związaną z mutacją genu APC oraz ścieżka związana z mutacją genów mutatorowych, głównie hMSH2 i hMLH1, prowadząca do niestabilności genetycznej. Zmiany przednowotworowe są ściśle powiązane z tymi ścieżkami karcynogenezy. Gruczolak jest łagodną zmianą nabłonkową powiązaną z mutacją APC będącą obserwowalnym prekursorem raka inwazyjnego. Sekwencja gruczolak-rak jest główną drogą prowadzącą do raka, obserwowaną w 85% przypadków raka jelita grubego u ludzi. Z kolei zmiany ząbkowane są powiązane ze ścieżką mutacji genów mutatorowych i około 15% przypadków raka jelita grubego jest następstwem tej drogi karcynogenezy. Makroskopowo łagodne gruczolaki mogą tworzyć uniesione zmiany nazywane polipem lub zmiany nieuniesione (płaskie).
Zmiany przednowotworowe są stwierdzane u około 25% osób z populacji ogólnej poddawanych kolonoskopii. Częstość występowania rośnie wraz z wiekiem i u osób po 80. roku życia łagodne zmiany przednowotworowe mogą być obecne u 85% osób poddanych kolonoskopii. Dwie trzecie polipów jest umiejscowiona po lewej połowie jelita grubego. U 2% bezobjawowych osób poddanych kolonoskopii stwierdza się zmiany o wysokim stopniu neoplazji i u 1% badanych rozpoznaje się raka inwazyjnego.
Niezłośliwe zmiany nabłonkowe są klasyfikowane jako:
- gruczolaki konwencjonalne,
- gruczolak cewkowy,
- gruczolak cewkowo-kosmkowy,
- gruczolak kosmkowy,
- zmiany ząbkowane,
- polip hiperplastyczny,
- gruczolak/polip ząbkowany siedzący,
- tradycyjny gruczolak ząbkowany,
- zmiany mieszane.
Ogniska nieprawidłowych krypt
Ognisko nieprawidłowych krypt (ang. aberrant crypt focus) jest najwcześniejszym morfologicznym prekursorem neoplazji śródnabłonkowej i poprzedza rozwój polipów nabłonkowych. Zmiany te nie są widoczne w rutynowej endoskopii. W badaniu mikroskopowym lub endoskopii powiększającej są widoczne jako kilka do dwustu powiększonych krypt o poszerzonym ujściu, otoczonych pogrubiałym nabłonkiem i o zmniejszonej ilości śluzu. Progresja ognisk nieprawidłowych krypt do gruczolaka jest elementem karcynogenezy.
Gruczolaki jelita grubego
Gruczolaki jelita grubego są to łagodne zmiany nowotworowe z zaznaczonymi cechami neoplazji śródnabłonkowej. W obrazie histopatologicznym występują zmiany cytologiczne i architektoniczne. Zmiany cytologiczne obejmują wydłużenie i nawarstwienie jąder komórkowych, powiększenie jąder komórkowych, hiperchromazja i heterochromazja chromatyny, utratę polarności komórki, zwiększenie stosunku jądrowo-cytoplazmatycznego oraz obecność licznych figur podziału. Na zmiany architektoniczne składają się rozrost i stłoczenie krypt oraz wytworzenie kosmków. Makroskopowo gruczolaki mogą być zmianami uniesionymi, płaskimi lub zapadniętymi (wrzód).
Mikroskopowo na podstawie udziału elementu kosmkowego gruczolaki klasyfikuje się jako gruczolaki cewkowe (ang. tubular adenoma), gruczolaki cewkowo-kosmkowe (ang. tubulo-villous adenoma) i gruczolaki kosmkowe (ang. villous adenoma). Gruczolak cewkowy musi być zbudowany przynajmniej w 80% z elementów cewkowych, a gruczolak kosmkowy w przynajmniej 80% z elementów kosmkowych. Gruczolaki bez takiej przewagi jednej grupy elementów klasyfikowane są jako gruczolaki cewkowo-kosmkowe.
Gruczolak cewkowy jest zbudowany z przylegających, regularnych lub rozgałęzionych cew gruczołowych. Gruczolak kosmkowy jest zwykle zmianą siedzącą o kosmatej powierzchni zbudowanej z wydłużonych struktur przekraczających dwukrotnie grubość prawidłowej błony śluzowej.
Ze względu na nasilenie stopnia zmian cytologicznych i architektonicznych gruczolaków wyróżnia się neoplazję (dysplazja) niskiego i wysokiego stopnia. Neoplazja wysokiego stopnia cytologicznie cechuje się obecnością nasilonej atypii z obecnością zaokrąglonych jąder komórkowych, pogrubieniem chromatyny, obecnością wyraźnych jąderek i utratą polarności komórki. W architekturze zmiany stwierdza się stłoczenie struktur gruczołowych z wytworzeniem struktur sitowatych.
Największe ryzyko transformacji do raka inwazyjnego charakteryzuje zmiany z obecną neoplazją wysokiego stopnia, zmiany o wielkości >10 mm lub obecność >20% elementu kosmkowego (polipy cewkowo-kosmkowe i kosmkowe).
Zmiany ząbkowane
Zmiany ząbkowane stanowią heterogenną grupę zmian wykazujących ząbkowaną architekturę przekroju gruczołu, związaną z nadmiernym pofałdowaniem nadmiernie rozrośniętego nabłonka gruczołowego.
- Polip hiperplastyczny
Polipy hiperplastyczne stanowią zdecydowaną większość zmian ząbkowanych. Są to niewielkie zmiany o wielkości około 5 mm, rzadko przekraczające wielkość 10 mm. Zwykle są położone w lewej połowie jelita grubego. Makroskopowo polip hiperplastyczny jest trudny do odróżnienia od gruczolaków. Mikroskopowo budują go podłużne, proste krypty zawierające w świetle ząbkowanie tworzone przez nadmiernie rozrośnięte komórki nabłonka. Strefa proliferacyjna jest ograniczona do części podstawnej krypt, która pozostaje wąska i nie zawiera ząbkowania. Nie stwierdza się dysplazji.
- Gruczolak ząbkowany siedzący i polip ząbkowany siedzący
Pojęcia gruczolak ząbkowany siedzący i polip ząbkowany siedzący są stosowane zamiennie. Stanowią około 1–9% polipowatych zmian jelita grubego. Mikroskopowo cechuje się obecnością cech dysplazji. Występuje nadmierne ząbkowanie, które występuje na całej długości krypty, poszerzenie krypty i obecność rozgałęzień krypt. W przeciwieństwie do polipów hiperplastycznych gruczolak/polip ząbkowany siedzący stanowi zmianę przednowotworową.
- Tradycyjny gruczolak ząbkowany
Tradycyjny gruczolak ząbkowany jest stosunkowo rzadką zmianą, stanowi około 1% zmian polipowatych jelita grubego. Mikroskopowo również należy do zmian ząbkowanych, ale prezentuje obecność cech utkania cewko-kosmkowego lub kosmkowego. Charakteryzuje się neoplazją nabłonka niskiego stopnia, rzadziej wysokiego stopnia, z ząbkowaniem nabłonka. Występują wydłużone jądra komórkowe, pseudonawartwienia jąder i eozynofilna cytoplazma. Typowa jest obecność krypt ektopowych. Zwykle występują po lewej połowie jelita grubego.
Patogeneza
Karcynogeneza raka jelita grubego nie jest całkowicie poznana. Istotą tego procesu jest powstanie kaskady zmian cytogenetycznych i epigenetycznych w rezultacie długiej ekspozycji na środowiskowe i wrodzone czynniki ryzyka raka zaburzające homeostazę komórkową. Karcynogeneza jest procesem wieloetapowym. Pojedyncza mutacja nie jest wystarczająca do rozwoju raka, a choroba jest efektem wielu kolejnych mutacji. Kolejne mutacje pojawiają się w różnym czasie w różnych miejscach materiału genetycznego. Mutacje prowadzą do wyłączenia niektórych genów lub przeciwnie do wzmocnienia ich transkrypcji.
Karcynogeneza raka jelita grubego może być podzielona na inicjację, promocję i progresję. W najwcześniejszym etapie inicjacji dochodzi do pierwszej zmiany genetycznej. Jeśli mutacja wykazuje biologiczne znaczenie i komórka jest zdolna do przetrwania może otwierać to drogę do dalszych zmian genetycznych w etapie progresji. Zmiany genetyczne i epigenetyczne prowadzą do powstania klonu komórek o przewadze wzrostowej nad innymi komórkami. Dochodzi do gromadzenia komórek, które nabywają kolejne mutacje. W miarę kolejnych mutacji genetycznych komórki nabywają kolejnych cech komórek nowotworowych, w tym zdolność do inwazji, migracji i przerzutowania. Proces karcynogenezy jest rozciągnięty w czasie, od pierwszej mutacji do rozwoju raka inwazyjnego mija około 10–20 lat i około 5–10 lat od pojawienia się polipa do raka inwazyjnego.
Istnieją dwie główne ścieżki prowadzące do raka jelita grubego. Najczęstszą z nich jest szlak gruczolak–rak, w którym obserwuje się progresję zmian morfologicznych od łagodnego gruczolaka, który następnie ulega progresji przez neoplazję wysokiego stopnia do raka inwazyjnego. Karcynogenezę w tym szlaku rozpoczyna mutacja genu supresorowego APC, a następnie pojawiają się mutacje protoonkogenów i innych genów supresorowych ostatecznie doprowadzających do niestabilności chromosomalnej. W mniej częstym modelu zmian ząbkowanych pierwszym zjawiskiem jest wyłączenie genów naprawiających materiał genetyczny, co prowadzi do zjawiska niestabilności mikrosatelitarnej. Dopiero w kolejnym etapie dochodzi do aktywacji onkogenów.
Rola czynników środowiskowych
- Czynniki dietetyczne
Nieprawidłowa dieta odgrywa ważną rolę w karcynogenezie raka jelita grubego. Do transformacji nowotworowej dochodzi w następstwie długotrwałej ekspozycji na czynniki rakotwórcze. Nadmierne spożywanie czerwonego mięsa jest związane ze zwiększonym ryzykiem rozwoju raka jelita grubego. Prawdopodobnie karcynogeneza związana z czerwonym mięsem jest efektem powstawania związków N-nitrozowych i metabolizmu zwierzęcego hemu.
Wiele związków N-nitrozowych, w tym nitrozoaminy i nitrozoamidy jest związkami rakotwórczymi w karcynogenezie licznych nowotworów. Mogą one reagować z materiałem genetycznym komórki sprzyjając powstawaniu mutacji genetycznych. Obecność związków N-nitrozowych stwierdzono w przetworzonym mięsie, wędzonych rybach i serze oraz piwie.
Związki N-nitrozowe w znacznej części powstają endogennie w rezultacie nadmiernej ekspozycji na czerwone mięso. Azotany, obecne w żywności jako środki konserwujące, w wyniku metabolizmu obecnych w przewodzie pokarmowym bakterii ulegają redukcji do azotynów, które mogą reagować z aminami i amidami dając rakotwórcze związki N-nitrozowe. Istnieje zależność dawki czerwonego mięsa i ilości endogennych związków N-nitrozowych, ale nie stwierdzono jej dla białego mięsa. Różnica tłumaczona jest większą zawartością hemu w czerwonym mięsie niż w białym mięsie. Hem katalizuje reakcje powstawania związków N-nitrozowych niezależnie od wytwarzania tych związków przez bakterie. Hem może wykazywać działanie rakotwórcze poprzez wywoływanie uszkodzenia nabłonka i stymulacji do jego naprawy oraz peroksydację tłuszczów i wytwarzanie lipoperoksydów.
Prawdopodobnie w patogenezie raka jelita grubego pewną rolę pełnią policykliczne węglowodory aromatyczne i heterocykliczne aminy aromatyczne. Heterocykliczne aminy aromatyczne powstają podczas obróbki mięsa w wysokiej temperaturze, w tym podczas smażenia, pieczenia i grillowania. Z kolei głównym źródłem policyklicznych węglowodorów aromatycznych są gotowane, wędzone i grillowane mięso i ryby. Ryzyko raka jelita grubego jest bardziej związane ze sposobem gotowania mięsa niż samym przyjmowaniem wielopierścieniowych węglowodorów aromatycznych i heterocyklicznych amin.
Wysokie spożycie tłuszczów wpływa na karcynogenezę prawdopodobnie poprzez zwiększenie wydzielania żółci, która w przewodzie pokarmowym przy udziale bakterii ulega przemianie do wtórnych kwasów żółciowych, które promują karcynogenezę.
- Nieswoiste zapalenia jelit
Karcynogeneza w nieswoistych zapaleniach jelit jest związana z nasileniem stresu oksydacyjnego, który przyczynia się do uszkodzenia DNA, oraz wpływu hamującego apoptozę i nasilającego przeżycie komórki, a także utworzenia mikrośrodowiska promującego wzrost, migrację komórek oraz neoangiogenezę. Przewlekłe zapalenie nasila wymianę komórek błony śluzowej jelita grubego, a proces jest szczególnie nasilony w miejscach aktywnego zapalenia. Prawdopodobnie cytokiny i czynniki wzrostu związane z zapaleniem mogą stymulować karcynogenezę. TNF-α może powodować uszkodzenie DNA poprzez generację stresu oksydacyjnego. Czynnik NF-κB reguluje ekspresje cytokin prozapalnych i nasilenie poziomu reakcji zapalnej. Niektóre geny kontrolowane przez ten czynnik transkrypcyjny wykazują działanie hamujące apoptozę, zwiększające przeżycie komórki i regulujące różnicowanie się komórki.
- Palenie tytoniu
Palenie tytoniu dostarcza wiele substancji rakotwórczych, w tym wielopierścieniowe węglowodory aromatyczne, aminy aromatyczne, nitrozoaminy i aminy heterocykliczne, które ulegają metabolizmowi do związków zdolnych do połączenia z DNA, co wywołuje naprawę DNA, w tym poprzez wycięcie. Niektóre karcynogeny obecne w dymie tytoniowym (NNK: 4-(metylonitrozoamino)-1-(3-pirydylo)-1-butanon) wykazują powinowactwo do receptorów nikotynowych ostatecznie wpływając na powstawanie wolnych rodników tlenowych i stresu oksydacyjnego. Z kolei stymulacja receptorów β-adrenergicznych wywołuje szereg reakcji metabolicznych i immunomodulujących.
Szlak gruczolak–rak
Jest to główna sekwencja mutacji prowadząca do raka jelita grubego, dotyczy ona 80% przypadków sporadycznego raka i wszystkie przypadki rodzinnej polipowatości gruczolakowatej. W tym modelu sekwencja odpowiednich zmian morfologicznych z powiązanymi mutacjami prowadzi ostatecznie do raka. Akumulacja zmian cytogenetycznych dających przewagę wzrostową nad innymi komórkami prowadzi do progresji zmiany stopnia neoplazji (dysplazji) od gruczolaka do raka inwazyjnego. Sekwencja zmian jest inicjowana przez mutację genu APC, następnie pojawiają się mutacje KRAS (k-RAS), p53 i DCC. Ważną rolę pełnią mutacje genów naprawiających DNA: MLH1, MSH2 i MSH6. Mutacja APC za pośrednictwem szlaku Wnt/β-katenina oraz innych genów supresorowych prowadzi do zaburzenia kontroli apoptozy i kontroli cyklu komórkowego, co napędza proliferację komórek nowotworowych. Ostatecznie mutacje genów supresorowych, onkogenów i genów naprawiających DNA (mutatorowych) prowadzą do utraty stabilności genetycznej komórki, co umożliwia progresję zmiany do raka.
Szlak zmian ząbkowanych
Szlak zmian ząbkowanych prowadzi do raka poprzez mechanizm zaburzenia genów mutatorowych odpowiedzialnych za naprawę materiału genetycznego komórki, co powoduje niestabilność mikrosatelitarną (MSI). Pierwszymi mutacjami w szlaku zmian ząbkowanych są mutacje protoonkogenów KRAS lub BRAF. Zarówno mutacje KRAS, jak i BRAF są odpowiedzialne za aktywacje szlaku MAPK. Wywołuje to niekontrolowaną proliferację komórek, zwiększenie ich zdolności do przeżycia (unikanie apoptozy) i zdolność do migracji komórki. Kolejną zmianą jest powstanie niestabilności mikrosatelitarnej spowodowanej wyłączeniem genów mutatorowych. Prowadzi to do wrażliwości na akumulację zmian genetycznych w genach zlokalizowanych w regionach mikrosatelitarnych. W zmianach ząbkowanych często obserwuje się fenotyp metylatora wysp CpG (ang. CpG island methylator phenotype, CIMP). Metylacja wysp CpG hamuje ekspresję wielu genów, w tym genów supresorowych takich jak MLH1.
Podłoże cytogenetyczne karcynogenezy raka jelita grubego
- APC i szlak Wnt/β-katenina
Gen APC pełni kluczową rolę w karcynogenezie raka jelita grubego. Jego mutacja determinuje wejście na szlak gruczolak–rak, którego rozwój bez tej mutacji jest mało prawdopodobny. Mutacja genu APC lub mutacja genu β-kateniny jest stwierdzana w 80–90% przypadków tego raka, co sugeruje, że jest to wczesnym zdarzeniem w karcynogenezie raka jelita grubego.
Gen APC jest genem supresorowym blokującym przejście z fazy G1 do fazy S cyklu komórkowego. Główną funkcją białka APC jest regulacja szlaku Wnt/β-katenina. Szlak Wnt/β-katenina uczestniczy w regulacji proliferacji, apoptozy i różnicowania się komórki. W prawidłowych warunkach APC reguluje szlak Wnt poprzez wiązanie się z β-kateniną i obniżając jej stężenie. W przypadku wystąpienia mutacji białko APC nie posiada zdolności z wiązania β-kateniny i stężenie niezwiązanej β-kateniny wzrasta, co pozwala jej wejść do jądra komórkowego i stale aktywować geny odpowiedzialne za podział komórki, co nasila proliferację komórki i upośledza jej różnicowanie. β-katenina jest odpowiedzialna za migrację komórek. Jej nagromadzenie się w wyniku mutacji genu APC zaburza migrację komórek w kierunku powierzchni błony śluzowej, gdzie po kilku dniach uległaby usunięciu. W rezultacie akumulacja niezróżnicowanych komórek w kryptach jelitowych prowadzi do tworzenia się polipów. Białko APC za pośrednictwem β-kateniny i E-kadheryny kontroluje adhezje komórek oraz migrację komórek poprzez wpływ na mikrotubule. Białko APC poprzez oddziaływanie na aktynę wpływa na cytoszkielet.
- p53
p53 jest ważnym genem supresorowym i pełni istotną rolę w utrzymaniu stabilności genomu. W przypadku obecności błędów podczas replikacji białko p53 posiada zdolność zatrzymania cyklu komórkowego i wpływa na naprawę materiału genetycznego. Gdy uszkodzenia nie udaje się naprawić kieruje komórkę na szlak apoptozy.
p53 może wywołać apoptozę drogą wewnątrzpochodną i zewnątrzpochodną za pośrednictwem Fas. p53 posiada zdolność do wywołania ekspresji białek Bax, Noxa i PUMA, które obniżają stężenie antyapoptycznego białka Bcl-2, które ma za zadanie obniżać stężenie cytochromu C AIF. Uwolniony cytochrom C aktywuje kaspazy, które kontrolują szlak apoptozy. p53 reguluje w górę ekspresję Fas i DR5 (TRAIL-R2), które mogą wywołać apoptozę drogą zewnątrzpochodną. p53 w przypadku rozpoznania uszkodzenia DNA promuje powstawanie białka p21, które wiąże kompleks CDK4/CDK6, CDK2 i CDK1, co ostatecznie blokuje różne geny i zatrzymuje cykl komórkowy.
Mutacja powodująca unieczynnienie genu p53 jest kluczowym etapem w karcynogenezie raka jelita grubego. Odgrywa ważną rolę w przejściu gruczolaka do raka. Mutacja p53 jest stwierdzana w 34% przypadków raka w prawej połowie jelita grubego i 45% przypadków raka po lewej połowie okrężnicy.
- DCC (utrata heterozygotyczności 18q)
W zaawansowanym raku jelita grubego często dochodzi do utraty jednej kopii genów w regionie 18q21 zawierającego gen DCC. W 70% przypadków raka jelita grubego stwierdza się utratę heterozygotyczności obejmującą region genu DCC. Zwykle druga kopia genu jest dotknięta mutacją.
Gen DCC koduje przezbłonowe białko DCC wykazujące właściwości antyonkogenu. DCC blokuje wzrost komórki w przypadku nieobecności ligandu NTN1 (netrin-1), który jest produkowany w kryptach jelitowych i odpowiada za prawidłową regulację wzrostu, różnicowania się i migracji komórek. W przypadku nieobecności ligandu, DCC indukuje aktywacje kaspazy 9 oraz kaspazy 3 prowadząc do apoptozy. Z drugiej strony, w przypadku konstytutywnej aktywacji NTN1, DCC może promować wzrost komórek nowotworowych. Mutacja genu DCC powoduje brak wiązania z NTN1 i nieprawidłowe nadmierne przeżycie komórek nowotworowych.
- EGFR
Receptor naskórkowego czynnika wzrostu (EGFR) jest przezbłonową glikoproteiną o aktywności kinazy tyrozynowej. Głównym ligandami są naskórkowy czynnik wzrostu (EGF) i TGF-α, który powoduje dimeryzację receptora i transdukcję sygnału poprzez aktywacje szlaków MAPK/ERK i PI3K/AKT/mTOR. Zwiększa to zdolność do proliferacji, chroni komórki przed apoptozą, ułatwia migrację komórek i promuje angiogenezę. Zwiększoną ekspresję EGFR stwierdza się w 25–80% przypadków raka jelita grubego.
- KRAS
Białko KRAS (k-RAS) jest protoonkogenem, należy do nadrodziny białek RAS. Białko ma za zadanie transdukcję sygnału wzrostowego, głównie z układu EGFR. Mutacja onkogenu KRAS występuje w 30–50% przypadków raka jelita grubego.
KRAS jest niewielką GTP-azą odpowiadającą za rozkład GTP do GDP. Aktywacja KRAS jest promowana przez białka GEF (guanine nucleotide exchange factor), a inaktywacji pośredniczy GAP (GTPase-activating proteins). Zaktywowane białko KRAS poprzez białka pośredniczące Ras, RAF i MEK wpływa na szlaki MAPK/ERK i PI3K/AKT/mTOR.
Mutacja aktywująca KRAS zaburza interakcje KRAS z hamującym jej działanie GAP, co doprowadza do konstytutywnej aktywności KRAS i stałego pobudzania zależnych od nich szlaków. Prowadzi to do stymulacji wzrostu, proliferacji, oporności na apoptozę.
- BRAF
BRAF jest kinazą seroninową-treoninową aktywującą kinazy MAP/ERK należącą do rodziny kinaz RAF. Gen BRAF jest zaliczany do protoonkogenów. Gen wpływa na proliferację komórek, dojrzewanie i apoptozę. Mutacja aktywująca BRAF jest stwierdzana w 10% przypadków raka jelita grubego, w 90% dotyczy ona kodonu V600E. W wyniku mutacji dochodzi do konstytutywnej aktywacji BRAF, co prowadzi do promowania nadmiernej proliferacji komórek niezależnej od czynników wzrostowych i oporności komórek na apoptozę.
- Geny mutatorowe (MMR) i niestabilność mikrosatelitarna (MSI)
Geny mutatorowe kodują białka odpowiedzialne za korekcję błędów powstających spontanicznie podczas replikacji materiału genetycznego. Korekcja ta polega na usuwaniu źle sparowanych nukleotydów lub powstających pętli (insertion-deletion loop, IDL). Pętle IDL powstają w wyniku poślizgu polimerazy DNA podczas replikacji odcinków DNA z powtarzającymi się sekwencjami nukleotydów, w tym regionów mikrosatelitarnych. Jeśli białko naprawcze (np. kodowane przez gen mutatorowy) nie usunie błędnie wstawionego nukleotydu mutacja może się utrwalić, jeśli pętla IDL nie zostanie usunięta, może dojść do przesunięcia ramki odczytu. Łatwym do zdiagnozowania efektem dysfunkcji genów mutatorowych jest wydłużanie lub skracanie regionu mikrosatelitów, określane jako niestabilność mikrosatelitarna. Niestabilność mikrosatelitarna wysokiego stopnia (MSI-H) jest definiowana jako obecność niestabilności ≥30% badanych markerów, niestabilność mikrosatelitarna niskiego stopnia (MSI-L) definiuje się jako obecność niestabilności w 10–29% badanych markerach.
Do genów mutatorowych należą MLH1, MSH2, MSH6 i PMS2. Wyłączenie genów mutatorowych odbywa się za pośrednictwem metylacji wysp CpG lub mutacji punktowych poszczególnych genów. W sporadycznym raku jelita grubego najczęściej dochodzi do wyłączenia genów MLH1 i PMS2. MLH1 zwykle jest wyłączany za pomocą hipermetylacji promotora genu. Niestabilność mikrosatelitarną stwierdza się w 10–20% przypadków raka jelita grubego.
- VEGF
Czynnik wzrostu śródbłonka naczyniowego (VEGF) jest białkiem sygnalizacyjnym odpowiadającym za angiogenezę. Jest najważniejszym czynnikiem proangiogenetycznym w raku jelita grubego. Nadekspresja VEGF jest obserwowana w 50–60% przypadków raka jelita grubego.
Wraz z rozwojem guza jego masa oraz aktywność metaboliczna przewyższają możliwości zaopatrzenia go w krew przez dotychczasowe unaczynienie i rozwija się niedokrwienie i niedotlenienie guza. W konsekwencji obniżenia ciśnienia parcjalnego tlenu wydzielany jest HIF-1, który jest czynnikiem transkrypcyjnym przyczyniającym się do ekspresji VEGF. Czynnik HIF-1 współpracuje z IL-6 i TGF-β w ekspresji proangiogennej VEGF. Wydzielanie VEFF jest również stymulowane przez onkogen KRAS. VEGF bezpośrednio promuje tworzenie nowych naczyń krwionośnych. VEGF jest kluczowym czynnikiem sprzyjającym progresji nowotworu.
Przebieg naturalny choroby
Większość przypadków raka jelita grubego rozwija się na bazie łagodnych zmian obserwowanych makroskopowo jako polipy, które wykazują różnice pod względem budowy histopatologicznej i niesionego ryzyka rozwoju raka. Typ zmiany przednowotworowej jest odzwierciedleniem różnych szlaków karcynogenezy. Najważniejszą zmianą przednowotworową jest gruczolak. Zapoczątkowuje on szlak gruczolak–rak i na jego bazie rozwija się 80% przypadków raka. Część raków powstaje na bazie zmian ząbkowanych, które również mogą tworzyć polipy. Przejście z łagodnej zmiany do raka jest procesem wieloetapowym. Proces karcynogenezy od pierwszej mutacji do powstania raka trwa około 10–20 lat. Tylko część gruczolaków ulega progresji do raka. Szacuje się, że łączne ryzyko powstania raka na bazie gruczolaka większego niż 1 cm po 5 latach wynosi 2,5%, po 10 latach 8% i po 20 latach 25%. Rak początkowo dotyczy wyłącznie błony śluzowej, później dochodzi do inwazji warstwy mięśniowej. Rak na wczesnym etapie rozwoju rośnie powoli, ale po inwazji warstwy podśluzowej szybkość wzrostu przyspiesza.
Miejscowo rak szerzy się poprzecznie poprzez kolejne coraz głębsze warstwy jelita oraz podłużnie w obrębie jednej z warstw narządu. Szerzenie się podłużne wzdłuż długości jelita rzadko daje ogniska raka dalsze niż 2 cm od guza pierwotnego. Zaawansowany rak okrężnicy po spenetrowaniu surowicówki może szerzyć się poprzecznie na tkanki okołojelitowe i sąsiednie narządy. Rak w obrębie kątnicy i esicy może naciekać jajniki, jajowody, macicę i jelito cienkie. Rak poprzecznicy, zgięcia wątrobowego i śledzionowego może naciekać dwunastnicę, żołądek, trzustkę i śledzionę. Przednia ściana jamy brzusznej jest częściej zajęta w guzach położonych w wewnątrzotrzewnowych częściach jelita grubego, tylna ściana jest częściej zajęta w guzach jelita grubego w częściach pozaotrzewnowych. Rak zlokalizowany w odbytnicy może szerzyć się na tkanki okołoodbytnicze i naciekać sąsiednie narządy w tym pęcherz moczowy i pochwę.
W późniejszym etapie nowotwór szerzy się za pośrednictwem naczyń chłonnych i krwionośnych dając przerzuty węzłowe i przerzuty odległe. Przerzuty drogą limfatyczną w okrężnicy zwykle nie pojawiają się do czasu inwazji do przydanki. Penetracja przez nowotwór żył spływających do żyły wrotnej lub żyły głównej dolnej skutkuje pojawieniem się przerzutów odległych drogą krwionośną. Możliwy jest naciek wzdłuż nerwów.
Przerzuty odległe zwykle pojawiają się w bardziej zaawansowanych stadiach choroby, jednak zdarza się ich obecność już we wczesnym etapie choroby. Przerzuty, w związku z unaczynieniem wrotnym jelit, najczęściej lokalizują się w wątrobie. Najważniejszą pozawątrobową lokalizacją jest płuco, a następnie mózg i kości. Przerzuty do lokalizacji pozawątrobowych częściej występują w raku odbytnicy niż okrężnicy, co jest związane z podwójnym unaczynieniem żylnym odbytnicy. Obecność przerzutów w płucach wiąże się z większym ryzykiem stwierdzenia przerzutów w kościach i mózgu. Przerzuty odległe są stwierdzane u około 35% chorych w momencie rozpoznania.
Większość guzów jest zlokalizowana w esicy i odbytnicy. Guzy zlokalizowane w kątnicy i wstępnicy zwykle osiągają większe rozmiary niż guzy w pozostałych częściach jelita grubego. Guzy zlokalizowane w esicy i odbytnicy wykazują większą tendencję do zamykania światła jelita grubego i wywoływania niedrożności. Z guzami po stronie prawej częściej współwystępują guzy metachroniczne.
U 7–30% chorych w następstwie wzrostu guza lub obecności przerzutów dochodzi do przepuszczającej lub całkowitej niedrożności mechanicznej jelit. U około 2,5–10% przypadków w efekcie wzrostu guza może dojść do perforacji jelita grubego. Perforacja prowadzi do powstania rozlanego zapalenia otrzewnej lub ropnia wewnątrzotrzewnowego. Perforacja może być następstwem niedrożności jelit.
Rozpoznanie choroby
Podstawowym badaniem pozwalającym rozpoznać raka jelita grubego jest kolonoskopia. Badanie umożliwia uwidocznienie guza oraz pobranie próbki do badania histopatologicznego. Wirtualna kolonoskopia TK lub MRI, endoskopia kapsułkowa oraz radiologiczne badanie dwukontrastowe pełnią pomocniczą rolę w rozpoznaniu i w tych badaniach stwierdzenie podejrzanej zmiany wymaga weryfikacji kolonoskopowej. W ocenie zaawansowania stosuje się tomografię komputerową, rezonans magnetyczny, ultrasonografię endoskopową oraz pozytonową tomografię emisyjną.
Endoskopia
Endoskopia jest podstawową metodą wykrywania raka jelita grubego. Obejmuje ona rektosigmoidoskopię oraz kolonoskopię. Kolonoskopia umożliwia uwidocznienie śluzówki całego jelita grubego, a rektosigmoidoskopia ze względu na zasięg badania może wykryć tylko jedną trzecią zmian i wymaga późniejszej oceny pozostałej bliższej części jelita. Zawsze konieczne jest uwidocznienie całego jelita grubego, ponieważ istnieje ryzyko występowania guza synchronicznego.
Endoskopia umożliwia zobrazowanie i dokładne zlokalizowanie guza oraz pobranie materiału do badania histopatologicznego. Ponadto umożliwia usunięcie większości zmian przednowotworowych. Kolonoskopia wykazuje bardzo wysoką czułość i wysoką swoistość w wykrywaniu raka inwazyjnego oraz polipów, które mogą stanowić zmianę przednowotworową. Skuteczność badania ogranicza złe przygotowanie chorego do badania i sytuacja niemożności zbadania całego jelita grubego.
Rak jelita grubego może być widoczny jako zmiana wypukła, płaska lub jako owrzodzenie. Endoskopowo zmiany klasyfikuje się według podziału Borrmanna i wyróżnia się postać polipowatą, grzybiastą (wrzodziejąco-polipowata), wrzodziejącą lub zmianę rozlaną. W celu ułatwienia rozpoznania bardzo wczesnych zmian bywają stosowane chemoendoskopia (barwienie błony śluzowej) oraz endoskopia powiększająca.
Przy niewielkich, płaskich zmianach pomocne bywa przedoperacyjne oznakowanie guza za pomocą założonego klipsa lub wykonania tatuażu.
Nierzadko pełna kolonoskopia nie może być wykonana z powodów technicznych lub stanu chorego. Powodem może być zwężenie nowotworowe lub zapalne jelita, silne uczucie dyskomfortu badanego, skurcz jelita, zrosty lub uchyłki.
Ultrasonografia endoskopowa (EUS) i ultrasonografia endorektalna (ERUS)
Ultrasonografia endoskopowa jest inwazyjną metodą diagnostyczną polegającą na umieszczeniu w przewodzie pokarmowym endoskopu wyposażonego w głowicę ultrasonograficzną. Ultrasonografia endorektalna jest podobną metodą i sonda jest umieszczana w obrębie odbytnicy. Podstawowym celem badania jest ocena zaawansowania, a także rozpoznanie chorych wymagających chemioterapii neoadiuwantowej od chorych niewymagających tego leczenia.
Ultrasonografia endoskopowa w ocenie stopnia zaawansowania miejscowego raka jelita grubego (cecha T klasyfikacji TNM) charakteryzuje się bardzo wysoką czułością wynoszącą 80–96% i swoistością wynoszącą 75–98% i wykazuje przewagę nad TK i MRI. W ocenie zajęcia węzłów chłonnych (cecha N klasyfikacji TNM) wykazuje około 70% czułość i 80% swoistość nie wykazując istotnej klinicznie przewagi nad TK i MRI. Biopsja cienkoigłowa wykonana podczas EUS pomaga rozpoznać zajęcie węzłów chłonnych.
Endoskopia kapsułkowa
Endoskopia kapsułkowa jest metodą diagnostyczną, w której stosuje się kapsułkę zawierającą urządzenie rejestrujące (endoskop). W celu diagnostyki jelita grubego stosuje się inne urządzenia niż do diagnostyki jelita cienkiego. Kapsułka jest wyposażona w dwa aparaty i posiada zasilanie na około 10 godzin pracy. Kapsułkę endoskopową połyka się, w celu ograniczenia zużycia baterii urządzenie pozostaje w uśpieniu do około godziny, następnie podczas pasażu przez jelito grube wykonuje liczne zdjęcia śluzówki z częstością 2–4 zdjęć na sekundę. Ze względu na niepełne pole widzenia dwóch kamer część błony śluzowej pozostaje niezbadana. Ograniczeniem jest także niemożliwość wykonania dodatkowych obrazów z podejrzanego miejsca i niemożliwość wykonania zabiegów, w tym pobrania próbki do badania histopatologicznego. Endoskopy kapsułkowe drugiej generacji w wykrywaniu polipów większych od 6 mm osiągają czułość wynoszącą do 86%.
Endoskopia kapsułkowa może być stosowana u chorych z niskim ryzykiem raka jelita grubego, bez objawów alarmujących i występowania raka jelita grubego w rodzinie. U chorych z wysokim ryzykiem rozpoznania raka, z objawami alarmującymi lub występowaniem raka jelita grubego w rodzinie zaleca się wykonanie kolonoskopii. Endoskopia kapsułkowa może być zastosowana u chorych, u których niemożliwe jest wykonanie pełnej kolonoskopii. Endoskopia kapsułkowa może znaleźć zastosowanie jako badanie przesiewowe raka jelita grubego.
Wirtualna kolonoskopia TK i tomografia komputerowa
Wirtualna kolonoskopia jest badaniem radiologicznym, w którym na podstawie przekrojów uzyskanych w tomografii komputerowej tworzy się odwzorowanie powierzchni błony śluzowej. Zabieg wymaga dobrego przygotowania i wprowadzenia gazu (zwykle powietrza lub dwutlenku węgla) do jelita grubego w celu rozciągnięcia błony śluzowej.
Czułość badania jest uzależniona od wielkości zmiany. Dla polipów poniżej 6 mm czułość wynosi około 48%, dla polipów pomiędzy 6–9 mm czułość wynosi około 70%, a dla zmian większych niż 9 mm 85%. Swoistość dla polipów o wielkości poniżej 6 mm wynosi 92%, dla polipów o wielkości 6–9 mm 93% i 97% dla polipów powyżej 9 mm. W metaanalizie kilku badań czułość wirtualnej kolonoskopii TK w wykrywaniu raka jelita grubego wynosiła 96% i była porównywalna z kolonoskopią.
Wirtualna kolonoskopia TK jest stosowana w przypadku niemożności wykonania pełnej kolonoskopii lub przeciwwskazań do badania. Metoda jest przydatna w ramach wstępnej diagnostyki u starszych chorych i chorych w złym stanie ogólnym z niepokojącymi objawami. Podejrzenie raka jelita grubego za pomocą wirtualnej kolonoskopii wymaga wykonania optycznej kolonoskopii, która umożliwia pobranie materiału do badania histopatologicznego.
Metoda może znaleźć zastosowanie jako alternatywa do kolonoskopii w badaniach przesiewowych w kierunku raka jelita grubego. W Europie bywa wykorzystywana u chorych z niecałkowitym badaniem kolonoskopowym w ramach zastąpienia badania na krew utajoną w kale lub u chorych niezgadzających się na kolonoskopię.
Klasyczna wielorzędowa tomografia komputerowa jamy brzusznej, miednicy i klatki piersiowej jest wykorzystywana do oceny zaawansowania choroby nowotworowej.
Wirtualna kolonoskopia MRI i rezonans magnetyczny
Wirtualna kolonoskopia MRI bywa wykorzystywana do rozpoznawania raka jelita grubego u chorych, u których nie można wykonać pełnej kolonoskopii. Metoda jest bardzo czuła w wykrywaniu polipów większych niż 10 mm i raka jelita grubego.
Rezonans magnetyczny jest stosowany do oceny zaawansowania choroby. Jest przydatny do oceny zaawansowania miejscowego guza (cecha T klasyfikacji TNM) oraz oceny obecności przerzutów w wątrobie (cecha M klasyfikacji TNM). Metoda jest szczególnie przydatna do oceny rozprzestrzeniania się guza poza światło narządu w obrębie odbytnicy, w tym oceny mezorektum (tkanki okołoodbytnicze) i powięzi mezorektum. W ocenie zaawansowania miejscowego metoda nie wykazuje przewagi nad endorektalnym USG, które ma podobną skuteczność. Ze względu na wysokie koszty i ograniczoną dostępność MRI badania nie stosuje się rutynowo w ocenie stopnia zaawansowania miejscowego. Rezonans magnetyczny wykazuje pewną przewagę nad tomografią komputerową w wykrywaniu przerzutów do wątroby.
Pozytonowa tomografia emisyjna
Pozytonowa tomografia emisyjna w połączeniu z tomografią komputerową (PET-TK) jest przydatną metodą w ocenie zaawansowania choroby, odpowiedzi na leczenie i rozpoznania nawrotu choroby. Jest stosowana w ocenie obecności przerzutów pozawątrobowych, a wraz z podwyższonym stężeniem markera CEA wskazuje na nawrót. Metoda jest oparta o wykrywanie zwiększonego wychwytu glukozy znakowanej fluorem (18F-FDG), co pozwala rozpoznać miejsca o zwiększonym poziomie metabolizmu, jakimi są ogniska nowotworu złośliwego.
Radiologiczne badanie dwukontrastowe
Badanie polega na podaniu zawiesiny siarczanu baru jako pozytywnego środka cieniującego oraz dwutlenku węgla jako negatywnego środka kontrastującego i wykonanie serii zdjęć rentgenowskich w różnych układach. Czułość badania dla zmian mniejszych niż 5 mm wynosi 32%, a dla zmian 6–10 mm wynosi 50%. Czułość badania w rozpoznawaniu raka esicy i odbytnicy wynosi około 80% i specyficzność wynosi około 98%.
W badaniu radiologicznym rak może się objawiać:
- okrężnym zwężeniem przypominającym ogryzek jabłka,
- zmianami polipowatymi o grzybiastym kształcie,
- polipem z zagłębieniem u podstawy,
- polipem o nieregularnym zarysie,
- zmianą płaską z ubytkiem w kształcie płytki,
- zmianą z kraterowatym rozpadem i uniesionymi brzegami.
Markery nowotworowe
- CEA (antygen rakowo-płodowy)
CEA jest glikoproteiną stosowaną w diagnostyce wielu nowotworów złośliwych. Stężenie markera ulega podwyższeniu o 50% u chorych na raka jelita grubego, jednak zwykle następuje to w zaawansowanym stadium choroby. Wysokie przedoperacyjne stężenie jest związane z większym zaawansowaniem choroby i wyższym ryzykiem nawrotu. Podwyższone stężenie CEA koreluje z gorszym rokowaniem. Powtarzalne oznaczenia CEA wykazuje wysoką czułość w diagnostyce nawrotu choroby.
- CA 19-9
CA 19-9 jest glikoproteiną wykorzystywaną w diagnostyce przede wszystkim raka trzustki, jego podwyższone stężenie obserwuje się również w raku dróg żółciowych i innych nowotworach przewodu pokarmowego.
CA 19-9 wykorzystuje się w diagnostyce i monitorowaniu raka jelita grubego. Połączenie CEA i CA 19-9 dodatkowo zwiększa czułość badania. CA 19-9 samodzielnie lub w połączeniu z CEA jest używany w monitorowaniu odpowiedzi na leczenie.
- CA 72-4
CA 72-4 jest glikoproteiną, którego podwyższone stężenie obserwuje się w różnych nowotworach złośliwych. Marker wykazuje bardzo wysoką swoistość sięgającą 100%, jednak jego przydatność ogranicza niewielką czułość wynosząca około 60%. Skuteczność badania zwiększa jednoczesny pomiar CA 72-4 i CEA. Wysokie stężenie CA 72-4 koreluje z wyższym zaawansowaniem nowotworu, wyższym ryzykiem nawrotu i gorszym rokowaniem.
- TPA
Tkankowy antygen polipeptydowy jest polipeptydem powstającym podczas fazy S i fazy G2 cyklu komórkowego. Jest uwalniany do krążenia w wyniku rozpadu komórek. Zwiększone stężenie TPA jest stwierdzane w 60–80% przypadków raka jelita grubego. Prawdopodobnie jego podwyższone stężenie jest niekorzystnym czynnikiem rokowniczym.
Biopsja
Zmiany rozpoznane podczas endoskopii lub badań obrazowych wymagają wykonania biopsji w celu potwierdzenia lub wykluczenia obecności nowotworu złośliwego. Pobrany bioptat jest następnie badany histopatologicznie. Celna biopsja może jednoznacznie potwierdzić raka, jednak pobrana próbka może nie dostarczać pełnej informacji o nowotworze.
Badanie histopatologiczne
Badanie histopatologiczne umożliwia ostateczne rozpoznanie choroby, które jest konieczne przed rozpoczęciem leczenia ogólnoustrojowego. Badanie umożliwia określenie histologicznego typu guza, stopnia jego złośliwości histologicznej, histopatologiczną ocenę stopnia zaawansowania, w tym ocenę głębokości nacieku, zajęcia węzłów chłonnych, obecności przerzutów odległych oraz ocenę marginesów chirurgicznych.
Ocena zaawansowania i rokowania
Ocena zaawansowania choroby
Samo rozpoznanie choroby nowotworowej nie jest wystarczające do wyboru właściwego leczenia, do czego konieczna jest ocena zaawansowania choroby (ang. staging). Zaawansowanie choroby jest określane według klasyfikacji TNM, która składa się ze stopnia zaawansowania guza pierwotnego, stopnia zajęcia lokalnych węzłów chłonnych oraz obecności przerzutów odległych. Obecnie obowiązuje 7 klasyfikacja TNM według AJCC.
Ocena zaawansowania choroby początkowo jest przeprowadzana klinicznie na podstawie historii choroby, badania lekarskiego, kolonoskopii z biopsją oraz badań obrazowych. Następnie po chirurgicznym usunięciu guza preparat po operacji jest badany histopatologicznie, co jest podstawą do postawienia histologicznej oceny zaawansowania.
Kliniczna ocena guza pierwotnego (cecha T) jest przeprowadzana za pomocą ultrasonografii endoskopowej lub rezonansu magnetycznego. Tomografia komputerowa, rezonans magnetyczny i ultrasonografia endoskopowa służą do oceny obecności przerzutów do pobliskich węzłów chłonnych (cecha N). W ocenie obecności przerzutów odległych wykorzystuje się tomografię komputerową, rezonans magnetyczny i pozytonową tomografię emisyjną. Rezonans magnetyczny wykazuje pewną przewagę nad tomografią komputerową i PET w wykrywaniu przerzutów do wątroby. W ocenie obecności przerzutów do płuc zaleca się RTG klatki piersiowej lub tomografię komputerową klatki piersiowej. Choć tomografia komputerowa wykazuje wyższą czułość w wykrywaniu przerzutów do płuc, to jednak ze względu na częste stwierdzanie zmian nienowotworowych w płucach, chorzy bez przerzutów wątrobie lub w węzłach chłonnych nie odnoszą korzyści z przedoperacyjnej tomografii komputerowej klatki piersiowej. Wytyczne ESMO nie zalecają rutynowego wykonywania tomografii komputerowej klatki piersiowej.
Podstawowymi badaniami wykorzystywanymi do oceny zaawansowania choroby jest tomografia komputerowa jamy brzusznej i miednicy, zdjęcie rentgenowskie klatki piersiowej lub tomografia komputerowa klatki piersiowej, ewentualnie tomografia komputerowa klatki piersiowej. Rezonans magnetyczny może być korzystniejszym badaniem u chorych z zaawansowanym nowotworem ze względu na lepszą czułość w wykrywaniu przerzutów do wątroby i otrzewnej. PET-TK nie jest zalecany do rutynowej oceny zaawansowania klinicznego. Przed operacją oznacza się stężenia CEA, brak normalizacji po miesiącu od zabiegu sugeruje nieskuteczność leczenia.
Czynniki rokownicze
Rokowanie chorego jest uzależnione od wielu czynników. Zależy ono od głębokości nacieku, położenia guza, zajęcia lokalnych węzłów chłonnych, obecności przerzutów odległych, stopnia zaawansowania klinicznego, stopnia złośliwości histopatologicznej, uzyskania ujemnych marginesów chirurgicznych i obecności nawrotu choroby.
Rokowanie chorego koreluje ze stopniem zaawansowania klinicznego guza ocenianego w klasyfikacji TNM. Kluczowa rokowniczo jest głębokość inwazji w głąb ściany jelita grubego. Wraz z głębokością nacieku ściany narządu wzrasta ryzyko wznowy po leczeniu radykalnym, zajęcia węzłów chłonnych oraz obecności przerzutów odległych. Sama wielkość guza nie koreluje z rokowaniem lub ma marginalny wpływ na rokowanie, choć wielkość nowotworu wpływa na miejscową kontrolę choroby. Rozległa inwazja warstwy podśluzowej i obecność depozytów komórek nowotworowych poza guzem pogarszają rokowanie.
Do czynników rokowniczych zalicza się lokalizację guza. Nowotwory zlokalizowane w okrężnicy rokują lepiej od występujących w odbytnicy. Gorsze rokowanie cechuje guzy o wrzodziejącym lub siedzącym typie makroskopowym w porównaniu do polipowatego typu wzrostu. Egzofityczny wzór wzrostu jest korzystnym czynnikiem rokowniczym, wiąże się z mniejszym zaawansowaniem i mniejszym ryzykiem obecności przerzutów odległych. Niedrożność jelita oraz perforacja są niekorzystnymi czynnikami rokowniczymi. Zajęcie lokalnych węzłów chłonnych jest bardzo ważnym, niekorzystnym czynnikiem rokowniczym, na przeżycie niekorzystnie wpływa sama obecność zajęcia węzłów chłonnych oraz rozległość ich zajęcia. Nieuzyskanie marginesów chirurgicznych wolnych od nacieku wiąże się z wysokim ryzykiem nawrotu i gorszym rokowaniem. Rokownicze znaczenie ma wzór naciekania nowotworu.
Prawdopodobnie podtyp histopatologiczny guza, z wyjątkiem tych z definicji o wysokim stopniu złośliwości, nie wpływa na rokowanie. Stopień złośliwości histologicznej koreluje z rokowaniem. Nowotwory słabo zróżnicowane (o wysokim stopniu złośliwości histologicznej) są związane z gorszym rokowaniem i słabszym przeżyciem chorych. Gruczolakorak śluzowy i sygnetowaty są traktowane jak guzy o wyższym stopniu złośliwości i są skorelowane z gorszym przeżyciem. Inwazja naczyń żylnych i limfatycznych pogarsza rokowanie, jest związana z wyższym ryzykiem nawrotu choroby oraz gorszym przeżyciem chorych. Niezależnym niekorzystnym czynnikiem prognostycznym jest inwazja okołonerwowa, która znacząco zwiększa ryzyko wznowy i pogarsza przeżycie chorych.
Klasyfikacja TNM
Klasyfikacja TNM jest systemem oceny zaawansowania klinicznego nowotworu.
| Guz pierwotny – cecha T | |
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| Tis | Rak in situ |
| T1 | Guz nacieka warstwę podśluzową |
| T2 | Guz nacieka błonę mięśniową właściwą |
| T3 | Guz nacieka przez błonę mięśniową właściwą tkanki okołookrężnicze lub okołoodbytnicze |
| T4 | – |
| T4a | Guz powoduje perforację otrzewnej |
| T4b | Guz bezpośrednio nacieka lub przylega do innych narządów lub struktur |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w regionalnych węzłach chłonnych |
| N1 | Obecne są przerzuty w 1–3 regionalnych węzłach chłonnych |
| N1a | Przerzut w 1 regionalnym węźle chłonnym |
| N1b | Przerzuty w 2–3 regionalnych węzłach chłonnych |
| N1c | Obecny depozyt lub depozyty komórek nowotworowych w warstwie podsurowiczej, krezce lub niepokrytych otrzewną tkankach okołookrężniczych lub okołoodbytniczych bez przerzutu lub przerzutów w węzłach chłonnych |
| N2 | Obecne są przerzuty w 4 lub więcej regionalnych węzłach chłonnych |
| N2a | Przerzuty w 4–6 regionalnych węzłach chłonnych |
| N2b | Przerzuty w 7 lub więcej regionalnych węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| Mx | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Obecne przerzuty odległe |
| M1a | Przerzuty ograniczone do jednego narządu lub miejsca (np. wątroba, płuco, jajnik, pozaregionalny węzeł chłonny) |
| M1b | Przerzuty w więcej niż jednym narządzie lub miejscu lub w otrzewnej |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M |
| 0 | Tis | N0 | M0 |
| IA | T1 | N0 | M0 |
| T2 | N0 | M0 | |
| IIA | T3 | N0 | M0 |
| IIB | T4a | N0 | M0 |
| IIC | T4b | N0 | M0 |
| IIIA | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| T1 | N2a | M0 | |
| IIIB | T3 | N1 | M0 |
| T4a | N1 | M0 | |
| T2 | N2a | M0 | |
| T3 | N2a | M0 | |
| T1 | N2b | M0 | |
| T2 | N2b | M0 | |
| IIIC | T4a | N2a | M0 |
| T3 | N2b | M0 | |
| T4a | N2b | M0 | |
| T4b | N1 | M0 | |
| T4b | N2 | M0 | |
| IVa | dowolne T | dowolne N | M1a |
| IVb | dowolne T | dowolne N | M1b |
Inne klasyfikacje
Obok klasyfikacji TNM, która jest zalecaną klasyfikacją do oceny zaawansowania choroby, bywają używane starsze klasyfikacje Dukesa i Astler-Collera.
| Stopień | Cechy |
| A | Nowotwór nie przekracza ściany jelita |
| B | Nowotwór przekracza ścianę jelita do surowicówki lub tkanki tłuszczowej okołoodbytniczej |
| C | Przerzuty w okolicznych węzłach chłonnych |
| D | Przerzuty odległe |
| Stopień | Cechy |
| A | Rak ograniczony do błony śluzowej |
| B1 | Naciek nie przekracza ściany mięśniowej |
| B2 | Naciek przekracza ścianę mięśniową, obejmuje tkanki okołookrężnicze lub otrzewną |
| C1 | Stopień B1 i zajęcie regionalnych węzłów chłonnych |
| C2 | Stopień B2 i zajęcie regionalnych węzłów chłonnych |
| D | Obecne przerzuty odległe |
Leczenie
Strategia leczenia raka jelita grubego zależy od stopnia zaawansowania choroby, stanu ogólnej sprawności chorego oraz współistniejących istotnych chorób. Całkowite wyleczenie raka jelita grubego jest możliwe wyłącznie u chorych poddanych radykalnemu zabiegowi chirurgicznemu, w pozostałych przypadkach leczenie jest ukierunkowane przede wszystkim na maksymalne wydłużenie przeżycia chorego. Zabieg chirurgiczny polega na szerokim wycięciu guza z zachowaniem odpowiednich marginesów zdrowych tkanek. Rodzaj zabiegu zależy od położenia guza, a w przypadku guzów położonych w odbytnicy także od możliwości jego usunięcia z zachowaniem funkcji zwieraczy odbytu. W bardzo wczesnych stadiach choroby rak może być leczony endoskopowo. W przypadku raka okrężnicy w zależności od położenia guza wykonuje się częściową prawostronną lub lewostronną hemikolektomię albo odcinkową resekcję okrężnicy. W przypadku raka odbytnicy wykonuje się przednią resekcję odbytnicy lub brzuszno-kroczową amputację odbytnicy. Zachowanie zwieraczy warunkuje bliskość nacieku raka w stosunku do zwieraczy, konieczność zachowania odpowiedniego marginesu wolnego od nacieku nowotworowego oraz techniczna możliwość utworzenia zespolenia. W raku odbytnicy standardowym elementem każdego zabiegu jest całkowite wycięcie mezorektum.
Leczenie okołooperacyjne różni się w raku okrężnicy i w raku odbytnicy. Celem leczenia okołooperacyjnego jest zmniejszenie ryzyka nawrotu, wydłużenie przeżycia chorych i w przypadku raka odbytnicy ułatwienie lub umożliwienie wykonania radykalnego zabiegu z zachowaniem zwieraczy. Leczenie operacyjne raka odbytnicy w zaawansowanym stadium choroby, obejmujące wysokie zaawansowanie miejscowe choroby (guzy T3–T4), zajęcie lokalnych węzłów chłonnych lub lokalnie nieoperacyjny guz, wymaga zastosowania leczenia neoadiuwantowego lub ewentualnie jest uzupełniane leczeniem adiuwantowym, gdy leczenie neoadiuwantowe nie było stosowane przed operacją. Leczenie neoadiuwantowe w raku odbytnicy polega na chemioradioterapii z kapecytabiną lub 5-fluorouracylem albo 5-fluorouracylem z leukoworyną, a następnie chemioterapii z użyciem programu FOLFOX, kapecytabiny z lub bez oksaliplatyny albo 5-fluorouracylu z lub bez leukoworyny. Chemioradioterapia może być poprzedzona chemioterapią. U chorych w pośrednim zaawansowaniu raka odbytnicy równoważnym leczeniem jest krótkotrwała radioterapia bez chemioterapii. Leczenie raka okrężnicy w stadium III zaawansowania klinicznego według TNM jest uzupełniane o sześciomiesięczną chemioterapię adiuwantową za pomocą 5-fluorouracylu, kapecytabiny, programu FOLFOX, CapeOx albo FLOX. W niektórych przypadkach konieczne jest również włączenie leczenia adiuwantowego w stadium II zaawansowania klinicznego.
Leczenie choroby z przerzutami jest oparte o chemioterapię; jej charakter zależy od założonych celów terapeutycznych i stanu chorego. U niewielkiej części chorych możliwe jest wykonanie chirurgicznego wycięcia pojedynczych przerzutów do wątroby lub płuc, a pewna część chorych może odnieść korzyść z intensywnej chemioterapii mającej na celu zmniejszenie wielkości przerzutów i techniczne umożliwienie operacji. U większości chorych operacja nie jest możliwa i intensywna wielolekowa chemioterapia ma na celu przede wszystkim jak największe wydłużenie przeżycia chorych. W ramach intensywnej chemioterapii stosuje się wielolekowe programy lecznicze oparte o fluoropirymidynę (5-fluorouracyl, kapecytabina) w połączeniu z oksaliplatyną lub irynotekanem tworząc schematy FOLFOX, CapeOX (XELOX), FOLFIRI i FOLFOXIRI, które mogą być kojarzone z bewacyzumabem lub inhibitorami EGFR (cetuksymab, panitumumab). U chorych w złym stanie klinicznym podstawowym celem jest złagodzenie objawów choroby i hamowanie progresji choroby, w tym celu stosuje się leczenie oparte o pojedyncze aktywne w raku jelita grubego leki przeciwnowotworowe.
Leczenie chirurgiczne w chorobie ograniczonej
Leczenie endoskopowe
Większość przypadków raka jelita grubego jest stwierdzana podczas kolonoskopii wykonanej przesiewowo lub z powodu niewyjaśnionych dolegliwości. Choć badanie pozwala klinicznie postawić podejrzenie nowotworu złośliwego, to jednak nie ma możliwości wykluczenia go bez wykonania biopsji i wykonania badania histopatologicznego. W związku z tym wszystkie stwierdzone podczas endoskopii podejrzane zmiany są w miarę możliwości usuwane w całości, a następnie badane histopatologicznie. Rodzaj zabiegu endoskopowego zależy od wielkości i typu wzrostu polipa, a w zależności od histopatologicznych cech rokowniczych ewentualne dalsze postępowanie.
Małe polipy o wielkości do 5–8 mm są usuwane w całości za pomocą kleszczyków biopsyjnych. Większe, uszypułowane polipy są usuwane za pomocą pętli diatermicznej lub elektrokoagulacji. Kluczowe jest oznaczenie na preparacie miejsca wycięcia polipa, ponieważ determinuje to ocenę marginesu chirurgicznego i wybór dalszego postępowania. Duże zmiany o siedzącym typie wzrostu (o szerokiej podstawie) nie są usuwane podczas endoskopii, ale pobiera się z nich wycinek do badania histopatologicznego. w przypadku polipów, które są zbyt duże aby je usunąć podczas zabiegu endoskopowego i łagodnym charakterze pobranej biopsji w badaniu histopatologicznym, przeprowadza się odcinkową resekcję jelita grubego z marginesem 5 cm.
Rak o charakterze uszypułowanego lub siedzącego polipa z korzystnymi czynnikami ryzyka („rak w polipie”, „złośliwy polip”) po endoskopowym całkowitym usunięciu nie wymaga dalszego leczenia poza leczeniem endoskopowym. Do korzystnych czynników ryzyka zalicza się osiągnięcie ujemnych marginesów chirurgicznych, 1 i 2 stopień złośliwości histologicznej oraz bez inwazji struktur naczyniowych. Jednak w przypadku polipa siedzącego po leczeniu endoskopowym, ze względu na większe prawdopodobieństwo nawrotu i zajęcia węzłów chłonnych, pomimo ujemnych marginesów i korzystnych czynników ryzyka histopatologicznego standardową metodą leczenia jest resekcja jelita grubego.
Jeśli wiarygodna ocena marginesów jest niemożliwa lub badanie histopatologiczne wykaże niekorzystne cechy rokownicze, to konieczna jest resekcja jelita grubego z wycięciem en block węzłów chłonnych. Do niekorzystnych cech histopatologicznych wymagających bardziej rozległego leczenia zalicza się brak wolnych od nacieku marginesów chirurgicznych wycięcia, 3 i 4 stopień złośliwości histologicznej i inwazja struktur naczyniowych. Za ujemny margines przyjmuje się brak nacieku nowotworowego 1–2 mm linii cięcia. Stwierdzenie marginesów wolnych od nacieku nowotworowego, braku naciekania struktur naczyniowych i 1–2 stopnia złośliwości histologicznej nie wyklucza możliwości wznowy po leczeniu endoskopowym.
Klasyczna operacja
U chorych z chorobą operacyjną bez przerzutów odległych wykonuje się zabieg operacyjny polegający na anatomicznej resekcji jelita grubego z guzem w jednym bloku tkankowym (en block) z regionalnymi węzłami chłonnymi. Zakres zabiegu jest uzależniony od położenia guza, anatomicznej struktury unaczynienia tętniczego i limfatycznego.
W przypadku guza położonego w kątnicy, wstępnicy i zgięcia wątrobowego wykonuje się prawostronną hemikolektomię. Zabieg polega na usunięciu 10–15 cm końcowego odcinka jelita krętego, całej kątnicy, wstępnicy i bliższego odcinka poprzecznicy. Ciągłość przewodu pokarmowego odtwarza się za pomocą zespolenia jelita krętego z pozostawioną częścią poprzecznicy. Ze względu na specyfikę unaczynienia i konieczność usunięcia określonego dorzecza węzłów chłonnych nie przeprowadza się mniej rozległych operacji. Zamykane są niektóre odgałęzienia tętnicy krezkowej górnej: tętnica krętniczo-kątnicze, tętnica krętnicza prawa i prawa gałąź tętnicy okrężniczej środkowej. Jeśli występuje konieczność podwiązania lewej gałęzi tętnicy okrężniczej środkowej to konieczna jest kontrola unaczynienia pozostawianej części poprzecznicy i ewentualne poszerzenie resekcji w przypadku braku odpowiedniego ukrwienia. Guzy położone w początkowym odcinku poprzecznicy wymagają usunięcia całej tętnicy okrężniczej środkowej, prawej tętnicy okrężniczej i tętnicy krętniczo-kątniczej.
Guzy położone w poprzecznicy wymagają różnego sposobu leczenia chirurgicznego w zależności od położenia. W przypadku guzów położonych w okolicy zgięcia wątrobowego oraz środkowej części okrężnicy wykonuje się rozszerzoną prawostronną hemikolektomię poszerzoną o podwiązanie prawego i lewego odgałęzienia tętnicy okrężniczej środkowej. W niektórych przypadkach, gdy jelito grube jest dobrze ruchome, guzy środkowej części poprzecznicy mogą być leczone odcinkową resekcją poprzecznicy. Jednak taka operacja jest rzadko wykonywana ze względu na niewystarczającą szerokość resekcji oraz ryzyko powstania wewnętrznej przepukliny. Prawostronna hemikolektomia zapewnia lepsze ukrwienie zespolenia, co przekłada się na mniejsze ryzyko jego nieszczelności. Guzy położone w dalszym odcinku poprzecznicy i zgięcia śledzionowego wymagają lewostronnej hemikolektomii.
W przypadku guzów zlokalizowanych w zstępnicy wykonuje się lewostronną hemikolektomię. Zabieg polega na usunięciu zgięcia śledzionowego i wzstępnicy, z podwiązaniem tętnicy okrężniczej lewej (odgałęzienie tętnicy krezkowej dolnej) i wykonaniu zespolenia pomiędzy poprzecznicą a esicą.
Guzy esicy mogą być leczone resekcją esicy z zachowaniem 5 cm marginesów chirurgicznych po mobilizacji poprzecznicy i zgięcia śledzionowego i podwiązaniu tętnicy krezkowej dolnej poniżej oddzielenia się tętnicy okreżniczej lewej.
Rak odbytnicy może być leczony przez przezodbytowe wycięcie guza, przednią resekcję odbytnicy albo brzuszno-kroczową amputacje odbytnicy. Zawsze dąży się do zachowania zwieraczy, choć nie zawsze jest to możliwe. Preferowaną operacją jest przednia resekcja odbytnicy, która pozwala zachować funkcję zwieraczy odbytu, jednak nie jest ona możliwa do wykonania u wszystkich chorych.
Przezodbytnicze wycięcie guza może być przeprowadzone w wybranych przypadkach guza o niewielkim zaawansowaniu miejscowym bez cech zajęcia węzłów chłonnych (guzy T1N0M0). Nowotwór musi się znajdować do 8 cm od brzegu odbytu, nie przekraczać 3 cm ani nie może zajmować więcej niż 30% obwodu odbytnicy. Nowotwór musi być dobrze lub umiarkowanie zróżnicowany i w biopsji nie mogą występować cechy inwazji żylnej lub limfatycznej. Jeśli w badaniu histopatologicznym stwierdza się niekorzystne cechy guza zwiększające ryzyko nawrotu, to wykonuje się radykalną resekcję odbytnicy. Wycięcie musi zachować odpowiednio szeroki margines zdrowych tkanek i musi być głębokie sięgając do okołoodbytniczej tkanki tłuszczowej. Margines powinien wynosić przynajmniej 1 cm. Ograniczeniem metody jest obecność mikroprzerzutów do okolicznych węzłów chłonnych. Rak odbytnicy w stadium T1 charakteryzuje się większą częstością zajęcia lokalnych węzłów chłonnych (13–25%) niż rak w okrężnicy (3–8%). Z tego względu przed zabiegiem konieczne jest wykonanie ultrasonografii endorektalnej (ERUS). Wycięcie przezodbytnicze jest metodą mniej inwazyjną i obciążającą dla chorego, jednak odsetek nawrotów tej metody leczenia jest większy niż w przypadku bardziej rozległej operacji radykalnej oraz oferuje nieznacznie gorsze przeżycie całkowite leczonych niż chorych leczonych operacją radykalną. Przezodbytnicza mikrochirurgia endoskopowa (TEN) może ułatwiać wycięcie przez odbyt niewielkich guzów.
W guzach o wyższym zaawansowaniu (T2, T3) leczenie chirurgiczne polega na przedniej resekcji odbytnicy lub brzuszno-kroczowej amputacji odbytnicy. Guzy położone powyżej załamka otrzewnej są leczone na podobnych zasadach jak rak w esicy. Guzy położone 1–2 cm od linii zębatej mogą być wycięte z odtworzeniem ciągłości przewodu pokarmowego bez wytwarzania stałej kolostomii. Przed operacją u niektórych chorych stosuje się neoadiuwantową radiochemioterapię w celu zwiększenia szansy na wykonanie zabiegu oszczędzającego zwieracze.
Przednia resekcja odbytnicy jest stosowana w zmianach dotyczących górnej i środkowej części odbytnicy. Operacja polega na mobilizacji i przecięciu odbytnicy, a następnie odtworzeniu ciągłości przewodu pokarmowego za pomocą zespolenia bok-do-końca. Podczas resekcji nisko położonego guza w celu zachowania zwieraczy możliwe jest wykonanie węższego marginesu zdrowych tkanek. Minimalny margines cięcia powinien wynosić przynajmniej 1–2 cm powyżej zwieraczy. W celu poprawy wielkości marginesu chirurgicznego bywają wykonywane operacje z częściową resekcją zwieraczy z zachowaniem ich funkcji, jednak nie ma dużych badań potwierdzających skuteczność takiego postępowania.
Brzuszno-kroczowa (krzyżowa) amputacja odbytnicy (operacja Milesa) jest wykonywana w przypadku nacieku zwieraczy odbytu, mięśnia dźwigacza odbytu lub konieczny zakres resekcji spowoduje utratę funkcji zwieraczy odbytu lub nietrzymanie moczu. Brzuszno-kroczowa amputacja odbytnicy polega na wycięciu w jednym bloku tkankowym (en block) części esicy, odbytnicę, odbyt i mezorektum z wyłonieniem stałej kolostomii.
Kilka badań wskazuje, że operacja brzuszno-kroczowa jest związana z gorszą lokalną kontrolą choroby oraz gorszym przeżyciem całkowitym leczonych.
Zarówno w przedniej resekcji odbytnicy, jak i w brzuszno-kroczowej amputacji odbytnicy wykonuje się całkowite wycięcie mezorektum (TME). Jest to standardowa procedura w przypadku guzów położonych w dolnej i środkowej części odbytnicy. W przypadku guzów górnej części odbytnicy zaleca się wycięcie mezorektum do 5 cm od brzegu guza. Zabieg polega na wypreparowaniu mezorektum wraz z powięzią mezorektum. Całkowite wycięcie mezorektum zmniejsza ryzyko nawrotu miejscowego i wydłuża przeżycie całkowite leczonych. Niecałkowite wycięcie mezorektum wiąże się z wyższym ryzykiem wznowy. Ponadto w raku w dalszej części odbytnicy bez naciekania zwieraczy całkowite wycięcie mezorektum sprzyja zachowaniu funkcji zwieraczy odbytu. Operacja ułatwia zaoszczędzenie niektórych okolicznych nerwów, co przekłada się na zachowanie prawidłowej funkcji pęcherza moczowego oraz funkcji seksualnych. W leczeniu raka odbytnicy nie zaleca się dodatkowego poszerzania usunięcia węzłów chłonnych (limfadenektomii), poza usunięciem węzłów podejrzanych klinicznie o obecność przerzutów węzłowych. Podobnie w raku okrężnicy wycina się również wszystkie podejrzane węzły chłonne położone poza obszarem resekcji.
Operacja laparoskopowa
Operacja laparoskopowa jest opcją chirurgicznego leczenia raka okrężnicy. Operacje wykonywane metodą laparoskopową pozwalają osiągać podobne wyniki leczenia raka okrężnicy w porównaniu do metody otwartej. Operacja laparoskopowa wiąże się z krótszym okresem pooperacyjnym i krótszym pobytem w szpitalu. Metoda nie jest zalecana w przypadku guzów powodujących niedrożność, perforację lub naciekających sąsiednie struktury.
W przypadku raka odbytnicy operacja laparoskopowa prawdopodobnie oferuje podobne wyniki długoterminowe jak operacja metodą klasyczną.
Leczenie okołooperacyjne choroby potencjalnie operacyjnej bez przerzutów
W leczeniu raka jelita grubego stosuje się leczenie neoadiuwantowe poprzedzające leczenie operacyjne lub leczenie adiuwantowe, które podaje się po zabiegu chirurgicznym w celu poprawy skuteczności zabiegu. W związku z odmiennościami przebiegu klinicznego i specyfiką leczenia raka końcowego odcinka jelita grubego dla raka w okrężnicy i raka w odbytnicy przyjęto odmienne strategie leczenia okołooperacyjnego.
Rak okrężnicy
Leczenie adiuwantowe jest leczeniem stosowanym po przeprowadzonym radykalnym zabiegu chirurgicznym w celu zmniejszeniu ryzyka wznowy miejscowej lub pojawienia się przerzutów odległych.
U chorych z rakiem jelita grubego zasadność zastosowania leczenia adiuwantowego zależy od zaawansowania choroby:
- W chorobie w stadium I klinicznym nie stosuje się leczenia adiuwantowego.
- W chorobie w stadium II klinicznym o niskim ryzyku może być zastosowane leczenie adiuwantowe za pomocą kapecytabiny lub 5-fluorouracylu albo chorych wyłącznie się obserwuje.
- W chorobie w stadium II klinicznym o wysokim ryzyku – obejmującym guz w stopniu zaawansowania miejscowego T4, o wysokiej złośliwości histologicznej (z wyłączeniem nowotworów z niestabilnością mikrosatelitarną), naciekiem marginesów chirurgicznych, inwazją naczyń krwionośnych i limfatycznych, naciekiem okołonerwowym, niedrożnością jelit, perforacją jelita lub niewystarczającą oceną węzłów chłonnych (poniżej 12 węzłów) – stosuje się leczenie adiuwantowe za pomocą 5-fluorouracylu lub kapecytabiny albo programu FOLFOX lub CapeOx albo FLOX lub wyłącznie się obserwuje.
- W chorobie w stadium III klinicznym u wszystkich chorych zaleca się leczenie adiuwantowe za pomocą programu FOLFOX lub CapeOx albo FLOX albo 5-fluorouracylu lub kapecytabiny w monoterapii.
Kilka badań na chorych w II i III stadium klinicznym wykazało skuteczność leczenia adiuwantowego u chorych w III stadium klinicznym. Korzyści z leczenia adiuwantowego u chorych w II stadium klinicznym są znacznie mniejsze. Chorzy z przeciętnymi czynnikami ryzyka w II stadium klinicznym mają dobre rokowanie, dlatego nie odnoszą dużych korzyści z leczenia uzupełniającego. Z kolei chorzy z większym ryzykiem nawrotu odnoszą więcej korzyści z leczenia adiuwantowego. Kilka badań wskazuje na korzyści z leczenia adiuwantowego w II stadium klinicznym. Wyniki sugerują, że korzyści mogą być większe dla chorych z większym ryzykiem zajęcia węzłów chłonnych. Z kolei w innym badaniu nie wykazano korzyści z leczenia adiuwantowego również u chorych z czynnikami niekorzystnego rokowania, choć ograniczeniem pracy był starszy wiek leczonych. Wykazano, że opóźnienie chemioterapii adiuwantowej o 4 tygodnie powoduje zmniejszenie przeżycia całkowitego chorych.
U chorych w stadium II klinicznym zaleca się ocenę niestabilności mikrosatelitarnej (MSI), która jest czynnikiem korzystnego rokowania. Pozwala to na identyfikację chorych nie korzystających z leczenia adiuwantowego za pomocą 5-fluorouracylu. Ocenę niestabilności mikrosatelitarnej zaleca się również u wszystkich chorych ≤70. roku życia oraz u chorych z zespołem Lyncha.
Program FOLFOX6 jest preferowany nad programem FOLFOX4 w leczeniu adiuwantowym i choroby z przerzutami. W badaniu klinicznym na 2246 chorych w III stadium klinicznym porównano skuteczność leczenia adiuwantowego za pomocą programu FOLFOX (5-fluorouracyl, leukoworyna i oksaliplatyna) z połączeniem 5-fluorouracylu z leukoworyną (folinian wapnia). Wykazano, że program FOLFOX wywoływał dłuższe 5-letnie przeżycie wolne od choroby (DFS) w porównaniu do 5-fluorouracylu z folinianem wapnia wynoszące odpowiednio 66,4% i 58,9%, a także dłuższe 6-letnie przeżycie całkowite (OS) leczonych za pomocą programu FOLFOX w porównaniu do 5-fluorouracylu wynoszące odpowiednio 72,9% i 68,7%. Analiza pięciu badań na łącznie 4060 chorych poniżej 75. roku życia w III stadium klinicznym raka okrężnicy wykazała, że dodanie oksaliplatyny do 5-fluorouracylu poprawia przeżycie całkowite chorych. Również inna analiza danych potwierdza pozytywny wpływ na przeżycie dodania oksaliplatyny do 5-fluorouracylu również u chorych po 75. roku życia.
Program FLOX również jest złożony z 5-fluorouracylu, leukoworyny i oksaliplatyny, jednak różni się od FOLFOX odmienną wielkością i rozkładem dawek. Skuteczność programu FLOX porównano z połączeniem 5-fluorouracylu i leukoworyny (FULV). FLOX wykazał wyższy odsetek 4-letnich przeżyć wolnych od choroby (DFS) wynoszący 73,2% w porównaniu do 67,0% dla FULV. Po 7-letniej obserwacji program FLOX dalej wykazywał korzyści w wydłużeniu przeżycia wolnego od choroby, jednak nie obserwowano korzyści w wydłużeniu przeżycia całkowitego (OS).
Programy FOLFOX i FLOX są podobne pod względem skuteczności, jednak różnią się profilem toksyczności i drogą podania. Program FLOX znacznie częściej wywołuje ciężką biegunkę niż program FOLFOX. Z kolei program FLOX nie wymaga podania do cewnika centralnego.
Kapecytabina jest doustnym prolekiem metabolizowanym do 5-fluorouracylu. W leczeniu adiuwantowym III stadium zaawansowania raka jelita grubego wywołuje nie gorsze przeżycie wolne od choroby (DFS) i przeżycie całkowite (OS) jak 5-fluorouracyl. Kapecytabina może być łączona z oksaliplatyną (program CapeOX/XELOX). Połączenie wywołuje dłuższe 3-letnie przeżycie wolne od choroby (DFS) niż 5-fluorouracyl w połączeniu z leukoworyną.
U wybranych chorych z guzem o zaawansowaniu T4 według TNM stosuje się adiuwantową chemioradioterapię z użyciem 5-fluorouracylu. Może być zastosowana przedoperacyjna (neoadiuwantowa) chemioradioterapia w celu uzyskania operacyjności guza.
Rak odbytnicy
Neoadiuwantowe lub adiuwantowe leczenie raka odbytnicy jest przeprowadzane w stadium II i III zaawansowania klinicznego ze względu na wysokie ryzyko nawrotu choroby. Ryzyko nawrotu jest związane z trudnościami technicznymi uzyskania wystarczająco szerokiego marginesu chirurgicznego, braku przydanki odbytnicy i bliskości odbytnicy do innych narządów miednicy. Leczenie okołooperacyjne w raku odbytnicy polega na chemioradioterapii opartej na fluoropirymidynach i napromieniowaniu miednicy i następnie wykonaniu zabiegu radykalnego uzupełnionego chemioterapią. Postępowanie okołooperacyjne zależy od rozpoznanego stopnia zaawansowania choroby. Zaleca się by czas leczenia okołooperacyjnego wynosił około 6 miesięcy. Zabieg u chorych w stadium T3 N0 M0 lub zajęcia węzłów chłonnych (cecha N1–N2) bez poprzedzającego leczenia neoadiuwantowego powinien być zarezerwowany wyłącznie dla chorych z przeciwwskazaniami do chemioradioterapii. Wówczas po radykalnym onkologicznie zabiegu po histopatologicznej ocenie stadium zaawansowania T1–T2 N0 M0 chorego wyłącznie się obserwuje, z kolei u chorych w stadium T3 N0 M0 lub chorych T1–T3 N0 M0 rozważa się zastosowanie leczenia adiuwantowego
Rak odbytnicy oceniony przedoperacyjnie jako guz o zaawansowaniu miejscowym T1 lub T2:
- w przypadku klinicznego zaawansowania choroby ocenionego T1–T2 N0 M0 po radykalnym zabiegu chirurgicznym nie jest konieczne leczenie okołoooperacyjne,
- w przypadku zaawansowania choroby ocenionego przed operacją jako T1–T2 N0 M0, ale wyższego patomorfologicznego zaawansowania po operacji ocenionego na T3 N0 M0 lub T1–T4 N1–N2 konieczne jest zastosowanie sześciomiesięcznego leczenia adiuwantowego na które składa się kolejno:
- chemioterapia za pomocą programu FOLFOX albo kapecytabina z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracyl z lub bez leukoworyny,
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracyl z lub bez leukoworyny,
- albo
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- adiuwantowa chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny.
U chorych z guzem o zaawansowaniu T3 N0 M0 z ujemnymi marginesami chirurgicznymi korzyści z radioterapii nie są duże i wystarczającym leczeniem może u nich być wyłącznie chemioterapia. Jednak ze względu na częste niedoszacowanie zajęcia węzłów chłonnych mimo wykonania ERUS zaleca się rutynowe stosowanie radioterapii w stadium T3 N0.
W przypadku zaawansowanej choroby zabieg chirurgiczny może być wykonany bez poprzedzającego leczenia neoadiuwantowego i wówczas terapię uzupełnia się leczeniem adiuwantowym albo zabieg chirurgiczny jest poprzedzony leczeniem neoadiuwantowym, a następnie po zabiegu może być przeprowadzone leczenie adiuwantowe.
W przypadku choroby ocenionej przedoperacyjnie jako nowotwór zaawansowany (T3–T4), z zajęciem węzłów chłonnych (N1–N2) lub lokalnie nieoperacyjny:
- w przypadku choroby lokalnie zaawansowanej T3–T4, lokalnie nieoperacyjnej lub zajęciem węzłów chłonnych (N1–N2) stosuje się leczenie okołooperacyjne w kolejności:
- chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny,
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- zabieg operacyjny,
- albo
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- zabieg operacyjny,
- chemioterapia adiuwantowa za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny.
- w przypadku przeciwwskazań do chemioradioterapii w przypadku zaawansowania choroby T3 N0 lub T1–T4 i N1–N2 lub lokalnie nieoperacyjnej po leczeniu chirurgicznym:
- histopatologicznie rozpoznano stadium zaawansowania pT1–T2 N0 M0 i chorego wyłącznie obserwuje się,
- histopatologicznie rozpoznano stadium zaawansowania pT3–T4 N0 M0 lub pT1–T4 N1–N2 M0 i w dalszym postępowaniu rozważa się leczenie w kolejności:
- chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny,
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny,
- albo
- chemioradioterapia z kapecytabiną albo chemioradioterapia z 5-fluorouracylem lub chemioradioterapia z 5-fluorouracylem z leukoworyną,
- chemioterapia za pomocą programu FOLFOX albo kapecytabiny z lub bez oksaliplatyny (CapeOX) albo 5-fluorouracylu z lub bez leukoworyny.
Radioterapia lub radiochemioterapia jest kluczowym elementem leczenia okołooperacyjnego. Radioterapia lub radiochemioterapia po zabiegu chirurgicznym jest następnie uzupełniana o chemioterapię adiuwantową. Wskazania do radiochemioterapii obejmują dwie grupy chorych: chorych ze znacznym zaawansowaniem nowotworu i chorobą nieoperacyjną oraz chorych o pośrednim zaawansowaniu obejmującym chorobę o zaawansowaniu miejscowym T3 lub zajęciu lokalnych węzłów chłonnych (cecha N+). W chorobie o znacznym zaawansowaniu miejscowym stosuje się chemioradioterapię. W chorobie o pośrednim stopniu zaawansowaniu (T3, N+) może być stosowana radiochemioterapia z dawką około 50 Gy lub tylko krótkotrwała radioterapia z pięcioma dawkami po 5 Gy bez chemioterapii. U starannie wybranych chorych w specjalistycznych ośrodkach może być wykonany zabieg chirurgiczny bez poprzedzającego leczenia neoadiuwantowego.
W zalecaniach NCCN zaleca się stosowanie przedoperacyjnej (neoadiuwantowej) chemioradioterapii u chorych w stadium II i III zaawansowania klinicznego. Pooperacyjna (adiuwantowa) radiochemioterapia jest stosowana u chorych z rakiem odbytnicy początkowo ocenionych jako stadium I, ale po operacji i badaniu histopatologicznym zmienioną kwalifikacją na stadium II lub III. Neoadiuwantowa chemioradioterapia pozwala na redukcje masy guza i ułatwienie przeprowadzenia radykalnego zabiegu oraz zaoszczędzenie zwieraczy odbytu. W kilku badaniach porównano skuteczność radioterapii w leczeniu raka odbytnicy przed operacją i po operacji. Badanie CAO/ARO/AIO-94 wskazuje, że przedoperacyjna radioterapia wiązała się z niższym 10-letnim ryzykiem wznowy wynoszącym 7% w porównaniu do 10% dla leczenia pooperacyjnego, jednak nie stwierdzono różnicy w przeżyciu całkowitym. Z kolei analiza danych SEER na chorych z guzem T3 N0 wskazuje, że radioterapia pooperacyjna jest związana z wydłużeniem przeżycia chorych, a radioterapia przedoperacyjna nie wpływa znacząco na przeżycie. Napromieniowuje się lożę po guzie z 2–5 cm marginesem oraz okoliczne węzły chłonne, w tym przedkrzyżowe i biodrowe wewnętrzne. Zwykle łączna dawka wynosi 45–50 Gy w 25–28 dawkach frakcjonowanych. Po chemioradioterapii konieczna jest przerwa przed zabiegiem operacyjnym.
Chemioradioterapia jest stosowana w leczeniu neoadiuwantowym przed radykalną operacją w raku odbytnicy w zaawansowaniu T3–T4 N0 M0 lub T1–T4 N1–N2 M0 albo w leczeniu adiuwantowym w następstwie patomorfologicznej zmiany oceny stopnia zaawansowania na pT3 lub pN1–N2. Korzyści wynikające z dodania chemioterapii do radioterapii wynikają z nasilenia toksyczności stosowanego promieniowania dla komórek nowotworowych i likwidacji mikroprzerzutów.
W badaniu klinicznym porównano skuteczność samodzielnej przedoperacyjnej (neoadiuwantowej) radioterapii z przedoperacyjną chemioradioterapią z użyciem 5-fluorouracylu z leukoworyną. Chemioradioterapia prowadziła do wyższego odsetka odpowiedzi na leczenie i niższego ryzyka wznowy, kosztem wyższej toksyczności. Nie zaobserwowano różnicy w przeżyciu całkowitym (OS) pomiędzy przedoperacyjną chemioradioterapią i samodzielną przedoperacyjną radioterapią. W innym badaniu oceniono skuteczność chemioterapii przedoperacyjnej i pooperacyjnej do leczenia raka odbytnicy. Wykazano, że przedoperacyjna chemioterapia prowadzi do zmniejszenia masy guza i zmniejszenia zaawansowania zajęcia węzłów chłonnych. Nie obserwowano różnicy w przeżyciu całkowitym leczonych przedoperacyjną i pooperacyjną chemioterapią. Również w dwóch przeglądach systematycznych i jednaj metaanalizie stwierdzono, że dodanie chemioterapii do przedoperacyjnej radioterapii zmniejsza ryzyko nawrotu bez wpływu na przeżycie całkowite.
Wykazano, że kapecytabina jest równoważna 5-fluorouracylowi w leczeniu okołooperacyjnym raka odbytnicy. W badaniu NSABP R-04 porównującego leczenie okołooperacyjne za pomocą 5-fluorouracylu z lub bez oksaliplatyny lub kapecytabiny z lub bez oksaliplatyny nie stwierdzono różnicy w odsetku całkowitej odpowiedzi ocenianej histopatologicznie, odsetka zachowania zwieraczy odbytu i zmniejszenia zaawansowania. W innym badaniu stwierdzono, że kapecytabina w porównaniu do 5-fluorouracylu wywołuje nie gorszy odsetek pięcioletnich przeżyć całkowitych i wykazuje pewną przewagę w wywoływaniu przeżycia wolnego od progresji choroby (DFS). W kilku badaniach wykazano, że dodanie oksaliplatyny do 5-fluorouracylu nie poprawia wyników leczenia. W innym badaniu pomimo niższego odsetka występowania rezydualnej choroby podczas obserwacji nie zaobserwowano zwiększonego przeżycia wolnego od choroby i przeżycia całkowitego. Podobnie dodanie oksaliplatyny do kapecytabiny w przedoperacyjnej chemioradioterapii nie prowadzi do zwiększenia przeżycia całkowitego.
Alternatywnym sposobem przedoperacyjnego leczenia raka odbytnicy jest krótkotrwałe napromienianie (ang. short-course preoperative radiotherapy), polegające na podawaniu 25 Gy w pięciu frakcjach po 5 Gy w ciągu kolejnych pięciu dni bez podawania chemioterapii. Metoda jest często stosowana w Europie, w tym w Polsce, ze względu na większy komfort chorego i niższy koszt leczenia. W randomizowanym polskim badaniu na 312 chorych porównano krótkotrwałą radioterapię z konwencjonalną chemioradioterapią. Zaobserwowano, że konwencjonalna chemioradioterapia nie zwiększa stopnia miejscowej kontroli choroby ani przeżycia całkowitego chorych. Chemioradioterapia wiązała się z większą toksycznością krótkoterminową. Również w badaniu TROG nie stwierdzono częstości nawrotów oraz różnic w odsetku przeżyć całkowitych. Inne badanie wskazuje, że choć długa chemioradioterapia w porównaniu do krótkotrwałej słabiej wpływa na zmniejszenie masy guza, to jednak nie ma różnicy w odsetku uzyskiwanych marginesów mikroskopowo ujemnych od nacieku nowotworowego.
Chemioterapia indukcyjna jest jedną z opcji leczenia okołooperacyjnego. Potencjalne korzyści w chemioterapii indukcyjnej obejmują likwidację mikroprzerzutów, wyższy odsetek odpowiedzi ocenianej histopatologicznie, ułatwienie operacji i poprawę tolerancji chemioterapii. W kilku badaniach oceniono skuteczność chemioterapii indukcyjnej przeprowadzanej przed chemioradioterapią przedooperacyjną i operacją raka odbytnicy. W małym badaniu wykazano, że dodanie chemioterapii indukcyjnej za pomocą programu CapeOX składającego się z kapecytabiny i oksaliplatyny osiągnięto podobny odsetek odpowiedzi przy mniejszej toksyczności leczenia. Inne badanie wykazało podobną skuteczność w leczeniu adiuwantowym 5-fluorouracylu i FOLFOX.
Adiuwantowa chemioterapia jest wskazana u wszystkich chorych w stadium II i III po neoadiuwantowej chemioradioterapii i radykalnym zabiegu chirurgicznym, jeśli nie otrzymali wcześniej chemioterapii neoadiuwantowej. Niewiele badań oceniło skuteczność tego postępowania i jego rola nie jest w pełni zdefiniowana. W wytycznych NCCN w leczeniu adiuwantowym w raku odbytnicy zaleca się stosowanie programu FOLFOX lub CapeOX jako preferowane metody leczenia. Stosowane mogą być również 5-fluorouracyl z leukoworyną, program FLOX lub kapecytabina. W badaniu klinicznym wykazano, że adiuwantowa chemioterapia z użyciem 5-fluorouracylu po chemioterapii neoadiuwantowej nie redukowała ryzyka wznowy ani nie zwiększa odsetka przeżyć całkowitych (OS), jednak zwiększała odsetek przeżyć wolnych od choroby (DFS). W długoterminowej obserwacji w ramach tego badania również nie zaobserwowano wydłużenia przeżycia całkowitego, a wydłużenie przeżycia wolnego od choroby. W metaanalizie na łącznie 9785 chorych z rakiem odbytnicy wykazano, że dodanie 5-fluorouracylu do leczenia pooperacyjnego wydłuża przeżycie całkowite (OS) i przeżycie wolne od choroby (DFS). W badaniu klinicznym ADORE porównano leczenie adiuwantowe za pomocą 5-fluorouracylu i programu FOLFOX. Wykazano, że program FOLFOX wywołuje wyższy odsetek przeżyć wolnych od choroby wynoszący 71,6% w porównaniu do leczonych 5-fluorouracylem, którzy osiągnęli 62,9% odsetek przeżyć wolnych od choroby.
Leczenie nawrotu choroby po operacji radykalnej onkologicznie
Nawrót miejscowy lub pojawienie się przerzutów odległych po radykalnej onkologicznie operacji dotyczy 15–40% chorych. Nawrót częściej pojawia się w przypadku raka odbytnicy niż raka w okrężnicy, co jest związane z większą trudnością uzyskania odpowiedniego marginesu resekcji. Guzy odbytnicy wykazują tendencje do nawrotu miejscowego, a guzy okrężnicy do utworzenia przerzutów odległych. Leczenie adiuwantowe zmniejsza ryzyko nawrotu o około 40% i w ośmioletniej obserwacji 35% chorych doświadczyło nawrotu choroby nowotworowej. Odsetek nawrotów po 1 roku od leczenia wynosił 12%, po dwóch latach od leczenia 14%, po trzech 8%, a po czterech i pięciu latach od leczenia odpowiednio 8% i 3%, 80% nawrotów pojawia się w ciągu pierwszych trzech lat od operacji. Ryzyko nawrotu jest znacząco większe, gdy stwierdza się margines chirurgiczny z obecnym naciekiem nowotworowym (resekcje R1 i R2). W badaniu obserwacyjnym stwierdzono 40% ryzyko nawrotu choroby po resekcji z naciekiem nowotworowym marginesu resekcji, podczas gdy u chorych z ujemnym marginesem resekcji ryzyko nawrotu wynosiło 10%.
W przypadku miejscowego nawrotu w części przypadków możliwe jest wykonanie powtórnej operacji, co poprawia wyniki lokalnej kontroli choroby i może poprawiać przeżycie całkowite leczonych. Celem reoperacji jest usunięcie nawrotowego guza wraz z marginesem zdrowych tkanek, a operacja powinna być połączona z leczeniem adiuwantowym. Zwykle uzyskanie pożądanych marginesów zdrowych tkanek jest bardzo trudne, co wymaga rozległego zakresu zabiegu. Decyzja o wykonaniu powtórnej operacji jest bardzo trudna, ponieważ może być oparta jedynie o pośrednie przesłanki wskazujące na nawrót obejmujące wzrost stężenia CEA, stwierdzenie zwiększonego wychwytu znacznika w PET czy niewielkie zmiany widoczne w tomografii komputerowej.
Leczenie nawrotu w postaci przerzutu odległego jest leczone na tych samych zasadach co choroba z przerzutami.
Leczenie choroby z przerzutami
Około 50–60% chorych z rakiem jelita grubego rozwija przerzuty odległe. Podstawą leczenia choroby z przerzutami jest chemioterapia. U niewielkiej części chorych przerzuty mogą być usunięte operacyjnie, a mała grupa chorych z początkowo technicznie nieoperacyjnymi pojedynczymi przerzutami będzie mogła zostać zakwalifikowana do zabiegu po chemioterapii. Leczenie różni się w zależności od przyjętej optymalnej strategii leczenia choroby zaawansowanej klinicznie i chorzy w zależności od założonych celów leczenia mogą być podzieleni na cztery grupy kliniczne:
- chorzy z pierwotnie operacyjnymi przerzutami do wątroby lub płuc bez przeciwwskazań do zabiegu – u chorych z pojedynczymi, korzystnie położonymi przerzutami wykonuje się ich resekcje z zachowaniem odpowiednio marginesu zdrowych tkanek. Zabieg jest uzupełniony adiuwantową chemioterapią lub poprzedzony neoadiuwantową chemioterapią.
- chorzy z potencjalnie operacyjnymi przerzutami – celem leczenia jest zmniejszenie wielkości przerzutów celem umożliwienia ewentualnej operacji i długotrwałego przeżycia chorych. W leczeniu wykorzystuje się najaktywniejsze intensywne programy chemioterapii z dwoma lub trzema lekami z lub bez użycia leków celowanych.
- chorzy z uogólnioną chorobą lub przerzutami ze zbyt małym prawdopodobieństwem wykonania udanej resekcji – celem leczenia jest maksymalne wydłużenie przeżycia chorych, w tym celu stosuje się intensywną chemioterapię za pomocą połączenia dwóch lub trzech leków z lub bez leków celowanych. U chorych odpowiadających na leczenie można powtórnie rozważyć kwalifikację do leczenia zabiegowego pojedynczych przerzutów.
- chorzy z chorobą uogólnioną leczeni paliatywnie – podstawowym celem leczenia jest złagodzenie objawów choroby, poprawa jakości życia i hamowanie progresji choroby, aby maksymalnie wydłużyć przeżycie leczonych. Stosuje się mniej toksyczne programy lecznicze za pomocą pojedynczych leków lub ich kombinacji.
Leczenie ogólnoustrojowe wydłuża przeżycie całkowite leczonych. Wybór leczenia zależy od stanu sprawności chorego, współistniejących chorób, występowania objawów choroby nowotworowej, szybkości progresji choroby i wcześniejszego leczenia. U chorych w dobrym stanie sprawności stosuje się chemioterapię opartą o fluoropirymidynę (5-fluorouracyl, kapecytabina) w połączeniu z oksaliplatyną lub irynotekanem. Wykorzystuje się programy wielolekowe: FOLFOX, CapeOX (XELOX), FOLFIRI i FOLFOXIRI. Chemioterapia może być kojarzona z inhibitorami EGFR (cetuksymab, panitumumab) lub inhibitorami angiogenezy (bewacyzumab).
Przewaga wielolekowej chemioterapii w wydłużeniu przeżycia całkowitego jest mniej wyraźna i przeżycie zależy przede wszystkim od samego zastosowania aktywnych w chorobie leków, a w mniejszy sposób od ich kojarzenia w programy wielolekowe. Jednak programy wielolekowe w większym odsetku wywołują odpowiedź obiektywną i bardziej wydłużają przeżycie wolne od progresji choroby. U chorych starszych, ze współistniejącymi istotnymi chorobami, w gorszym stanie sprawności, z mniejszą dynamiką wzrostu choroby uzasadnione jest zastosowanie terapii sekwencyjnej z przynajmniej dwoma rzutami leczenia, którą charakteryzuje mniejsza toksyczność. Optymalny czas trwania chemioterapii jest kwestią sporną. Typowo leczenie kontynuuje się do czasu wystąpienia progresji lub pojawienia się nieakceptowalnej toksyczności. Opcją jest także czasowe przerwanie intensywnego leczenia wielolekowego lub przejście na mniej intensywne leczenie podtrzymujące w momencie uzyskania kontroli i stabilizacji zmian nowotworowych, a następnie powtórne wprowadzenie leczenia skojarzonego w momencie progresji choroby. Leczenie podtrzymujące po czasowym przerwaniu intensywnej chemioterapii wielolekowej jest złożone z 5-fluorouracylu z lub bez bewacyzumabu. Ważna jest ciągła kontynuacja opieki nad chorymi celem zapewnienia i realizacji najlepszej strategii leczenia.
Leczenie potencjalnie operacyjnych przerzutów
- Metastazektomia
Metastazektomia jest to operacja wycięcia przerzutów. Starannie wybrani chorzy z rakiem jelita grubego z pojedynczymi, korzystnie zlokalizowanymi przerzutami do wątroby mogą być leczeni operacyjnie w celu poprawy rokowania. Chorzy z nieoperacyjnymi przerzutami lub nieresekcyjnym guzem pierwotnym nie kwalifikują się do metastazektomii. Na podobnych zasadach mogą być leczone przerzuty do płuc.
Operacja może być wykonana jednocześnie z wycięciem guza pierwotnego, a następnie uzupełniona chemioterapią adiuwantową lub jednoetapowa operacja jest poprzedzona chemioterapią neoadiuwantową lub wycięcie guza pierwotnego uzupełnia się leczeniem adiuwantowym, a następnie chorego poddaje się operacji usunięcia przerzutów. Wykonuje się operacje nieanatomiczne (resekcje klinowe), hemihepatektomie i segmentektomie. W przypadku nacieku na istotne naczynie może być konieczna jego resekcja z odtworzeniem.
Warunkiem przeprowadzenia operacji jest możliwość resekcji przerzutów z uzyskaniem ujemnych mikroskopowo marginesów resekcji (resekcja R0) oraz utrzymanie koniecznych funkcji metabolicznych przez pozostały miąższ wątroby. Konieczne jest zachowanie 1 cm marginesu resekcji. Nie przeprowadza się metastazektomii w przypadku obecności nieresekowalnych przerzutów, ryzyka wystąpienia niewydolności wątroby po operacji, obecności niekontrolowanej choroby pozawątrobowej, szerokiego zajęcia węzłów chłonnych i obecności przerzutów do mózgu lub kości. Paliatywna operacja wycięcia przerzutów jest rzadko wskazana i kluczowe w ich leczeniu jest leczenie ogólnoustrojowe.
Leczenie przerzutów do wątroby poprawia rokowanie. Mediana odsetka pięcioletniego przeżycia całkowitego leczonych resekcją przerzutów w różnych badaniach wynosi 20–40%. Jednak chorzy z pojedynczym przerzutem do wątroby osiągają lepsze wyniki i badania wskazują na medianę pięcioletniego przeżycia całkowitego wynoszącą 70%.
Podobne zasady leczenia obowiązują w przypadku przerzutów do płuc. Warunkiem operacji jest założenie radykalnej resekcji mikroskopowo wolnej od nacieku nowotworu (resekcja R0), stan chorego pozwala na zabieg oraz nie występują przerzuty pozapłucne, ewentualnie mogą być obecne, ale muszą być kontrolowane za pomocą leczenia chirurgicznego lub innej formy terapii. Nie ma randomizowanych badań oceniających skuteczność chirurgicznego leczenia przerzutów w płucach. Niektóre badania sugerują, że korzyści przynosi jednoczesne chirurgiczne leczenie przerzutów w wątrobie i pozawątrobowych.
- Leczenie potencjalnie resekowalnych nieoperacyjnych przerzutów (konwersja do operacyjności)
Większość chorych z przerzutami nie kwalifikuje się do operacji. Część chorych z izolowanymi przerzutami do wątroby lub płuc nie kwalifikuje się do zabiegu z powodu nacieku ważnych struktur i może ona odnieść korzyści z chemioterapii, która może wywołać regresję przerzutów przywracając ich techniczną operacyjność. Chorzy z dużą liczbą przerzutów w wątrobie lub płucach nie kwalifikują się do operacji poprzedzonej chemioterapią, ponieważ szansa na uzyskanie radykalnej resekcji przerzutów jest niewielka, a sama chemioterapia rzadko pozwala na całkowite zniszczenie przerzutu. W próbie konwersji do zmian operacyjnych może być użyty każdy aktywny schemat stosowany w leczeniu choroby uogólnionej, ponieważ głównym celem nie jest likwidacja mikroprzerzutów, lecz uzyskanie regresji „widocznych” przerzutów.
W leczeniu stosuje się program FOLFIRI z lub bez bewacyzumabu, pogram FOLFOX z lub bez bewacyzumabu, program CapeOX z lub bez bewacyzumabu, program FOLFIRI z lub bez panitumumabu albo cetuksymabu, program FOLFOX z lub bez panitumumabu albo cetuksymabu, program FOLFOXIRI z lub bez bewacyzumabu.
W badaniu II fazy oceniono przydatność programu FOLFOX w leczeniu nieoperacyjnych przerzutów do wątroby. Wykazano, że u 60% leczonych objętość guza uległa zmniejszeniu i u 40% z wszystkich leczonych chemioterapia umożliwiła radykalny onkologicznie zabieg. W badaniu na 1104 chorych z nieoperacyjnymi przerzutami do wątroby leczonych chemioterapią opartej głównie na oksaliplatynie leczenie u 12,5% chorych pozwoliło wykonać wtórną resekcję przerzutów.
W dwóch badaniach porównano skuteczność programów FOLFOX i FOLFOXIRI (5-fluorouracyl, leukoworyna, oksaliplatyna i irynotekan) w leczeniu chorych z nieoperacyjnymi przerzutami. W obu badaniach u chorych leczonych FOLFOXIRI zaobserwowano wzrost odsetka uzyskanych radykalnych resekcji w porównaniu z FOLFOX, w badaniu włoskim z 6% do 15%, a w badaniu greckim z 4% do 10%. W badaniu greckim ponadto zaobserwowano wyższą medianę przeżycia całkowitego leczonych schematem FOLFOXIRI wynoszącą 24,4 miesiąca w porównaniu z medianą przeżycia leczonych programem FOLFOX wynoszącą 16,7 miesiąca.
W kilku badaniach oceniono skuteczność dodania inhibitora EGFR do schematu FOLFOXIRI lub FOLFOX w konwersji choroby nieoperacyjnej do operacyjnej. W badaniu CELIM porównano połączenie cetuksymabem z programem FOLFOXIRI lub FOLFOX. Zaobserwowano, że dodanie cetuksymabu wywołuje wzrost odsetka wykonanych resekcji z 32% do 60%. Nie zaobserwowano różnicy przeżycia całkowitego pomiędzy grupami chorych leczonych cetuksymabem ze schematem FOLFOXIRI lub cetuksymabem z programem FOLFOX. Również w innym badaniu porównującym połączenie cetuksymabu z programem FOLFOXIRI lub FOLFOX u chorych z nieoperacyjnymi przerzutami do wątroby dodanie cetuksymabu do chemioterapii prowadziło do większego odsetka uzyskanych resekcji, ponadto przeżycie chorych otrzymujących cetuksymab było wyższe niż chorych leczonych bez tego leku. Metaanaliza czterech badań wykazała, że dodanie cetuksymabu lub panitumumabu do chemioterapii znacząco zwiększa przeżycie całkowite chorych i odsetek wykonanych resekcji.
Rola bewacyzumabu w konwersji nieoperacyjnych przerzutów do operacyjnych nie jest jasna. Badania sugerują, że dodanie bewacyzumabu do schematów opartych na irynotekanie zwiększa odsetek odpowiedzi na leczenie. Z drugiej strony duże badanie wskazuje na brak korzyści dodania bewacyzumabu do chemioterapii.
- Chemioterapia neoadiuwantowa i adiuwantowa operacyjnych przerzutów
U wszystkich chorych z chorobą przerzutową (stadium IV) zaleca się stosowanie leczenia ogólnoustrojowego, które może zostać wdrożone przed operacją lub po zabiegu. Programy lecznicze nie różnią się od stosowanych w leczeniu choroby zaawansowanej i przerzutowej. Sekwencja leczenia farmakologicznego i operacyjnego jest niejasna. Potencjalnie chemioterapia neoadiuwantowa pozwala na wcześniejsze leczenie mikroprzerzutów i określenie wrażliwości na leczenie. Wadą postępowania jest ryzyko progresji w trakcie leczenia uniemożliwiające leczenie operacyjne i, paradoksalnie, uzyskanie pełnej odpowiedzi utrudniającej ocenę ustalenia zakresu operacji.
Leczenie choroby z nieoperacyjnymi przerzutami
Leczenie nieoperacyjnej choroby z przerzutami jest oparte o chemioterapię. Chemioterapia na tym etapie zaawansowania choroby nie umożliwia wyleczenia, jednak poprzez kontrolę wzrostu guza i objawów choroby prowadzi do przedłużenia przeżycia chorych oraz przedłużenia czasu do progresji choroby. Wybór leczenia jest uwarunkowany założonymi celami leczenia, stanem sprawności chorego, obecnością współistniejących chorób i profilem toksyczności terapii. Programy leczenia mogą być złożone z jednego leku lub kombinacji kilku leków. W leczeniu pierwszego rzutu u chorych kwalifikujących się do intensywnego leczenia stosuje się jeden z pięciu schematów wielolekowych: program FOLFOX z lub bez bewacyzumabu albo cetuksymabu/panitumumabu, program CapeOX, program FOLFIRI z lub bez bewacyzumabu albo cetuksymabu/panitumumabu, program FOLFOXIRI z lub bez bewacyzumabu i 5-fluorouracyl z leukoworyną albo kapecytabinę. Badania porównujące skuteczność leczenia pierwszej linii w intensywnej chemioterapii nie wykazały znaczącej przewagi żadnego z tych pięciu programów leczenia i żaden z nich nie jest preferowany wobec pozostałych programów pierwszej linii.
- FOLFOX
Program FOLFOX jest połączeniem 5-fluorouracylu, leukoworyny i oksaliplatyny. Schemat FOLFOX może być stosowany samodzielnie lub w połączeniu z bewacyzumabem lub w połączeniu z inhibitorami EGFR (cetyksymab, panitumumab) w leczeniu pierwszego rzutu u chorych z zaawansowaną chorobą w ramach intensywnej chemioterapii.
W badaniu III fazy na około 200 chorych porównano leczenie za pomocą 5-fluorouracylu z leukoworyną z lub bez dodania oksaliplatyny. Zaobserwowano, że w grupie chorych otrzymujących chemioterapię z dodaniem oksaliplatyny wywołuje ona wyższy odsetek odpowiedzi obiektywnych wynoszący 53% w porównaniu do 16% oraz wyższą medianę przeżycia wolnego od progresji wynoszącą w grupie leczonych 5-fluorouracylem z oksaliplatyną 8,7 miesiąca i 7,4 miesiąca w grupie bez oksaliplatyny. Połączenia 5-fluorouracylu, leukoworyny i oksaliplatyny w schemat FOLFOX1 i 2 nigdy nie oceniono w badaniach z randomizacją. Programy FOLFOX3 i FOLFOX4 w badaniu klinicznym wykazały skuteczność u chorych z progresją po leczeniu 5-fluorouracylem. Program FOLFOX4 wywołał nieco wyższy odsetek odpowiedzi i niższy stopień toksyczności niż FOLFOX3. W innym badaniu porównano skuteczność schematu LV5FU2 (5-fluorouracyl, leukoworyna) z programem FOLFOX4 w leczeniu wcześniej nie leczonych chorych z przerzutowym rakiem jelita grubego. Wykazano, że chorzy leczeni schematem FOLFOX4 wykazywali wyższy odsetek odpowiedzi obiektywnych niż leczeni LV5FU2, który wynosił odpowiednio 51% i 22%, a także wyższą medianę czasu wolnego od progresji (PFS) wynoszącą 9 miesięcy dla chorych leczonych FOLFOX4 w porównaniu do 6,2 miesiąca u leczonych LV5FU2. Przewaga przeżycia całkowitego u leczonych FOLFOX4 nie osiągnęła istotności statystycznej.
W badaniu EORTC 40983 oceniono skuteczność chemioterapii FOLFOX zastosowanej okołooperacyjnie u chorych zakwalifikowanych do resekcji przerzutów do wątroby. Wykazano wzrost odsetka przeżyć wolnych od choroby (DFS). Nie zaobserwowano różnicy w przeżyciu całkowitym (OS) pomiędzy leczonych wyłącznie chirurgicznie i leczonych chirurgicznie z chemioterapią w programie FOLFOX, choć mogło być to spowodowane przez częstsze stosowanie chemioterapii II-rzutu w grupie leczonych wyłącznie chirurgicznie
Schemat FOLFOX stosowany bez połączenia z lekami celowanymi nie ma przewagi nad programem CapeOX (XELOX) i oba programy mogą być stosowane zamiennie.
- CapeOX (XELOX)
Schemat CapeOX (XELOX) jest połączeniem kapecytabiny i oksaliplatyny. Może być stosowany w leczeniu pierwszego rzutu u chorych z chorobą zaawansowaną w ramach intensywnej chemioterapii. Do programu CapeOX może zostać dodany bewacyzumab.
W dużym badaniu III fazy porównano skuteczność leczenia za pomocą programu FOLFOX oraz CapeOX u chorych z przerzutowym rakiem jelita grubego i zaobserwowano, że leczenie programem CapeOX i FOLFOX wywołuje podobne mediany przeżycia wolnego od progresji (PFS) oraz podobne mediany przeżycia całkowitego (OS). W metaanalizie 7 badań na łącznie 3603 chorych z przerzutowym rakiem jelita grubego wykazano, że u leczonych programami FOLFOX i CapeOX mediana czasu przeżycia wolnego od progresji (PFS) i przeżycia całkowitego (OS) nie różnią się statystycznie.
- FOLFIRI
Schemat FOLFIRI jest połączeniem 5-fluorouracylu, leukoworyny i irynotekanu. Schemat FOLFIRI może być stosowany samodzielnie lub w połączeniu z bewacyzumabem lub w połączeniu z inhibitorami EGFR (cetyksymab, panitumumab) w leczeniu pierwszego rzutu u chorych z chorobą zaawansowaną w ramach intensywnej chemioterapii. Program FOLFIRI może być łączony z bewacyzumabem lub inhibitorami EGFR.
W badaniu klinicznym porównano skuteczność programu FOLFIRI i FOLFOX6, chorych losowo przydzielano do leczenia programem FOLFOX lub FOLFIRI, a po wystąpieniu progresji podawano drugi badany schemat jako leczenie drugiej linii. Oba programy wykazały dość podobne wyniki. Program FOLFOX wywołał odpowiedź u 54% leczonych, mediana przeżycia wolnego od progresji (PFS) wynosiła 8,0 miesięcy, z kolei schemat FOLFIRI wywoływał odpowiedź obiektywną u 56% leczonych, a mediana przeżycia wolnego od progresji wynosiła 8,5 miesiąca. Podobnie w kolejnym badaniu porównującym skuteczność programów FOLFIRI i FOLFOX nie zaobserwowano różnicy pomiędzy odsetkami odpowiedzi obiektywnych, czasem wolnym od progresji choroby (DFS) i medianami przeżycia całkowitego (OS).
- FOLFOXIRI
Schemat FOLFOXIRI jest połączeniem 5-fluorouracylu, leukoworyny, oksaliplatyny i irynotekanu. Schemat FOLFOXIRI może być stosowany samodzielnie lub w połączeniu z bewacyzumabem w leczeniu pierwszego rzutu u chorych z chorobą zaawansowaną w ramach intensywnej chemioterapii.
W badaniu GONO u 244 chorych z zaawansowanym rakiem jelita grubego porównano leczenie schematem FOLFOXIRI i FOLFOX. Zaobserwowano, że leczeni programem FOLFOXIRI osiągnęli wyższą medianę przeżycia wolnego od progresji choroby wynoszącą 9,8 miesiąca w porównaniu do 6,9 miesiąca u leczonych programem FOLFOX oraz wyższą medianę przeżycia całkowitego wynoszącą 22,6 miesiąca w porównaniu do 16,7 miesiąca dla leczonych FOLFOX. Z kolei w badaniu HORG nie stwierdzono istotnej statystycznie różnicy przeżycia całkowitego pomiędzy leczonymi programem FOLFOXIRI i FOLFOX. Program FOLFOXIRI wykazuje większą toksyczność niż FOLFOX.
- 5-fluorouracyl z leukoworyną lub kapecytabina
Połączenie 5-fluorouracylu z leukoworyną, monoterapia kapecytabiną, połączenie 5-fluorouracylu z leukoworyną i bewacyzumabem i połączenie kapecytabiny z bewacyzumabem mogą być stosowane w leczeniu pierwszego rzutu u chorych ze słabszą tolerancją bardziej agresywnego i toksycznego leczenia.
W analizie dwóch badań porównujących samodzielne leczenie chirurgiczne przerzutów z zabiegiem uzupełnionym chemioterapią za pomocą 5-fluorouracylu z leukoworyną wykazano, że adiuwantowa chemioterapia po wycięciu przerzutów wydłuża przeżycie wolne od progresji choroby (PFS), którego mediana u chorych leczonych adiuwantową chemioterapią wynosiła 27,9 miesiąca, a wyłącznie metastazektomią 18,8 miesiąca. Wykazano, że dodanie bewacyzumabu do kapecytabiny wydłuża przeżycie wolne od progresji choroby (PFS) w porównaniu do monoterapii kapecytabiną.
- Bewacyzumab
Bewacyzumab jest przeciwciałem monoklonalnym wiążącym się z czynnikiem wzrostu śródbłonka naczyniowego (VEGF), co hamuje tworzenie naczyń stymulowane przez rozrastający się nowotwór i uzależniony od angiogenezy wzrost guza i przerzutów. Bewacyzumab dodany do chemioterapii pierwszej linii oferuje umiarkowane korzyści kliniczne. Może być dodany do programu FOLFOX, CapeOX (XELOX), FOLFIRI, FOLFOXIRI, 5-fluorouracylu z leukoworyną lub kapecytabiny. Nie zaleca się stosowania bewacyzumabu w leczeniu uzupełniającym po resekcji przerzutów.
Kilka badań wskazuje, że dodanie bewacyzumabu do 5-fluorouracylu i leukoworyny wydłuża przeżycie całkowite (OS) leczonych. W analizie kilku badań wykazano, że dodanie bewacyzumabu do 5-fluorouracylu i leukoworyny wydłuża medianę przeżycia całkowitego. Chorzy otrzymujący leczenie z bewacyzumabem osiągnęli medianę przeżycia całkowitego wynoszącą 17,9 miesiąca, a chorzy leczeni bez bewacyzumabu 14,6 miesiąca. Z kolei w badaniu na 1400 chorych z przerzutowym rakiem jelita grubego oceniającym skuteczność dodania bewacyzumabu do programów leczniczych opartych na oksaliplatynie (FOLFOX4 i CapeOX) zaobserwowano wydłużenie przeżycia wolnego od progresji choroby (PFS) o 1,4 miesiąca, ale nie stwierdzono istotnego statystycznie wydłużenia przeżycia całkowitego (OS). Nie ma randomizowanych badań porównujących skuteczność programu FOLFIRI z lub bez bewacyzumabu. Kilka metaanaliz wskazuje, że dodanie bewacyzumabu do chemioterapii powoduje wydłużenie mediany przeżycia wolnego od progresji choroby (PFS) i niewielkie wydłużenie mediany przeżycia całkowitego.
Dodanie bewacyzumabu do chemioterapii wiąże się z wyższą śmiertelnością związaną z leczeniem. Początkowe badania przedkliniczne sugerowały, że przerwanie leczenia bewacyzumabem może spowodować przyspieszenie nawrotu połączonego z jego większą agresywnością. Późniejsze badania kliniczne nie potwierdziły istnienia efektu z odbicia.
- Inhibitory EGFR
Cetuksymab i panitumumab są przeciwciałami monoklonalnymi skierowanymi przeciw receptorowi naskórkowego czynnika wzrostu (EGF), który aktywuje szlaki MAPK/ERK i PI3K/AKT/mTOR, które z kolei zwiększają zdolność do proliferacji, chronią komórki przed apoptozą, ułatwiają migrację komórek i promują angiogenezę. Inhibitory EGFR mogą być stosowane w leczeniu skojarzonym z programami FOLFOX i FOLFIRI pierwszego rzutu u chorych z chorobą zaawansowaną w ramach intensywnej chemioterapii. Inhibitory EGFR lub bewacyzumabu dodane do programów chemioterapii pierwszej linii są równoważnymi opcjami terapeutycznymi.
Cetuksymab i panitumumab wykazują skuteczność tylko u 10–20% chorych, mimo że nadmierną ekspresję receptora EGF stwierdza się w 25–80% przypadków raka jelita grubego. Jednocześnie ocena nadekspresji EGFR nie pozwala przewidzieć skuteczności leczenia, dlatego nie zaleca się jej rutynowego oznaczania, a ujemny wynik badania nie dyskwalifikuje chorego z leczenia tymi lekami. Zaleca się oznaczenie mutacji KRAS i NRAS, ponieważ chorzy z rozpoznaną mutacją KRAS lub NRAS nie odnoszą korzyści z leczenia inhibitorami EGFR. Również niektóre mutacje BRAF powodują oporność na leczenie inhibitorami EGFR i zaleca się oznaczenie mutacji BRAF, choć wartość predykcyjna oznaczenia jest niepewna.
Skuteczność cetuksymabu dodanego do programu FOLFOX oceniono w kilku badaniach klinicznych. W badaniu OPUS wykazano, że dodanie cetuksymabu do programu FOLFOX zwiększa odsetek odpowiedzi obiektywnych oraz wydłuża czas przeżycia wolnego od progresji (PFS). Nie zaobserwowano wydłużenia mediany przeżycia całkowitego. Z kolei w badaniu MRC COIN nie potwierdzono korzyści w wydłużeniu czasu przeżycia wolnego od progresji (PFS) po dodaniu cetuksymabu do schematu FOLFOX lub CapeOX. Jednak analiza zbiorcza wyników tego badania i badania OPUS wskazuje na korzyści w odsetku odpowiedzi obiektywnych i czasu wolnego od progresji choroby (PFS). W dużym badaniu porównano leczenie schematem FOLFOX z cetyksymabem z leczeniem programem FOLFOX z bewacyzumabem i wykazano, że przeżycie całkowite jest zbliżone w obu metodach leczenia.
W badaniu CRYSTAL zbadano skuteczność połączenia cetuksymabu z programem FOLFIRI w porównaniu do schematu FOLFIRI stosowanego bez kojarzenia z inhibitorami EGFR. U chorych leczonych cetuksymabem z FOLFIRI stwierdzono wydłużenie przeżycia wolnego od progresji choroby oraz przeżycia całkowitego w stosunku do FOLFIRI stosowanego samodzielnie. Jednak połączenie nie poprawia jakości życia leczonych. W innym badaniu porównano skuteczność leczenia za pomocą panitumumabu i programu FOLFIRI z leczeniem za pomocą FOLFOX z bewacyzumabem. Zaobserwowano, że panitumumab z FOLFIRI wywołuje lepszą poprawę przeżycia całkowitego niż bewacyzumab z FOLFIRI.
Skuteczność panitumumabu w połączeniu z programem FOLFOX oceniono w dużym randomizowanym badaniu. Zaobserwowano, że dodanie panitumumabu do schematu FOLFOX wywołuje wydłużenie przeżycia wolnego od progresji (PFS) oraz wydłużenie przeżycia całkowitego (OS). W małym badaniu oceniającym skuteczność leczenia za pomocą panitumumabu z FOLFOX i bewacyzumabu z FOLFOX stwierdzono poprawę przeżycia całkowitego w grupie leczonych za pomocą panitumumabu z FOLFOX.
Skuteczność panitumumabu w połączeniu z programem FOLFIRI oceniono jedynie jako leczenie drugiej linii. W kilku badaniach stwierdzono wydłużenie czasu wolnego od progresji, a w jednym badaniu zaobserwowano wydłużenie przeżycia wolnego od progresji choroby.
- Leczenie II linii
Leczenie po progresji choroby zależy od zastosowanego leczenia pierwszej linii:
- chorzy, którzy w pierwszej linii leczenia byli leczeni programem FOLFOX lub CapeOX (XELOX) w drugiej linii terapii mogą być leczeni za pomocą programu FOLFIRI lub irynotekanu stosowanej samodzielnie lub w połączeniach z lekami celowanymi: bewacyzumabem, cetuksymabem, panitumumabem, ramucirumabem lub afliberceptem. Ze względu na koszty i profil toksyczności preferowanym lekiem anty-VEGF jest bewacyzumab,
- chorzy, którzy w pierwszej linii leczenia byli leczeni programem FOLFIRI w drugiej linii terapii mogą być leczeni za pomocą programu FOLFOX lub CapeOX (XELOX) podawanych samodzielnie lub w połączeniu z bewacyzumabem, irynotekanem w połączeniu z cetuksymabem lub panitumumabem, ewentualnie cetuksymabem lub panitumumabem w monoterapii,
- chorzy, którzy w pierwszej linii leczenia byli leczeni za pomocą 5-fluorouracylu lub kapecytabiny bez połączenia z oksaliplatyną lub irynotekanem w drugiej linii terapii mogą być leczeni za pomocą programu FOLFOX, CapeOX, FOLFIRI, irynotekanu w monoterapii lub irynotekanu z oksaliplatyną (IRINOX),
- chorzy, którzy w pierwszej linii leczenia byli leczeni programem FOLFOXIRI w drugiej linii terapii mogą być leczeni za pomocą połączenia irynotekanu z cetuksymabem lub panitumumabem, monoterapii cetuksymabem lub panitumumabem.
Irynotekan w porównaniu do 5-fluorouracylu bardziej wydłuża przeżycie całkowite (OS) i przeżycie wolne od progresji choroby (PFS). Nie stwierdzono różnicy przeżycia całkowitego pomiędzy chorymi leczonymi irynotekanem w monoterapii lub programem FOLFOX. Metaanaliza wykazała, że dodanie leku celowanego do klasycznej chemioterapii poprawia wyniki leczenia kosztem wyższej toksyczności.
Panitumumab w leczeniu drugiej linii w monoterapii poprawia przeżycie wolne od progresji choroby w porównaniu do najlepszej terapii wspomagającej. Panitumumab dodany do programu FOLFIRI wydłuża przeżycie wolne od progresji choroby w stosunku do samodzielnego leczenia za pomocą FOLFIRI. Cetuksymab w leczeniu drugiej linii w monoterapii lub w połączeniu z irynotekanem wydłuża przeżycie wolne od progresji choroby.
W badaniu ML18147 bewacyzumab dodany do chemioterapii II linii przedłużał przeżycie wolne od progresji choroby i nieznacznie wpływał na wydłużenie przeżycia całkowitego, podobnie w badaniu BEBYP bewacyzumab wydłużał przeżycie wolne od progresji choroby. Kontynuacja leczenia bewacyzumabem mimo progresji po leczeniu połączeniem chemioterapii I linii i bewacyzumabu może poprawiać przeżycie całkowite.
Aflibercept jest przeciwciałem wiążącym się z czynnikiem wzrostu śródbłonka naczyniowego (VEGF). W badaniu VELOUR aflibercept dodany do programu FOLFIRI wydłużał przeżycie wolne od progresji oraz przeżycie całkowite. Lek wykazuje aktywność tylko w połączeniu z programem FOLFIRI u chorych nie leczonych wcześniej za pomocą tego schematu.
Ramucirumab jest przeciwciałem skierowanym przeciw receptorowi VEGFR2. W badaniu RAISE wykazano, że dodanie ramucirumabu do schematu FOLFIRI powoduje wydłużenie przeżycia całkowitego w stosunku do leczenia za pomocą wyłącznie programu FOLFIRI.
Leczenie paliatywne i wspomagające
Leczenie paliatywne jest to terapia ukierunkowana na poprawę jakości życia poprzez walkę z uciążliwymi objawami choroby nowotworowej.
- Niedrożność jelita grubego
Niedrożność jelita pojawia się w 10–25% przypadków raka jelita grubego. Niedrożność częściej pojawia się w guzach esicy i w okolicy zgięcia śledzionowego, co jest następstwem ich fizjologicznie węższego światła. Szacuje się, że niedrożność jest spowodowana guzem zlokalizowanym w 11% przypadków w kątnicy, wstępnicy w 5% przypadków, zgięcia wątrobowego w 3% przypadków, poprzecznicy w 11% przypadków, zgięcia śledzionowego w 12% przypadków, zstępnicy w 10% przypadków, esicy w 35% przypadków i odbytnicy w 13% przypadków. Niedrożność w raku jelita grubego zwykle jest efektem stopniowego zarastania światła narządu. Perforacja z powodu narastającego obrzęku i martwicy ściany jelita towarzyszy 3–8% przypadków niedrożności. Niedrożność jelita grubego pogarsza rokowanie.
Typ i nasilenie objawów zależą od progresji od niedrożności przepuszczającej do pełnej niedrożności. Typowo objawy mają charakter powolnie narastający, a dolegliwości mają trudny do określenia początek. Niepełna niedrożność objawia się bólem brzucha, wzdęciami, zaparciami ze zmniejszeniem kalibru stolca, możliwe są naprzemienne biegunki i zaparcia. W późniejszym etapie pojawia się pełna niedrożność, w której występuje kolkowy, a później również tępy ból brzucha, nudności i wymioty, wzdęcia, zatrzymanie stolca i gazów. W badaniu fizykalnym bywa możliwe palpacyjne stwierdzenie obecności guza. W związku z rozwijającymi się zaburzeniami wodno-elektrolitowymi, gospodarki kwasowo-zasadowej oraz narastającej toksemii pojawiają się objawy ogólnoustrojowe, które nieleczone ostatecznie prowadzą do wstrząsu i zgonu.
Niedrożność jelita grubego z powodu nowotworu jest rozpoznawana na podstawie objawów klinicznych, badania fizykalnego oraz badań obrazowych.
Leczenie niedrożności z powodu nowotworu złośliwego jest bardzo trudne, szczególnie gdy jest ona pierwszym objawem nierozpoznanej wcześniej choroby nowotworowej. Na wybór najlepszego postępowania wpływa dotychczasowy przebieg choroby, uzyskana odpowiedź na leczenie i stan ogólny chorego. W pierwszym etapie leczenia wyrównuje się zaburzenia wodno-elektrolitowe i kwasowo-zasadowe poprzez odpowiednio intensywne dożylne leczenie płynami. Konieczne jest założenie sondy nosowo-żołądkowej i odsysanie treści jelitowej. Zmniejsza to rozdęcie jelit, nasilenie wymiotów, ilość bakterii i ich toksyn oraz zapobiega zachłystowemu zapaleniu płuc. Rozplem bakterii i rozwijającą się sepsę kontroluje się za pomocą antybiotyków o szerokim spektrum działania obejmującym również bakterie beztlenowe. Sprzyja to ustąpieniu subniedrożności, co daje czas na wdrożenie diagnostyki, co może ułatwić skuteczniejsze leczenie.
U chorych w dobrym stanie ogólnym i jednym poziomem niedrożności może być wykonana operacja przywracająca drożność jelita. Przeciwwskazaniem do leczenia operacyjnego jest niedrożność wielopoziomowa oraz niedrożność spowodowana masywnym wysiewem do otrzewnej. U chorych w złym stanie ogólnym, w zaawansowanej chorobie czy starszym wieku wykonanie zabiegu może być niemożliwe, mimo technicznej możliwości jego wykonania.
Leczenie może być operacyjne, endoskopowe z założeniem stentu lub zachowawcze. Leczenie operacyjne polega na jednoetapowej resekcji guza z pierwotnym odtworzeniem ciągłości przewodu pokarmowego lub operacji z wyłonieniem stomii, która w kolejnych etapach leczenia może być zamknięta po odtworzeniu ciągłości przewodu pokarmowego. Operacja Hartmanna polega na usunięciu guza z wyłonieniem kolostomii w pierwszym etapie, a następnie odtworzeniu ciągłości przewodu pokarmowego w drugim etapie leczenia. Operacja polegająca na wyłonieniu stomii dwulufowej z usunięciem guza w drugim etapie leczenia i ewentualnym odtworzeniem ciągłości przewodu pokarmowego w trzecim etapie nie wykazuje przewagi nad operacją Hartmanna, która jest preferowana w sytuacjach klinicznych wymagających leczenia dwuetapowego. Operacja Hartmanna nie wykazuje przewagi nad odcinkową resekcją jelita z jednoczasowym zespoleniem. Operacja Hartmanna prawdopodobnie nie oferuje korzyści w przeżyciu całkowitym, ale może być ona lepsza dla chorych z dużym ryzykiem operacyjnym.
Niedrożność może być leczona za pomocą mało inwazyjnej procedury endoskopowego założenia samorozprężalnego stentu. Stenty powodują poszerzenie światła jelita poprzez ściśnięcie guza. Metalowe elementy wywierają ucisk na guz powodując jego miejscową martwicę, co ułatwia jego zakotwiczenie. Na zakotwiczenie wpływa klepsydrowaty kształt stentu, co również utrudnia jego niepożądaną migrację i nawrót niedrożności. Założenie stentu pozwala uniknąć operacji u nieuleczalnie chorych lub odroczyć ją u chorych wymagających pilnego zabiegu. Endoskopowe założenie stentu w porównaniu do zabiegu chirurgicznego wykazuje mniejszą śmiertelność okołooperacyjną i mniejszą chorobowość okołooperacyjną kosztem wyższego odsetka późnych powikłań. Stentowanie w porównaniu do zabiegu chirurgicznego wykazuje mniejszą skuteczność w paliatywnym łagodzeniu objawów niedrożności, jednak zabieg operacyjny nie daje znaczącej przewagi w przeżyciu całkowitym. Około 20% chorych wymaga powtórnego zabiegu z powodu zamknięcia światła przez nowotwór lub migracji stentu. Stenty samorozprężalne nie są wskazane w przypadku guzów zlokalizowanych w kanale odbytu, ponieważ mogą wywołać uczucie bólu, parcia na stolec lub nietrzymanie moczu. W guzach odbytnicy bywa stosowany laser Nd:YAG.
W przypadku nieoperacyjnej niedrożności jelita grubego z powodu nowotworu leczenie skupia się na łagodzeniu objawów choroby i zapewnieniu możliwie najlepszej jakości życia. Konieczne jest opanowanie bólu, nudności i wymiotów oraz ograniczenie ilości przyjmowanego pokarmu. Ból jest opanowywany za pomocą leków przeciwbólowych podawanych według drabiny analgetycznej. Ze względu na nudności i wymioty unika się doustnego podawania leków i preferuje się drogę dożylną i przezskórną. Preferowanym opioidem jest fentanyl. W leczeniu nudności i wymiotów stosuje się leki antycholinergiczne (hioscyna, skopolamina), metoklopramid, niektóre neuroleptyki (haloperydol, chloropromazyna), antagonisty 5-HT3 (ondansetron, granisetron i inne) oraz glikokortykosteroidy. Leki przeciwsekrecyjne zmniejszają wydzielanie z przewodu pokarmowego ograniczając nudności, wymioty i ból. Największe kliniczne znaczenie wykazuje hioscyna, skopolamina i oktreotyd (analog somatostatyny). W pełnej niedrożności w leczeniu paliatywnym lekiem przeciwwymiotnym z wyboru jest haloperydol.
U chorych, u których możliwe jest wykonanie zabiegu przywracającego drożność jelita podaje się całkowite żywienie pozajelitowe. Długoterminowe żywienie pozajelitowe chorych z guzem nieoperacyjnym jest kontrowersyjne ze względów etycznych i raczej nie jest rutynowo stosowane u tych chorych.
- Perforacja jelita
Perforacja jelita grubego dotyczy około 2,5–10% przypadków raka jelita grubego. Może być ona efektem martwicy guza, martwicy wzdętego jelita, zwykle kątnicy, lub powikłaniem leczenia zabiegowego. Perforacja pojawia się w zaawansowanym stadium choroby, w 53% przypadków występuje w IV stopniu zaawansowania klinicznego, w 37% przypadków w stadium IIIb i 12% w IIIa. Stanowi stan zagrożenia życia z powodu rozwoju rozlanego zapalenia otrzewnej lub powstania ropnia wewnątrzotrzewnowego. Powikłanie jest związane z wysoką śmiertelnością krótkoterminową osiągającą 20–40% i ze złym rokowaniem długoterminowym.
Głównym objawem perforacji jelita jest bardzo silnym ból brzucha oraz objawy rozwijającego się zapalenia otrzewnej. Leczenie jest operacyjne i jego podstawowym celem jest opanowanie rozlanego zapalenia otrzewnej i rozwijającej się sepsy. Zwykle wykonuje się operację Hartmanna z wycięciem fragmentu jelita obejmującego perforację z wyłonieniem tymczasowej kolostomii, konieczne jest płukanie jamy brzusznej.
- Krwawienie z guza
Krwawienie w raku jelita grubego najczęściej występuje pod postacią przewlekłą prowadzącą do niedokrwistości. Ostre i zagrażające życiu krwotoki z guza są raczej rzadkie, jednak wymagają pilnej operacji. Krwawienie z guza może stanowić poważny problem w zaawansowanej chorobie nowotworowej, szczególnie u chorych ze wskazaniami do leczenia przeciwzakrzepowego. Podstawą rozpoznania jest kolonoskopia, która umożliwia lokalizację miejsca krwawienia. Należy wykluczyć krwawienie z górnego odcinka przewodu pokarmowego. Pomocna może być selektywna angiografia lub scyntygrafia za pomocą znakowanych 99Tc krwinkami czerwonymi.
Celem leczenia jest usunięcie źródła krwawienia. Przed zabiegiem zaburzenia wodno-elektrolitowe są wyrównywane za pomocą leczenia płynami, a w niektórych sytuacjach może być konieczna transfuzja koncentratu krwinek czerwonych. Jeśli jest to możliwe przeprowadza się radykalny onkologicznie zabieg. W przypadku choroby nieoperacyjnej wykonywana jest koagulacja plazmowa za pomocą beamera argonowego lub ablacja przy użyciu lasera Nd:YAG. Powodują one martwicę skrzepową lub waporyzację guza, ale zwykle konieczne jest kilkakrotne powtarzanie zabiegu. Koagulacja za pomocą argonu ze względu na niewielką penetrację odznacza się mniejszym ryzykiem perforacji jelita.
- Ból nowotworowy
Przewlekłych dolegliwości bólowych doświadcza około 30% chorych z rakiem jelita grubego. Leczenie bólu nowotworowego jest oparte o leki przeciwbólowe. Leki o coraz wyższej sile działania są podawane w określonej kolejności ułożonej według drabiny analgetycznej. Początkowo w pierwszym stopniu leczenia podawane są niesteroidowe leki przeciwzapalne. Gdy okazują się one nieskuteczne mimo zwiększenia ich dawki, to leczenie bólu jest intensyfikowane i w drugim stopniu leczenia znajdują zastosowanie słabe opioidy takie jak kodeina, dihydrokodeina oraz tramadol. W przypadku ich nieskuteczności mimo zwiększenia dawki lub wystąpienia objawów niepożądanych podawane są silne opioidy obejmujące morfinę, oksykodon, fentanyl i buprenorfina. Preferuje się podawanie doustne lub przezskórne (w tym drugim przypadku za pomocą specjalnych plastrów). Leki doustne są podawane jako preparaty o zmodyfikowanym uwalnianiu służące do długotrwałej kontroli dolegliwości oraz jako preparaty o natychmiastowym uwalnianiu mające za zadanie doraźną kontrolę bólu. Silny ból może wymagać dożylnego podania leku. Ustalanie podstawowej dawki silnego opioidu rozpoczyna się od stosowania morfiny o natychmiastowym uwalnianiu, po czym przechodzi się na doustne opioidy o zmodyfikowanym uwalnianiu lub na plastry o działaniu przezskórnym. Kluczowe dla skuteczności leczenia przeciwbólowego jest stosowanie leków w regularnych odstępach czasu. Pomocniczo wykorzystywane są koanalgetyki, które same nie są lekami przeciwbólowymi, ale wspierają działanie leków przeciwbólowych.
W uporczywych dolegliwościach bólowych korzysta się z chirurgicznych blokad splotów i nerwów. Neuroliza splotu podbrzusznego górnego jest wykonywana w bólu w środkowej części brzucha i odbytnicy. Bywa wykonywana neuroliza splotu trzewnego. W leczeniu bólu odbytnicy wykonuje się neurolizę splotu podbrzusznego górnego, zwoju nieparzystego lub pośrodkową mielotomię.
- Zespół kacheksja-anoreksja
Zespół kacheksja-anoreksja jest rozpoznawany u 54% chorych na raka jelita grubego. Jest to złożony zespół zaburzeń prowadzących do spadku masy ciała w połączeniu z utratą apetytu, osłabieniem, niedokrwistością i zaburzeniami odpowiedzi immunologicznej w następstwie zaburzeń metabolicznych spowodowanych chorobą nowotworową. W patogenezie zespołu największą role odgrywają cytokiny prozapalne i neuroprzekaźniki. Zespół kacheksja-anoreksja znacznie pogarsza jakość życia i prowadzi do wysokiej śmiertelności.
Nie ma ogólnie przyjętego sposobu leczenia kacheksji. W leczeniu stosuje się progestageny (octan megestrolu, medroksyprogesteron) oraz kortykosteroidy. Istotna jest odpowiednia dieta i ćwiczenia fizyczne dostosowane do stanu chorego. Niesteroidowe leki przeciwzapalne mogą powodować przyrost masy ciała, poprawiać jakość życia i stan sprawności. W badaniach klinicznych wykazano skuteczność ibuprofenu, indometacyny, celekoksybu i rofekoksybu. Jednak nie ma wystarczających dowodów na ich rutynowe stosowanie w leczeniu zespołu kacheksja-anoreksja. Niektóre badania sugerują, że w leczeniu zespołu kacheksja-anoreksja mogą być skuteczne grelina, antagonisty melanokortyny, formoterol i talidomid.
Rokowanie
Przeżycie chorych na raka jelita grubego silnie zależy od stopnia zaawansowania klinicznego. Odsetek przeżyć pięcioletnich w raku jelita grubego wynosi około 65–70%. Pięć lat przeżywa 90% chorych z rakiem w zaawansowaniu miejscowym, 70% chorych w zaawansowaniu lokalnym i 10% chorych z chorobą uogólnioną.
| Stadium kliniczne | Przeżycie całkowite |
| I | 93% |
| IIa | 85% |
| IIb | 72% |
| IIIa | 83% |
| IIIb | 64% |
| IIIc | 44% |
| IV | 8% |
| Stadium kliniczne | Przeżycie całkowite w raku okrężnicy | Przeżycie całkowite w raku odbytnicy |
| I | 92% | 87% |
| IIa | 87% | 80% |
| IIb | 63% | 49% |
| IIIa | 89% | 84% |
| IIIb | 69% | 71% |
| IIIc | 53% | 58% |
| IV | 11% | 12% |
Historia
Początkowo leczenie raka jelita grubego było oparte wyłącznie na leczeniu chirurgicznym. Operacje raka jelita grubego były przez długi czas uważane za bardzo ryzykowne, ze względu na powikłania infekcyjne. Dopiero wprowadzenie pierwszych sulfonamidów w latach 30. XX wieku pozwoliło znacznie obniżyć śmiertelność związaną z zabiegiem. Jean-François Reybard w 1823 roku przeprowadził resekcje guza esicy z wykonaniem zespolenia. W 1883 roku Karel Maydl wykonał pierwszą prawostronną kolektomię. Po raz pierwszy pełna kolektomia została przeprowadzona przez René Leriche w 1914 roku.
W drugiej połowie XIX wieku guzy odbytnicy wycinano wyłącznie od strony krocza. Pierwszą operację usunięcia odbytnicy z dostępu kroczowego wykonał w 1826 roku Jacques Lisfranc. Mimo wprowadzanych kolejnych modyfikacji operacji wprowadzanych przez Theodora Billrotha, Aristide Verneuil, Emila Kochera, Ludwika Rydygiera i Paula Kraske polegających na usuwaniu kości guzicznej, kości krzyżowej lub innych struktur operacje charakteryzowała wysoka śmiertelność z powodu powikłań septycznych oraz wysoki odsetek wczesnych nawrotów. Ernest Miles w 1908 wykonał i opisał operację brzuszno-kroczową raka odbytnicy, jednak zabieg przeprowadził wcześniej w 1879 roku czeski chirurg Vincenz Czerny. Technikę operacji brzuszno-kroczowej systematycznie poprawiano, co umożliwiło jej wykonywanie w jednym etapie. W 1921 roku Henri Albert Hartmann do leczenia guzów w esicy i górnej części odbytnicy wprowadził dwuetapową operację z dostępu brzusznego. W 1939 C. F. Dixon przeprowadził operacje jednoetapową z jednoczesnym zespoleniem. Wówczas stosowano szeroki 5 cm dolny margines resekcji, co ograniczało możliwości zastosowania operacji zachowującej zwieracze w leczeniu raków położonych w odbytnicy. Jednak to operacja brzuszno-kroczowa w pierwszej połowie XX wieku była złotym standardem dla leczenia guzów położonych w odbytnicy. Dopiero badania wykazujące znacznie mniejszy konieczny margines resekcji umożliwiły operacje z zachowaniem zwieraczy również w guzach położonych w górnej i środkowej części odbytnicy. Na przełomie lat 40. i 50. wykazano przewagę mniej okaleczającej przedniej resekcji. W latach 70. XX wieku do chirurgii wprowadzono szew mechaniczny, co ułatwiło wykonywanie niskich przednich resekcji odbytnicy i pozwoliło na dalsze ograniczenie wskazań do operacji brzuszno-kroczowej. W 1982 roku R.J. Heald wprowadził całkowite wycięcie mezorektum, co znacząco poprawiło wyniki operacji raka odbytnicy. Na początku lat 90. do chirurgii raka jelita grubego wprowadzono operacje laparoskopowe.
Początki chemioterapii sięgają końca lat 50. W 1958 roku do leczenia zaawansowanego raka jelita grubego wprowadzono 5-fluorouracyl. W 1975 wykazano, że 5-fluorouracyl połączony z radioterapią (chemioradioterapia) znacząco podwyższa odsetek odpowiedzi całkowitych. Pierwsze badania nad leczeniem okołooperacyjnym raka jelita grubego prowadzono w latach 70. W połowie lat 80. standardem leczenia uzupełniającego stał się 5-fluorouracyl. W przełomie lat 80. i 90. do 5-fluorouracylu w celu zmniejszania toksyczności zaczęto dołączać leukoworynę. Na początku lat dwutysięcznych wprowadzono irynotekan i oksaliplatynę, które stały się podstawą współczesnych programów wielolekowych.
Choroba u zwierząt
Złośliwe nabłonkowe nowotwory jelita nie są częste wśród zwierząt, szczególnie w porównaniu do raka jelita grubego u ludzi, u których jest bardzo częstym nowotworem. U zwierząt rak znacznie częściej pojawia się w obrębie jelita cienkiego niż grubego. Rak jelita grubego został stwierdzony u różnych grup taksonomicznych zwierząt, w tym u niektórych gadów i ssaków, w tym gryzoni, bydła, koni, psów, kotów i niektórych naczelnych (tamaryna białoczuba). U psów częściej rak jest zlokalizowany w odbytnicy niż okrężnicy.
Rak jelita grubego u zwierząt objawia się obecnością świeżej krwi w kale, bolesnym parciem i uporczywymi próbami defekacji. Mogą występować wymioty, utrata apetytu i spadek masy ciała. W badaniu fizykalnym bywa stwierdzana obecność guza w jamie brzusznej, bolesność podczas palpacji, wodobrzusze i obecność guza w badaniu przez odbyt.
W rozpoznaniu choroby wykorzystuje się kontrastowe badanie radiologiczne, endoskopię i ultrasonografię. W badaniach laboratoryjnych stwierdza się niedokrwistość. Pomocna w rozpoznaniu bywa biopsja cienkoigłowa podejrzanej zmiany. Ostateczne rozpoznanie jest stawiane na podstawie badania histopatologicznego.
Leczenie jest oparte o chirurgiczną resekcję zmiany. Sporadycznie bywa stosowana radioterapia. Chemioterapii nie stosuje się rutynowo.
Uwagi
Bibliografia
- H. Randolph Bailey, Richard P. Billingham, Michael J. Stamos, Michael J. Snyder: Colorectal Surgery. Elsevier Health Sciences, 2012. ISBN 978-1-4557-3770-3.
- A.B. Benson, A.P. Venook, T. Bekaii-Saab, E. Chan i inni. Colon cancer, version 3.2015. „J Natl Compr Canc Netw”, 2015.
- Jim Cassidy, Patrick Johnston, Eric Van Cutsem: Colorectal Cancer. CRC Press, 2006. ISBN 978-1-4200-1630-7.
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Peter C. Enzinger, Moon J. Fenton, Charles S. Fuchs, Jean L. Grem i inni. Rectal Cancer, Version 3.2015. „J Natl Compr Canc Netw”, 2015.
- B. Glimelius, E. Tiret, A. Cervantes, D. Arnold. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 24 Suppl 6, s. vi81–vi88, październik 2013. DOI: 10.1093/annonc/mdt240. PMID: 24078665.
- S.R.S.R. Hamilton S.R.S.R., L.A.L.A. Aaltonen L.A.L.A., Pathology and Genetics of Tumours of the Digestive System, Lyon: IARC Press, 2000, ISBN 92-832-2410-8 [dostęp 2015-12-25] [zarchiwizowane z adresu 2018-07-28] .
- Yik-Hong Ho: Contemporary Issues in Colorectal Surgical Practice. INTECH, 2012. ISBN 978-953-51-0257-1.
- David Kelsen: Principles and Practice of Gastrointestinal Oncology. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7617-2.
- Radzisław Kordek: Onkologia. Podręcznik dla studentów i lekarzy. Gdańsk: VIA MEDICA, 2007. ISBN 978-83-7555-016-0.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Pior Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Vinay Kumar, Ramzi S. Cotran, Stanley L. Robins: Robins Patologia. Wrocław: Elsevier Urban & Partner, 2005, s. 232–232. ISBN 83-89581-92-2.
- R. Labianca, B. Nordlinger, G.D. Beretta, S. Mosconi i inni. Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 24 Suppl 6, s. vi64-72, październik 2013. DOI: 10.1093/annonc/mdt354. PMID: 24078664.
- Bernard Levin, Paul Rozen, Stephen J. Spann, Graeme P. Young: Colorectal Cancer in Clinical Practice: Prevention, Early Detection and Management. CRC Press, 2005. ISBN 978-1-84184-455-8.
-
 Otto S. Lin. Acquired risk factors for colorectal cancer. „Methods in Molecular Biology”. 472, s. 361–372, 2009. DOI: 10.1007/978-1-60327-492-0_16. PMID: 19107442.
Otto S. Lin. Acquired risk factors for colorectal cancer. „Methods in Molecular Biology”. 472, s. 361–372, 2009. DOI: 10.1007/978-1-60327-492-0_16. PMID: 19107442.
- Robert D. Odze Robert D. Odze, John R. Goldblum John R. Goldblum: Surgical Pathology of the GI Tract, Liver, Biliary Tract and Pancreas. Elsevier Health Sciences, 2009. ISBN 978-1-4377-1959-8.
- Daniel K. Podolsky, Michael Camilleri, J. Gregory Fitz, Anthony N. Kalloo, Fergus Shanahan, Timothy C. Wang: Yamada’s Textbook of Gastroenterology. John Wiley & Sons, 2015. ISBN 978-1-118-51215-9.
- Pat Price, Karol Sikora: Treatment of cancer. CRC Press, 2014. ISBN 978-1-4822-1494-9.
- Elaine Swan: Colorectal Cancer. John Wiley & Sons, 2006. ISBN 978-0-470-03168-1.
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2014. Kraków: Medycyna Praktyczna, 2014. ISBN 978-83-7430-405-4.
- E. Van Cutsem, A. Cervantes, B. Nordlinger, D. Arnold i inni. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 25 Suppl 3, s. iii1–9, wrzesień 2014. DOI: 10.1093/annonc/mdu260. PMID: 25190710.
- Claude E. Welch, Leslie W. Ottinger, John P. Welch: Manual of Lower Gastrointestinal Surgery. Springer Science & Business Media, 2012. ISBN 978-1-4612-6012-7.
- Christopher G. Willett: Cancer of the Lower Gastrointestinal Tract. T. 1. PMPH-USA, 2001, s. 82. ISBN 9781550091106.