Chemioterapia nowotworów

Chemioterapia nowotworów – metoda ogólnoustrojowego leczenia nowotworów za pomocą leków cytostatycznych, zwykle podawanych jako część schematu leczniczego. Często jest łączona z innymi metodami leczenia przeciwnowotworowego, szczególnie z metodami chirurgicznymi, radioterapią, hormonoterapią i leczeniem ukierunkowanym na konkretne procesy komórki nowotworowej. W chemioterapii może być wykorzystany pojedynczy lek (monoterapia) lub – znacznie częściej – kombinacja wielu leków (polichemioterapia) ułożona w program leczniczy przewidujący rodzaje leków, ich dawkę, odstępy między dawkami, drogę podania oraz pomocnicze leki wspierające leczenie.
Choć stosowane leki różnią się budową i mechanizmem działania, to wszystkie cytostatyki są skierowane przeciw szybko dzielącym się komórkom, jakimi są komórki nowotworowe. Leki przeciwnowotworowe nie mają jednak ściśle wybiórczego charakteru, choć ich najintensywniejsze działanie jest obserwowane w nienormalnie szybko dzielących się komórkach nowotworowych: wpływają one również na inne szybko dzielące się komórki, w tym komórki szpiku kostnego i przewodu pokarmowego. Skutkuje to najczęstszymi działaniami niepożądanymi chemioterapii: zapaleniem błony śluzowej przewodu pokarmowego i zahamowaniem czynności szpiku (powodującym spadek liczby erytrocytów, leukocytów i trombocytów).
Główną przeszkodą w uzyskaniu klinicznej skuteczności są efekty toksyczne w prawidłowych tkankach oraz rozwój oporności guza na podawane leki. Obecnie wiele chorób nowotworowych jest uleczalnych za pomocą chemioterapii samodzielnej lub połączonej z innymi metodami leczenia. Część z tych chorób, szczególnie choroby rozrostowe układu krwiotwórczego i nowotwory wieku dziecięcego, również jest wyleczalna w bardziej zaawansowanych etapach. W sytuacji, w której nie przewiduje się całkowitego wyleczenia, celem chemioterapii może być samo wydłużenie przeżycia mające szczególne znaczenie dla chorych w starszym wieku lub chorych z licznymi chorobami współistniejącymi. Ważnym zastosowaniem chemioterapii jest leczenie paliatywne, pozwalające zmniejszyć uciążliwość choroby i poprawić komfort życia.
Historia

Początek leczenia nowotworów za pomocą substancji chemicznych datuje się na XX wiek. Wtedy to Paul Ehrlich w 1910 roku wprowadził salwarsan – pierwszy nowoczesny lek przeciwbakteryjny. Zapoczątkowało to nową metodę leczenia chorób – chemioterapię. Przed wprowadzeniem chemioterapii choroby rozrostowe były leczone wyłącznie chirurgicznie lub za pomocą radioterapii, metody te dominowały aż do lat 60. XX wieku. Odkrycie pierwszych skutecznych leków przeciwnowotworowych jest związane z gazem musztardowym, który podczas I wojny światowej był stosowany jako bojowy środek trujący. Wówczas lekarze wojskowi zauważyli, że ofiary stosowania tego gazu często umierały w efekcie uszkodzenia szpiku kostnego. Przełomem w badaniach nad lekami przeciwnowotworowymi był niemiecki nalot na włoski port Bari, w wyniku którego doszło do przypadkowego uwolnienia przetransportowanego ze Stanów Zjednoczonych do Europy gazu musztardowego i zatrucia kilkuset osób. Stwierdzono, że u ofiar szpik kostny oraz węzły chłonne były znacznie uboższe w limfocyty. W związku z tym wydarzeniem Alfred Gilman i Louis Goodman przeprowadzili eksperyment z iperytem azotowym na myszach z przeszczepionym chłoniakiem, który w wyniku eksperymentalnego leczenia uległ regresji. Torakochirurg Gustaf Lindskog przekonał ich do wykonania próby na chorym dotkniętym chłoniakiem nieziarniczym powodującym niedrożność dróg oddechowych. Poprawa, choć tymczasowa, była znakomita. Mimo że wstępne badania przeprowadzono jeszcze w roku 1943, ich wyników nie ujawniono do 1946.
Kolejnym ważnym wydarzeniem było odkrycie antagonistów kwasu foliowego. Zauważono, że brak kwasu foliowego może powodować obraz podobny do działania iperytu azotowego, a jednocześnie wówczas błędnie uważano, że kwas foliowy może stymulować proliferację klonów ostrej białaczki limfoblastycznej. Sidney Farber opracował antagonistę kwasu foliowego aminopterynę oraz metotreksat (amethopterin). Następnie w 1948 roku Farber przetestował antagonisty kwasu foliowego na dzieciach chorych na ostrą białaczkę limfoblastyczną, uzyskując remisje. Wykazał tym samym, że jest możliwe farmakologiczne leczenie nowotworów. W 1951 metotreksat zastosowano w leczeniu raka piersi, choć pierwszym lekiem wprowadzonym do leczenia guzów litych był 5-fluorouracyl. W 1950 Charles Heidelberger odkrył, że niektóre komórki nowotworowe znacznie bardziej wykorzystują uracyl w swoim metabolizmie, i zablokował ten szlak metaboliczny „fałszywym” substratem: fluorouracylem. W 1951 wprowadzono pierwsze tiopuryny: tioguaninę i merkaptopurynę.
W 1956 Roy Hertz i Min Chiu Li za pomocą metotreksatu uzyskali pierwsze całkowite wyleczenie z choroby nowotworowej u chorej na raka kosmówki. W 1960 do obrotu wszedł pierwszy alkaloid barwinka różyczkowego – winblastyna – a w 1963 winkrystyna. Mimo coraz nowszych leków tylko niewielki odsetek pacjentów osiągał krótkotrwałe remisje, co było związane z szybkim rozwojem oporności komórek nowotworowych na stosowane leki. W 1962 Freireich zaproponował połączenie czterech leków w pełnych dawkach (winkrystyna, metotreksat, 6-merkaptopuryna, prednizon) w jeden schemat leczniczy VAMP, co skutkowało dłuższymi i częstszymi remisjami. W 1965 przypadkowo odkryto, że elektroliza platynowymi elektrodami spowodowała powstanie rozpuszczalnego związku platyny, który hamował podział bakterii. Zaowocowało to opracowaniem cisplatyny. Na początku lat 70. zaczęto stosować uzupełniającą (adiuwantową) chemioterapię, a w połowie lat 90. wprowadzono pierwsze leki celowane.
Cytostatyki
Leki alkilujące
Historycznie jest to najstarsza grupa leków przeciwnowotworowych. Cechują się zdolnością do podstawienia grupy alkilowej (alkilacja) do białek, RNA i DNA. Zdolność do efektu przeciwnowotworowego jest warunkowana przez wytworzenie wiązania kowalencyjnego z DNA, a najbardziej narażona na wytwarzanie wiązania jest guanina. W efekcie dochodzi do podstawienia grupy alkilowej, reakcji sieciowania (cross-link) lub zrywania nici kwasu nukleinowego. Uszkodzona nić może ulec złamaniu podczas mitozy lub próby naprawy, prowadząc do uruchomienia szlaku apoptozy (zaprogramowanej śmierci komórki). Środki alkilujące mogą również upośledzać czynność komórek poprzez wiązanie z grupą aminową, karboksylową, sulfonową i fosforanami, powodując uszkodzenie białek i innych substancji istotnych biologicznie. Działają we wszystkich fazach cyklu komórkowego, jednak ich skuteczność jest najwyższa w szybko dzielących się komórkach.
Do grupy należą pochodne iperytu azotowego (pierwszy i już praktycznie niestosowany związek chlorometyna, następnie cyklofosfamid, ifosfamid, chlorambucyl, melfalan), azyrydyny (tiotepa), pochodne nitrozomocznika (karmustyna, lomustyna, mimustyna), kompleksy platyny (cisplatyna, karboplatyna, oksaliplatyna) oraz prokarbazyna i dakarbazyna.
Antymetabolity
Jest to kilka grup leków, której cechą wspólną jest wypieranie naturalnych jednostek budulcowych (metabolitów) i zastępowanie ich nieprawidłowymi. W efekcie powstają niewydolne czynnościowo białka o nieprawidłowej budowie oraz dochodzi do powstawania nieprawidłowego DNA, które nie może ulegać replikacji. Jest to grupa, której działanie jest swoiste dla fazy S (syntezy) cyklu komórkowego. Leki z tej grupy (poza cytarabiną) cechują się względnie łagodnym działaniem ematogennym.
Antagonisty kwasu foliowego
Jest to grupa leków blokująca enzym reduktazę dihyrofolianową mający kluczowe znaczenie w przekształcaniu kwasu foliowego w kwas tetrahydrofoliowy (FH4), który jest niezbędny w procesie syntezy zasad purynowych – składników RNA i DNA. W efekcie niedoborów kwasu foliowego dochodzi do zatrzymania syntezy DNA i podziałów komórki.
Najważniejszymi przedstawicielami tej grupy są metotreksat i pemetreksed.
Analogi zasad purynowych
Jest to grupa leków, której działanie jest oparte na strukturalnym podobieństwie do puryn, w tym adeniny i guaniny. Do analogów puryn należy kladrybina, fludarabina, merkaptopuryna, tioguanizna i pentostatyna.
Merkaptopuryna konkuruje z hipoksantyną i guaniną o fosforybozylotransferazę hipoksantynowo-guanylową i ulega przemianie do monofosforanu tioinozyny (TIMP), który blokuje reakcje związane z kwasem inozynowym. S-metylotransferaza przekształca TIMP do monofosforanu metylotioinozyny (MTIMP). TIMP i MTIMP hamują amidotransferazę glutamino-5-fosforybozylopirofosforanową, która jest pierwszym enzymem szlaku syntezy nukleotydów purynowych. W efekcie zostaje zatrzymana synteza DNA. Podobnie działa tioguanina.
Kladrybina ulega transformacji do kladrybinotrifosforanu (Cd-ATP), który kompetycyjnie hamuje inkorporację prawidłowego nukleotydu do DNA, co blokuje jego elongację podczas replikacji DNA. Akumulacja Cd-ATP powoduje zaburzenie puli deoksyrybonukleotydów i w konsekwencji zaburzenie zarówno syntezy, jak i naprawy DNA.
Fludarabina ma podobny mechanizm działania, w którym jej metabolit hamuje elongację łańcucha DNA. W odróżnieniu od innych antymetabolitów fludarabina jest aktywna w niedzielących się komórkach, ponieważ prawdopodobnie głównym mechanizmem działania leku jest aktywacja apoptozy.
Analogi zasad pirymidynowych
Do analogów zasad pirymidynowych zalicza się fluoropirymidyny (fluorouracyl, kapecytabina) i cytydyny (cytarabina, gemcytabina).
Fluorouracyl hamuje aktywność syntazy tymidylanowej, która syntetyzuje monofosforan tymidyny. Kapecytabina jest prolekiem fluorouracylu. Cytarabina jest wbudowywana do DNA i zakłóca jego replikację. Gemcytabina blokuje przemianę fosforanu cytydyny w fosforan deoksycytydyny.
Inhibitory mitozy
Hamowanie podziału komórkowego jest możliwe poprzez zablokowanie mitozy poprzez uszkodzenie aparatu mitotycznego, który jest konieczny do rozdzielenia i przemieszczenia pary chromosomów homologicznych do dwóch przeciwnych biegunów komórki. Wrzeciono kariokinetyczne jest zbudowane z mikrotubul, których zaburzenie funkcji jest podstawą działania inhibitorów mitozy. Do inhibitorów mitozy zalicza się dwie grupy leków: alkaloidy barwinka różyczkowego oraz taksany. Obie grupy leków działają za pomocą całkowicie odmiennych mechanizmów. Mikrotubule są strukturami dynamicznymi podlegającymi ciągłej syntezie i degradacji. Alkaloidy barwinka zapobiegają tworzeniu się mikrotubul, a taksany uniemożliwiają demontaż mikrotubul. W efekcie dochodzi do zatrzymania cyklu komórkowego i pobudzenie procesu apoptozy. Są to leki swoiste dla fazy M, blokują podział w fazie G2 lub M.
Alkaloidy barwinka różyczkowego
Pierwsze alkaloidy otrzymano z barwinka różowego (Catharanthus roseus). Do grupy zalicza się winkrystynę, winblastynę, windezynę, winorelbinę.
Alkaloidy barwinka różyczkowego powodują depolimeryzację mikrotubul. Wykazują wysokie powinowactwo do wolnej tubuliny, z którą wiążąc się, powodują zmiany konformacyjne prowadzące do tendencji do jej agregacji i dynamicznej stabilizacji mikrotubul. Wzrost wrzecion podziałowych ulega spowolnieniu lub zatrzymaniu, co prowadzi do zatrzymania mitozy w metafazie. Ostatecznie prowadzi to do uruchomienia apoptozy.
Taksany
Lek wyizolowano z kory cisa krótkolistnego (Taxus brevifolia). Do grupy należą paklitaksel i docetaksel. Taksany początkowo powodują nasilenie tworzenia mikrotubul, następnie wiążą się z β-tubuliną i poprzez zahamowanie depolimeryzacji mikrotubul hamują syntezę wrzeciona kariokinetycznego. W rezultacie uniemożliwiają wędrówkę chromosomów homologicznych. Dochodzi do zatrzymania mitozy i aktywacji szlaku apoptozy.
Antybiotyki cytostatyczne
Pewne substancje mimo swojego działania bakteriobójczego nie znajdują zastosowania jako antybiotyki ze względu na swoje właściwości cytotoksyczne. Jest to grupa bardzo zróżnicowana pod względem budowy i mechanizmów działania. Do antybiotyków cytostatycznych zalicza się antracykliny (doksorubicyna, daunorubicyna, idarubicyna, epirubicyna), aktynomycyny (daktynomycyna), bleomycyna, mitomycyna, mitoksantron i amsakryna.
Antracykliny
Antracykliny to antybiotyki wyizolowane z różnych gatunków Streptomyces. Są to leki o bardzo szerokim zastosowaniu w lecznictwie. Wpływają na zablokowanie topoizomerazy II i w efekcie ich działania dochodzi do nieprawidłowego dwuniciowego pęknięcia DNA i jego degradacji. Dodatkowo struktura antracyklin sprzyja reakcjom utlenienia-redukcji i powstawania wolnych rodników tlenowych, które mogą wywierać efekt przeciwnowotworowy. Działanie antracyklin najsilniej jest wyrażone w fazie S.
Aktynomycyny
Daktynomycyna jest cytostatykiem wyizolowany z bakterii Streptomyces. Mechanizm działania leku nie jest w pełni wyjaśniony. Antybiotyk wbudowuje się między sąsiednią guaninę a cytozynę, co blokuje topoizomerazę II i prowadzi do dwuniciowego pęknięcia DNA. Drugim mechanizmem może być stabilna interkalacja antybiotyku z DNA uniemożliwiająca jego replikację. Rozważanym mechanizmem jest również wytwarzanie wolnych rodników.
Mitoksantron
Działanie antybiotyku wynika z interkalacji do DNA oraz blokowania topoizomerazy II.
Bleomycyna
Bleomycyna została wyizolowana ze Streptomyces verlicilus. Jest mieszaniną związków polipeptydowych, głównie bleomycyny A2 i B2. W wyniku połączenia się kompleksu bleomycyny z jonem żelazowym dochodzi do wytworzenia wysoce reaktywnych wolnych rodników, a następnie do rozerwania przez nie nici DNA, które jest zainicjowane odszczepieniem zasad pirymidynowych.
Mitomycyna
Mitomycyna została wyizolowana ze Streptomyces caespitous. Lek w komórce jest metabolizowany do bardzo reaktywnego związku alkilującego. Jego działanie polega na silnym sieciowaniu DNA.
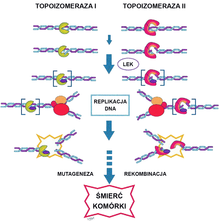
Inhibitory topoizomerazy
Struktura podwójnej helisy DNA sprawia, że nici są trudne do rozdzielenia, które jest jednak konieczne do przeprowadzenia replikacji DNA. Synteza bez dużego nakładu energii wymaga udziału enzymów, które czasowo i odwracalnie przerywają nić DNA (odwracalne nukleazy). Takimi enzymami są dwie topoizomerazy. Topoizomeraza I jest dzielona na dwie podklasy. Typ IA i IB, również topoizomeraza II jest dzielona na dwie podklasy IIA i IIB. Topoizomeraza I umożliwia rozcięcie jednej nici i rozwinięcie skręconych nici DNA, co jest konieczne do zapoczątkowania syntezy. Topoizomeraza pozwala na przerwanie obu nici i dodanie superskrętów, ułatwiając przemodelowanie chromatyny.
Do inhibitorów topoizomerazy I zalicza się topotekan i irynotekan, a do inhibitorów topoizomerazy II etopozyd.
Mechanizm działania

Leki przeciwnowotworowe wywierają hamujący wpływ na podział komórkowy, choć mechanizm ich działania jest różny dla każdej grupy leków. Większość cytostatyków działa poprzez hamujący wpływ na mitozę (podział komórki) głównie poprzez uszkodzenie DNA oraz struktur odpowiedzialnych za podział komórki. Uszkodzenia ostatecznie kierują je w proces apoptozy. Profil działania ukierunkowuje leki na szybko dzielące się komórki, jakimi są również komórki nowotworowe, choć jednocześnie ich nie selektywność wiąże się z toksycznością.
Działanie leków jest związane z działaniem na cykl komórkowy, który składa się z 4 faz obejmujący fazy przygotowania do podziału. Faza G1 jest fazą przygotowania komórki do syntezy DNA i podziału, faza S obejmuje intensywną replikację genomu komórki. Po fazie S komórka wkracza w krótki okres spoczynkowy (G2), po którym następuje faza M, w której komórka dzieli się na dwie. W prawidłowych warunkach komórka przechodzi w fazę spoczynkową G0, w której przez pewien okres nie ulega dalszym podziałom. Komórki nowotworowe charakteryzuje niepohamowany wzrost, a ich przyrost jest większy niż ubytek.
Podczas każdego cyklu chemioterapii leki nie zabijają wszystkich komórek nowotworowych, lecz tylko określoną ich część, niezależnie od absolutnej liczby komórek nowotworowych. Ponieważ tylko część komórek zostaje zniszczona, dawki leków muszą być powtarzane. Wykazano, że w miarę rozwoju masy guza zwolnieniu ulega dynamika podziałów komórkowych, zmniejsza się zarówno wskaźnik proliferacji, jak i czas podwojenia. Jest to związane z pewnym opóźnieniem rozwoju unaczynienia guza, które nie nadąża za szybkim wzrostem jego masy. Prowadzi to do niedotlenienia guza i komórki ulegają zatrzymaniu w fazie G0 lub ulegają nekrozie, stając się mniej wrażliwe na cytostatyki. W konsekwencji guzy o małej masie są najbardziej wrażliwe na leki. Leczenie cytoredukcyjne za pomocą metod chirurgicznych, radioterapii czy leków nieswoistych dla fazy zmniejszają masę guza, zwiększając jego wrażliwość na leki. Uzasadnia to również stosowanie leczenia adiuwantowego, także w przypadku gdy w stadium zaawansowanym są uważane za chemiooporne.
Niektóre leki działają tylko w określonej fazie cyklu komórkowego, nazywa się je lekami swoistymi dla fazy. W fazie G1 działanie wykazuje asparaginaza. W fazie S, gdzie występuje intensywna synteza DNA, działają antymetabolity (np. metotreksat, cytarabina, fluorouracyl). W fazie G2 działa bleomycyna i inhibitory topoizomerazy II (etopozyd, temipozyd). W fazie podziału M działają alkaloidy barwinka różyczkowego, taksany oraz inhibitory topoizomerazy I (topotekan, irynotekan). W przypadku leków swoistych dla fazy występuje ważne zjawisko synchronizacji. Niskie stężenie leku swoistego dla fazy powoduje jedynie zahamowanie cyklu komórkowego w fazie, na którą działa ten lek. Kolejna większa dawka wywiera wpływ na większą liczbę komórek, ponieważ większa ich ilość wkracza w cykl komórkowy. Niestety zjawisko dotyczy również innych typów komórek, co powoduje duże nasilenie objawów niepożądanych. Leki swoiste dla fazy są bardziej skuteczne, gdy komórki nowotworowe intensywnie się dzielą. W odróżnieniu od leków swoistych dla fazy, leki nieswoiste dla fazy działają w każdym etapie cyklu komórkowego i są cytotoksyczne nawet dla wolniej dzielących się komórek. Przykładem takich leków są leki alkilujące, pochodne nitrozomocznika i antracykliny. Mogą spowodować zmniejszenie masy guza, co może przyczynić się do wzrostu wrażliwości na leki swoistych dla fazy.
Leki alkilujące wiążą się z kwasami karboksylowymi i grupami aminowymi DNA oraz białek. Leki te powodują liczne zmiany strukturalne w obrębie kwasów nukleinowych, a w konsekwencji podział komórki. Antymetabolity wypierają naturalne metabolity i powodują powstawanie nieprawidłowych niefunkcjonalnych białek, w tym również enzymów. Powoduje to zaburzenie przemian metabolicznych i podziału komórek. Antagonisty zasad purynowych i pirymidowych powodują zablokowanie syntezy DNA. Antagonisty kwasu foliowego, blokując przemianę kwasu foliowego, prowadzą do zaburzenia syntezy kwasów nukleinowych. Inhibitory topoizomerazy powodują zablokowanie ważnych enzymów odpowiedzialnych za syntezę DNA umożliwiających rozplecenie podwójnej helisy DNA. Powodują one zablokowanie kompleksu topoizomerazy związanego DNA i trwałe przerwanie nici, a następnie śmierć komórki. Inhibitory mitozy mogą hamować budowę wrzeciona kariokinetycznego poprzez wiązanie się z tubuliną. Alkaloidy barwinka różyczkowego powodują rozpad mikrotubul, a taksany stabilizując mikrotubule, utrudniają ich depolimeryzację, upośledzając wędrówkę chromosomów, co ostatecznie blokuje podział komórki. Niektóre antybiotyki, oprócz działania przeciwbakteryjnego, wykazują działanie cytostatyczne. Grupa nie znalazła zastosowania w leczeniu zakażeń bakteryjnych. Antracykliny działają wielokierunkowo. Ulegają interkalacji do DNA, co prowadzi do zahamowania syntezy kwasów nukleinowych. Poprzez hamowanie działania topoizomerazy II i biotransformację do wolnych rodników powodują rozrywanie łańcuchów DNA. Również wykazują działanie toksyczne dla błony komórkowej, zwiększając jej płynność i przepuszczalność. Bleomycyna interkaluje z DNA, a jej metabolity poprzez reaktywne formy tlenu rozrywają łańcuch DNA. Mitomycyna powoduje powstanie wiązań poprzecznych między nićmi DNA.
W związku z profilem działania leków, który jest ukierunkowany na szybko dzielące się komórki nowotworowe o wysokim współczynniku wzrostu guza (np. ostra białaczka limfoblastyczna, agresywne chłoniaki nieziarnicze, chłoniak Hodgkina), nowotwory o szybszym tempie wzrostu są bardziej podatne na chemioterapię, ponieważ większa proporcja komórek przechodzi proces podziału komórkowego w danym momencie. Nowotwory o wolniejszym tempie wzrostu (np. chłoniaki indolentne) zazwyczaj wykazują bardziej umiarkowaną odpowiedź na leczenie.
Strategie lecznicze
Istnieje wiele strategii podawania cytostatyków. Chemioterapia może być podawana z założeniem wyleczenia, wydłużenia przeżycia, ale bez możliwości całkowitego wyleczenia lub jako leczenie paliatywne (łagodzące objawy choroby nowotworowej). Wyróżnia się następujące strategie lecznicze:
- Chemioterapia może być zastosowana w połączeniu z innymi metodami leczenia nowotworów, w tym metodami chirurgicznymi, radioterapią i leczeniem celowanym.
- Chemioterapia skojarzona jest to metoda, w której stosuje się wiele różnych leków jednocześnie. Leki różnią się mechanizmami działania oraz efektami ubocznymi.
- Chemioterapia neoadiuwantowa jest to metoda, w której pierwszej kolejności przed innymi metodami leczenia stosuje się terapię cytostatykami. Ten typ leczenia stosuje się w terapiach zakładających wyleczenie. Jest też stosowane w razie dużego guza uniemożliwiającego przeprowadzenie operacji chirurgicznej. Zmniejszenie masy i rozmiarów guza może pozwolić wykonać radykalny zabieg operacyjny.
- Chemioterapia adiuwantowa (uzupełniająca) jest stosowana po radykalnym leczeniu lokalnym (np. metody chirurgiczne), gdy występuje zwiększone ryzyko nawrotu. Terapia ma na celu zniszczenia mikroprzerzutów i zmniejszenia ryzyka nawrotu.
- Chemioterapia indukcyjna jest to wstępne leczenie, którego celem jest osiągnięcie znaczącej cytoredukcji, a idealnie całkowitą remisję choroby.
- Chemioterapia konsolidująca jest to leczenie włączane po uzyskaniu remisji w celu utrwalenia dotychczasowego korzystnego wyniku leczenia i wydłużenia czasu przeżycia wolnego od choroby (PFS). Zwykle jest to jeden z podawanych leków, którym osiągnięto remisję.
- Chemioterapia intensyfikująca jest stosowana w podobnym celu co konsolidująca, ale stosuje się inny lek niż te, którymi uzyskano remisję, aby osiągnąć wyleczenie.
- Chemioterapia podtrzymująca jest to metoda, w której stosuje się małe dawki cytostatyków, aby przedłużyć remisje.
- Chemioterapia ratująca jest podawana, gdy inne metody leczenia zawiodły, aby osiągnąć kontrolę choroby lub złagodzić jej objawy.
- Chemioterapia paliatywna jest metodą, która nie niesie możliwości wyleczenia z choroby, ale pozwala zredukować obciążenie guzem i przedłużyć przeżycie. Tego typu schematy charakteryzuje mniejsza toksyczność.
Schematy lecznicze
Podstawową metodą leczenia współczesnej chemioterapii są programy lecznicze złożone z kilku leków. Tylko w początkowym okresie stosowano pojedyncze cytostatyki w monoterapii. Szybko okazało się, że schematy wielolekowe znacząco poprawiają wyniki leczenia onkologicznego. Ze względu na pojawiającą się oporność pojedyncze leki są w stanie wywołać całkowitą odpowiedź tylko u 20% leczonych. Monoterapia może być stosowana w leczeniu paliatywnym niektórych nowotworów i w leczeniu niektórych specyficznych typów nowotworów o bardzo dobrym rokowaniu. Obecne schematy leczenia przewidują podawanie leków w cyklach, gdzie częstość i czas trwania leczenia ograniczają toksyczność, a jednocześnie zapewniają odpowiednią skuteczną dawkę leków.
Program leczniczy uwzględnia leki cytostatyczne i ewentualne inne leki pomocnicze, ich dawkę, drogę podania, liczbę cykli, odstępy między lekami wchodzącymi w skład schematu oraz przerwy między kolejnymi cyklami. Współczesne schematy poza klasycznymi lekami cytostatycznymi często również zawierają leki celowane. Schematy lecznicze powstają na podstawie badań klinicznych, które następnie mogą być modyfikowane w zależności od sytuacji klinicznej. Wybór najodpowiedniejszego schematu leczniczego jest oparty na badaniach naukowych wskazujących najskuteczniejszą metodę z uwzględnieniem stanu pacjenta i profilu toksyczności.
Podstawowym warunkiem doboru leków w programie leczniczym jest ich odmienny mechanizm działania przeciwnowotworowego. Program wielolekowy zapewnia więcej interakcji między lekami a heterogenną populacją komórek nowotworowych. Zapobiega to selekcji komórek opornych na grupę leków i utrudnia wywarzanie oporności na cytostatyki. W programach wielolekowych komórki oporne na jeden lek mogą być niszczone przez inny cytostatyk o odmiennym profilu działania. Schematy powinny uwzględniać znane wzorce oporności krzyżowej (grupowej) na leki. Cytostatyki wchodzące w skład schematu muszą być skuteczne jako pojedyncze leki. Leki, gdy tylko jest to możliwe, powinny mieć odmienny wzór toksyczności zależnej od dawki. Może to zapobiegać rozwinięciu powikłań o wysokim nasileniu. Ułatwia to kontrolowanie objawów niepożądanych i redukuje ryzyko konieczności przerwania lub redukcji dawki z powodu działania toksycznego. Istotne są również odstępy, w jakim są podawane cytostatyki. Właściwy dobór czasu podania umożliwi najbardziej efektywne działanie leku w trakcie największej wrażliwości komórki na cytostatyk. Leki działające w fazie S będą najbardziej skuteczne w trakcie poprawy syntezy po okresie supresji syntezy kwasów nukleinowych spowodowanej dużą masą guza. Zatem poprzedzanie ich podaniem leków nieswoistych dla fazy może spowodować redukcję masy guza, a tym samym mobilizację nieaktywnych komórek do syntezy DNA. Niezwykle ważne są interakcje między lekami. Wiele leków, w tym również cytostatyki, może wpływać na stężenie, aktywność czy metabolizm innego leku. Przykładem może być interakcja między metotreksatem a 5-fluorouracylem. Metotreksat podany przynajmniej godzinę przed 5-fluorouracylem zwiększa aktywność tego drugiego. Dzieje się tak ze względu na nasilenie aktywacji 5-fluorouracylu do formy nukleotydowej. Z kolei odwrotna sekwencja, w której 5-fluorouracyl poprzedza metotreksat, skutkuje osłabieniem działania przeciwnowotworowego metotreksatu.
| Typ nowotworu | Lek | Akronim |
| Chłoniaki nieziarnicze | Cyklofosfamid, winkrystyna, prednizon | COP/CVP |
| Cyklofosfamid, doksorubicyna, winkrystyna, prednizolon | CHOP | |
| Cyklofosfamid, doksorubicyna, winkrystyna, etopozyd, prednizon | CHOEP | |
| Cyklofosfamid, doksorubicyna, windezyna, bleomycyna, prednizon | ACVBP | |
| Cyklofosfamid, doksorubicyna, winkrystyna, deksametazon, metotreksat, cytarabina | HYPER-CVAD | |
| Etopozyd, karboplatyna, ifosfamid | ICE | |
| Deksametazon, cytarabina, cisplatyna | DHAP | |
| Etopozyd, metylprednizolon, cytarabina, cisplatyna | ESHAP | |
| Chłoniak Hodgkina | Doksorubicyna, bleomycyna, winblastyna, dakarbazyna | ABVD |
| Bleomycyna, etopozyd, doksorubicyna, cyklofosfamid, winkrystyna, prokarbamazyna, prednizon | BEACOPP | |
| Rak trzustki | Leukoworyna (folinian wapnia), 5-fluorouracyl, irynotekan, oksaliplatyna | FOLFIRINOX |
| Rak żołądka | Epirubicyna, cisplatyna, 5-fluorouracyl | ECF |
| Epirubicyna, cisplatyna, kapecytabina | ECX | |
| Rak jelita grubego | 5-fluorouracyl, leukoworyna (folinian wapnia), oksaliplatyna | FOLFOX |
| Leukoworyna (folinian wapnia), 5-fluorouracyl, irynotekan | FOLFIRI | |
| Kapecytybina, oksaliplatyna | XELOX | |
| Rak płuca | Etopozyd, cisplatyna | EP |
| Cyklofosfamid, doksorubicyna, winkrystyna | CAV | |
| Cyklofosfamid, doksorubicyna, etopozyd | CAE | |
| Gemcytabina, cisplatyna | GemCis | |
| Nowotwory głowy i szyi | Cisplatyna, 5-fluorouracyl | PF |
| Rak piersi | Doksorubicyna, cyklofosfamid | AC |
| Doksorubicyna, paklitaksel | AT | |
| Cyklofosfamid, doksorubicyna, 5-fluorouracyl | CAF | |
| Docetaksel, doksorubicyna, cyklofosfamid | TAC | |
| Fluorouracyl, epirubicyna, cyklofosfamid | FEC | |
| Epirubicyna, cyklofosfamid | EC | |
| Gemcytabina, paklitaksel | GT | |
| Gemcytabina, karboplatyna | – | |
| Cyklofosfamid, metotreksat, 5-fluorouracyl | CMF | |
| Rak jajnika | Paklitaksel, karboplatyna | PC |
| Bleomycyna, etopozyd, cisplatyna | BEP |
Dawkowanie
Ważnym czynnikiem wpływającym na skuteczność chemioterapii jest osiągnięcie skutecznej dawki leków. Odpowiedź guza na leczenie nie jest zależnością liniową, a raczej krzywą sigmoidalną, która w porównaniu do normalnych tkanek wykazuje wyraźną selektywność oddziaływania w guzie nowotworowym. Część liniowa krzywej zwykle jest stroma, co oznacza, że na tym etapie zmniejszenie dawki leku prowadzi do bardzo znaczącego spadku skuteczności leczenia, a w praktyce jego niezdolność do całkowitego wyleczenia choroby. Redukcja dawki nawet pojedynczego leku z programu leczniczego może prowadzić do nadmiernego wzrostu populacji komórek nowotworowych wrażliwych na lek, którego dawkę zredukowano, a jednocześnie opornych na inne leki z kombinacji.
Liczba niszczonych komórek nowotworowych, poza samą wielkością podanej dawki, jest zależna również od odstępów między dawkami, gdyż lek jest eliminowany z organizmu i musi być ponownie podany. Zależność wielkości dawki w stosunku do czasu jego podania opisuje intensywność dawki. Zapewnienie odpowiedniej intensywności dawki ma duże przełożenie na wyniki leczenia, a jej obniżenie może być przyczyną zmniejszonej skuteczności terapii. W związku z tym cytostatyki podaje się w możliwie wysokich dawkach w możliwie krótkich odstępach czasu, ponieważ zbyt niskie dawki lub zbyt długie odstępy między nimi skutkują zbyt niską intensywnością dawki. Ograniczeniem wielkości dawki i jej intensywności są efekty toksyczne. Przerwy między kolejnymi cyklami leczenia ogranicza konieczność poprawy funkcji najbardziej wrażliwych narządów, którym zwykle jest szpik kostny. W związku z tym, że najbardziej nasilony okres uszkodzenia szpiku (nadir) w przybliżeniu przypada na 14 dzień po podaniu leków, zwykle stosuje się 14–28 dniowe odstępy między kolejnymi cyklami leków. Po osiągnięciu pewnej dawki leku jej dalsze zwiększanie nie powoduje zwiększenia nasilenia niszczenia komórek nowotworowych, ale może zwiększać efekty toksyczne.
Konieczność realizacji skutecznej dawki leku wiąże się z zapewnieniem odpowiedniej intensywności dawki leku. Koncepcja intensywnej dawki wiąże się ze zwiększeniem dawki leku w standardowym czasie jej podania (eskalacja dawki), z kolei koncepcja gęstej dawki oznacza standardową dawkę leku w skróconym czasie jej podawania. Wykazano, że zwiększona intensywność lub gęstość dawki wiąże się z większym współczynnikiem odpowiedzi na leczenie dla wielu typów nowotworów złośliwych.
Standardowo dawka leku jest obliczana w stosunku do pola powierzchni ciała (BSA), które z kolei jest wyliczone ze wzoru matematycznego lub nomogramu uwzględniającego wagę i wzrost. Wzór wywodzi się z badania z 1916 roku i pierwotnie służył do szacowania dawek u ludzi na podstawie badań nad zwierzętami. Gdy w latach 50. wprowadzono chemioterapię do leczenia onkologicznego, przyjęto wzór BSA jako oficjalny standard dawkowania chemioterapii wobec braku lepszych opcji.
Wielu autorów kwestionuje wiarygodność tej metody obliczania dawki, ponieważ nie uwzględnia ona wielu stanów wpływających na farmakokinetykę i farmakodynamikę leku, w tym wieku, płci, otyłości, nasilenia metabolizmu leku, funkcji narządów, interakcji lekowych, czynników genetycznych i współistniejących chorób. Dawkowanie w oparciu o wzór BSA u otyłych chorych jest bardzo trudne, a dawka często jest arbitralnie obniżona i zwykle jest ona zbyt niska. W badaniu 33 leków dawkowanych metodą BSA pozwalała ona zmniejszyć zróżnicowanie osobnicze tylko w przypadku 5 leków. Inne badanie wykazało, że różnice klirensu (współczynnik oczyszczania) zbadanych leków dawkowanych metodą BSA wynosiły aż od 30 do 70%, a zatem metoda często nie przekłada się na indywidualizację efektów działania wielu leków.
Wielu leczonych faktycznie nie otrzymuje właściwej dawki, gdy jest ona wyliczona na podstawie BSA, część pacjentów otrzymuje zbyt dużą dawkę, a część zbyt małą. W randomizowanym badaniu klinicznym Gamelin i współpracownicy wykazali, że w raku okrężnicy leczonym 5-fluorouracylem aż 85% leczonych nie uzyskało optymalnej dawki terapeutycznej, która w 68% była zbyt niska, a w 17% była zbyt wysoka.
Wiele badań sugeruje, że dawka powinna być indywidualizowana w celu osiągnięcia optymalnej ekspozycji, co przekłada się na lepsze wyniki leczenia i mniejsze skutki uboczne leczenia. W badaniu Gamelina leczeni 5-fluorouracylem z monitorowaniem stężenia leku w surowicy osiągali przeżycie całkowite dłuższe o 6 miesięcy w porównaniu do leczonych bez monitorowania stężenia, czemu również towarzyszyła niższa toksyczność leczenia. Podobne wyniki uzyskano w badaniu z terapią monitorowaną farmakokinetycznie w leczeniu raka jelita grubego schematem FOLFOX, gdzie chorzy leczeni z monitorowaniem stężenia leku osiągali dłuższe przeżycia całkowite i mniejszą toksyczność leczenia niż leczeni w oparciu o metodę BSA.
Terapia z monitorowaniem stężenia leków ma duży potencjał w poprawieniu skuteczności leczenia za pomocą środków, które w większości mają skomplikowaną farmakokinetykę oraz wąski indeks terapeutyczny, gdzie po jego przekroczeniu pojawiają się nasilone efekty toksyczne, a zbyt niskie stężenie grozi nieskutecznością leczenia. Monitorowanie stężenia leku jest już rutynowo stosowane podczas leczenia za pomocą leków przeciwpadaczkowych, immunosupresyjnych i niektórych antybiotyków.
Ograniczeniem tej metody jest brak ustalonego indeksu terapeutycznego dla wielu leków, a dodatkowo komplikuje bardzo wiele różnych typów nowotworów, z których każdy może mieć unikalną zależność efektu od dawki.
Droga podania
Większość chemioterapeutyków jest podawana dożylnie, choć niektóre leki mogą być podane doustnie lub innymi drogami. W niektórych sytuacjach leki muszą być podawane miejscowo, aby pokonać naturalne bariery utrudniające penetrację leku i zmniejszające jego skuteczność w celu uniknięcia nasilonej toksyczności ogólnoustrojowej. Istotnym problemem jest zapewnienie długotrwałego dostępu dożylnego, który umożliwia długotrwałe leczenie dożylne lekami, które często działają drażniąco na małe naczynia obwodowe.
Droga doustna
Liczba leków, które można podawać drogą doustną, jest dość ograniczona. Droga doustna odgrywa większą rolę w chemioterapii paliatywnej, gdzie znacznie większe znaczenie odgrywa prostota i wygoda przyjmowania leków, która zwiększa jakość życia chorych. Jest to podyktowane właściwościami farmakologicznymi chemioterapeutyków, które często nie wchłaniają się wystarczająco z przewodu pokarmowego i nie osiągają skutecznego stężenia lub leki są zbyt drażniące dla przewodu pokarmowego. Nawet gdy pewne leki są dostępne w formie doustnej, to nie zawsze ta droga jest najodpowiedniejsza dla leczonego, ponieważ wymioty, biegunki, zaburzenia połykania lub wchłaniania stanowią ograniczenia dla tej drogi podaży leków. Niektóre leki (np. kapecytabina) są podawane w formie proleków pozbawionych działania cytostatycznego do czasu przekształcenia ich w substancję czynną, co umożliwia podaż w formie doustnej.
Droga dożylna
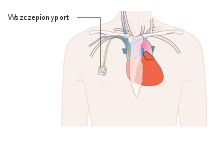
Droga dożylna wymaga odpowiedniego dostępu do żyły, do której będą podawane leki. Dostęp dożylny może być czasowy na czas podawania chemioterapii za pomocą kaniuli dożylnej (wenflon) lub igły z drenem (igła typu „motylek”) lub stały poprzez chirurgicznie zakładane porty wewnątrznaczyniowe. Rodzaj dostępu dożylnego musi być starannie wybrany, uwzględniając przewidywany rodzaj i czas leczenia, ze szczególnym uwzględnieniem rodzajów podawanych leków.
Stały dostęp jest znacznym udogodnieniem dla chorych, u których przewiduje się wielokrotne czy wielogodzinne wlewy leków. Jest on wymagany w przypadku leków drażniących i ulcerogennych, które wykazują duże ryzyko znacznego uszkodzenia tkanek w przypadku ich wynaczynienia. Również jest niezbędny w sytuacji występowania znacznych odczynów naczyniowych na podawane leki. Dostęp długoterminowy do dużego naczynia również może być konieczny w żywieniu pozajelitowym, nawadnianiu dożylnym, w przypadku częstego podawania produktów krwiopochodnych oraz trudności z uzyskaniem dostępu do obwodowych żył.
Długotrwały dostęp do naczynia centralnego może być osiągnięty za pomocą różnych technik i cewników. Najczęściej stosuje się cewniki centralne, cewniki centralne wprowadzone z dostępu obwodowego (PICC), porty naczyniowe, cewniki tunelizowane (cewniki Broviaca, Hickmana i Groshonga).
Cewniki centralne są stosunkowo proste do założenia, wymiany lub usunięcia. Mogą być używane jako jednokanałowe lub wielokanałowe. Są zakładane do żyły szyjnej wewnętrznej, podobojczykowej lub żyły udowej. Mogą być stosowane zarówno w intensywnej opiece nad chorym, opiece pooperacyjnej, jak i również do długotrwałego podawania leków lub terapii wspomagającej. Mogą być stosowane przez 7–14 dni i nie nadają się do długotrwałej opieki ani leczenia ambulatoryjnego. Ten typ cewnika charakteryzuje największe ryzyko zakażenia lub przemieszczenia cewnika. Cewniki tunelizowane są zakładane chirurgicznie, przebiegając w kanale podskórnym, oddalają miejsce wejścia do żyły od miejsca przejścia cewnika przez skórę. Zapobiega to szerzeniu się zakażenia po zewnętrznej stronie cewnika. Mankiet umieszczony na części przechodzącej przez skórę umożliwia wrastanie tkanki podskórnej, co dodatkowo chroni go przed inwazją flory bakteryjnej skóry. Pozwala to na dłuższe utrzymywanie cewnika. Cewniki PICC poprzez zastosowanie metody Seldingera mogą być umieszczane do żyły centralnej, zwykle żyły podobojczykowej, z dostępu przez żyłę obwodową. Mogą być stosowane do długotrwałej terapii, jednak zwykle są stosowane do krótkiego 2–3 tygodniowego leczenia. Całkowicie wszczepialne porty naczyniowe posiadają umieszczone pod skórą zakończenie umożliwiające wielokrotne podanie leków poprzez samouszczelniającą się silikonową membranę. Membrana umożliwia wielokrotne przekłuwanie igłą i wielokrotną podaż cytostatyków. Zakończenie portu zwykle jest umieszczane na ścianie klatki piersiowej. Porty naczyniowe znacząco upraszczają podawanie leków u chorych wymagających długotrwałej chemioterapii lub żywienia pozajelitowego. Urządzenia nie przeszkadzają w wykonaniu tomografii komputerowej lub rezonansu magnetycznego. Porty naczyniowe są najlepszym rozwiązaniem dla pacjentów wymagających długotrwałego podawania leków, produktów krwiopochodnych lub żywienia pozajelitowego. Zastosowanie portów naczyniowych obecnie jest rutynowym postępowaniem, jednak czynnikiem ograniczającym ich zastosowanie jest ich wysoki koszt.
Cewniki naczyniowe wymagają stałej opieki, na którą składa się profilaktyka powikłań infekcyjnych i zamknięcia światła cewnika przez zakrzep. Tunelizowane cewniki wymagają więcej opieki od całkowicie wszczepialnych urządzeń i są one ograniczeniem aktywnego trybu życia. Wymagają one codziennego płukania heparyną z solą fizjologiczną. Cewnik powinien być zakryty podczas kąpieli. Cewniki PICC wymagają częstej zmiany opatrunków i częstego płukania heparynizowanym roztworem soli fizjologicznej. W czasie podawania leków porty naczyniowe wymagają warunków aseptycznych. Płukanie heparyną musi być przeprowadzane co 8–12 tygodni. Pacjenci mogą się kąpać już po 24–48 godzin po założeniu, a port nie ogranicza znacząco aktywności fizycznej.
Droga dotętnicza
Podawanie leków dotętniczo jest znacznie trudniejsze technicznie do wykonania i obarczone większym ryzykiem powikłań od dożylnego podawania leków. W związku z tym ta metoda podaży cytostatyków jest stosowana wyłącznie w leczeniu miejscowym, gdzie podanie dotętnicze pozwala zastosować znacznie większe stężenia leków, które podane ogólnoustrojowo w niższych dawkach nie są wystarczająco skuteczne. Celem terapii dotętniczej jest ekspozycja guza na zwiększone stężenie leków w obszarze zasilonym przez daną tętnicę, a następnie regresję guza, przy jednoczesnym stosowaniu ogólnoustrojowej terapii dożylnej lub doustnej. Zmniejszenie ogólnej toksyczności nie jest głównym celem dotętniczej terapii miejscowej, zwykle stosuje się dawki maksymalnie w stosunku do maksymalnej toksyczności miejscowej i ustrojowej.
Terapia dotętnicza wymaga odpowiedniego dostępu do tętnicy, który może być uzyskany chirurgicznie lub metodami radiologii interwencyjnej (przezskórnie pod kontrolą skopii). Do krótkoterminowej terapii cewnik jest wprowadzany metodami radiologii interwencyjnej do tętnicy promieniowej lub tętnicy udowej, a do długotrwałej terapii wykorzystuje się cewniki wprowadzane chirurgicznie. Jest to związane z wagą ryzyka przemieszczenia się cewnika, powikłaniami zakrzepowymi, ryzykiem zakażenia oraz z obciążeniem chorego zabiegiem. Metody radiologii interwencyjnej pozwalają precyzyjnie wprowadzić cewnik w pożądane miejsce przy mniejszym obciążeniu dla chorego w porównaniu do metody operacyjnej. Z drugiej strony cewniki wprowadzone metodą chirurgiczną wykazują mniejszą skłonność do przemieszczania się w związku z ruchem chorego, w tym również ruchami oddechowymi. Przezskórnie wprowadzone cewniki rzadko utrzymują stabilność dłużej niż kilka tygodni. Cewniki wykorzystywane do przezskórnego wprowadzenia mają większy potencjał do uszkodzenia ściany tętnicy i wywołania zakrzepu w porównaniu do cewników wprowadzonych chirurgicznie, które są znacznie miększe i nie mają zagiętej końcówki. Chirurgicznie wprowadzone cewniki zwykle są połączone z portem naczyniowym, co zmniejsza ryzyko zakażenia. Poważnym problemem jest zakażenie martwicy leczonego guza, który jest szczególnie podatny na wzrost bakterii. Cewnik dotętniczy może być źródłem czynników infekcyjnych powodujących zakażenie martwych tkanek.
Dotętniczo cytostatyki można podawać do tętnicy wątrobowej w paliatywnym leczeniu przerzutów raka jelita grubego do wątroby. Terapia dotętnicza ma uzasadnienie w unikalnym unaczynieniu tego narządu. Większość substancji odżywczych do prawidłowej tkanki wątroby jest dostarczane przez żyłę wrotną, z kolei guzy są w większości zaopatrywane z tętnicy wątrobowej. Chemioterapia podana dotętniczo stwarza szansę zwiększonego wychwytu w guzie i jednoczesnego zaoszczędzenia prawidłowej tkanki wątroby. Najczęściej stosowanym lekiem w leczeniu przerzutów raka jelita grubego jest floksurydyna, która jest pochodną 5-fluorouracylu. Podana dotętniczo w przerzucie osiąga 15-krotnie większe stężenie niż po podaniu dożylnym. W randomizowanych badaniach wykazano wzrost odsetka remisji od 20 do 50% w porównaniu ze standardową chemioterapią ogólnoustrojową. Połączenie chemioterapii dotętniczej i ogólnoustrojowej może być korzystne u niektórych chorych z nieoperacyjnymi przerzutami raka jelita grubego do wątroby, również może być zastosowana w leczeniu uzupełniającym po resekcji przerzutów raka jelita grubego do wątroby.
Chemioterapia dotętnicza bywa wykorzystywana w leczeniu nieoperacyjnych nowotworów głowy i szyi. Leki są podawane do tętnicy szyjnej zewnętrznej. Cisplatyna wykazuje aktywność w tej grupie nowotworów; podczas różnych badań nad jej wykorzystaniem w leczeniu miejscowym uzyskano odsetek obiektywnych odpowiedzi u 50–70% leczonych. Wyniki te jednak nie odbiegają od dożylnego podania cisplatyny i 5-fluorouracylu.
Izolowana perfuzja i infuzja
Izolowana terapia lokalna jest metodą chemioterapii miejscowej, w której daną część ciała czasowo odcina się od krążenia i podaje się dotętniczo duże dawki chemioterapii. Mimo różnych potencjalnych anatomicznie miejsc do takiej terapii niemal wyłącznie znalazła ona zastosowanie w terapii kończyn, gdzie izolacja od krążenia dużego nie jest tak problematyczna. Izolowana perfuzja kończyny jest metodą, w której kończyna jest wyłączona z krążenia dużego za pomocą opaski uciskowej. Główne naczynia są podłączone do kaniul, przez które przepływa mieszanina krwi pełnej i soli fizjologicznej, która jest dotleniona i ogrzana w układzie pozaustrojowym. Zabieg jest przeprowadzany w warunkach łagodnej hipertermii. Izolowana infuzja do kończyny jest techniką mniej inwazyjną od izolowanej perfuzji kończyny. Cewniki nie są zakładane chirurgicznie, a za pomocą nakłucia tętnicy pod kontrolą skopii. Wlew leków jest przeprowadzany po zaciśnięciu opaski uciskowej przez 20–30 minut. Na koniec zabiegu podany roztwór jest aktywnie usuwany z krwiobiegu, do kaniuli tętniczej jest podawany roztwór krytaloidów, a z kaniuli żylnej jest on wypompowywany za pomocą strzykawki lub pompy. Metoda ze względu na krótki czas niedokrwienia nie wymaga oksygenatora, nie wymaga również kontroli monitorującej ucieczkę krwi z lekami z odizolowanego krążenia do krążenia dużego. Nie stosuje się hipertermii. Ograniczeniem metody może być powstające niedotlenienie i kwasica, które nasilją lokalną toksyczność oraz brak kontroli przecieku do krążenia ogólnoustrojowego, co może zwiększać toksyczność ogólnoustrojową.
Izolowana perfuzja kończyny lub izolowana infuzja znalazły zastosowanie w leczeniu czerniaka i mięsaków. W leczeniu rozproszonych przerzutów in-transit czerniaka może być zastosowana izolowana perfuzja kończyny albo izolowana infuzja z podaniem melfalanu z lub bez TNF-α. Metaanaliza wykazała odsetek odpowiedzi całkowitych wynoszący około 60% i odsetek odpowiedzi obiektywnych wynoszący 90%. Izolowana perfuzja kończyny jest wykorzystywana w leczeniu miejscowo zaawansowanego lub słabo kontrolowanego mięsaka jako metoda pozwalająca uchronić przed amputacją kończyny. Stosuje się połączenie melfalanu i TNF-α. Badano również możliwość izolowanej perfuzji płuc w celu leczenia niektórych przerzutów.
Chemioterapia dootrzewnowa
Chemioterapia dootrzewnowa jest metodą, w której leki przeciwnowotworowe zostają podane do jamy otrzewnej, gdzie nowotwór jest bardziej eksponowany na działanie leków ze względu na znacznie wyższe stężenie leku w porównaniu do podania układowego oraz dłuższego czasu działania. Warunkiem powodzenia terapii tym samym lekiem po częściowej odpowiedzi jest brak bezwzględnej oporności guza na zastosowane wcześniej leczenie, ponieważ tylko wtedy wyższe stężenie leku pozwala przezwyciężyć rozwijającą się całkowitą oporność. Głównym problemem tej metody jest sposób penetracji leku do guza, który odbywa się za pomocą dyfuzji z otrzewnowej powierzchni guza, a nie za pośrednictwem kapilar. Głębokość penetracji leku do guza jest stosunkowo płytka i wynosi około 1–2 mm. Terapia jest skuteczna tylko w przypadku występowania małych (<1 cm) guzków.
Metoda może być zastosowana w leczeniu choroby resztkowej raka jajnika po skutecznym leczeniu ogólnoustrojowym lub równoczesnego zastosowania z chemioterapią ogólnoustrojową w celu późniejszej cytoredukcji. Wykazano wydłużenie przeżycia u chorych, u których zastosowano neoadiuwantową chemioterapię dootrzewnową przed operacją cytoredukcyjną.
Chemioterapia dootrzewnowa może być użyta jako terapia adiuwantowa lub neoadiuwantowa raka żołądka u chorych z dużym ryzykiem nawrotu. Również może być zastosowana w leczeniu międzybłoniaka otrzewnej po operacji cytoredukcyjnej.
Droga dokanałowa
Opony mózgowo-rdzeniowe stanowią naturalną barierę, która jest trudna do pokonania przez leki cytostatyczne. Przechodzenie leków z krwi do płynu mózgowo-rdzeniowego jest bardzo ograniczone. W sytuacji, gdy leki muszą być podane do płynu mózgowo rdzeniowego, stosuje się chemioterapię dokanałową lub dokomorową.
Chemioterapia dokanałowa jest to metoda podania leków do płynu mózgowo-rdzeniowego poprzez nakłucie lędźwiowe, polegające na wprowadzeniu igły punkcyjnej w odcinku lędźwiowym kręgosłupa do przestrzeni podpajęczynówkowej, a następnie podaniu leków.
Chemioterapia dokomorowa jest podawana za pomocą zakładanego neurochirurgicznie zbiornika Ommaya, który składa się z cewnika kończącego się w komorze bocznej oraz zbiornika położonego pod skórą, do którego za pomocą strzykawki podaje się leki. Bywają również wykorzystywane zbiorniki lędźwiowe, choć te są mniej skuteczne.
Ograniczeniem tych metod jest niewielka penetracja leku, który musi dyfundować do guza i jest mało skuteczna w głębszych warstwach guza. Ponadto lek, który już przeniknie, ulega ucieczce do krążenia przez kapilary guza. Zmiany powyżej 5 mm nie są skutecznie leczone lokalnym podaniem leku. Guz zmniejsza również przestrzeń podpajęczynówkową, co również ogranicza skuteczność tej terapii. Chemioterapia dokanałowa i dokomorowa jest wykorzystywana w leczeniu rakowatości opon oraz zapobieganiu inwazji OUN przez niektóre nowotwory o wysokim ryzyku nacieku, szczególnie ostrej białaczki limfoblastycznej i agresywnych chłoniaków.
W ostrej białaczce limfoblastycznej w celu prewencji nacieku OUN dokanałowo podaje się metotreksat oraz przeprowadza się radioterapię całego OUN. U dorosłych takie postępowanie redukuje ryzyko nacieku mózgowia z ponad 30% do 11%. W ostrej białaczce szpikowej zajęcie OUN nie jest częste, obecne schematy nie uwzględniają profilaktyki OUN.
W przypadku chłoniaków zwiększone ryzyko zajęcia OUN i nawrotu występuje w przypadku choroby bardziej zaawansowanej klinicznie. Największe ryzyko dotyczy chłoniaków nieziarniczych, a czynnikami ryzyka są zaawansowane stadium kliniczne choroby, zajęcie więcej niż jednego narządu pozawęzłowego, zajęcie szpiku, narządu miąższowego, skóry, podwyższone stężenie LDH, fenotyp B, występowanie objawów B (gorączka, spadek masy ciała, nocne poty), młody wiek i zły stan kliniczny chorego. Chorzy o wysokim ryzyku nawrotu po osiągnięciu remisji powinni otrzymywać profilaktykę OUN, którą może być metotreksat podany dokanałowo, naświetlenie OUN lub wysoka dawka metotreksatu podawana doustrojowo.
Terapia dokanałowa bywa stosowana w leczeniu paliatywnym niektórych guzów litych. Niektóre badania wskazują na korzyści chemioterapii dokanałowej w leczeniu zajęcia OUN w raku niedrobnokomórkowym płuc i czerniaku. Dokanałowa podaż metotreksatu może być stosowana w paliatywnym leczeniu bólu w przerzutowym raku piersi jako alternatywa podaży dożylnej.
Leczenie miejscowe
Miejscową chemioterapię stosuje się również w leczeniu nieczerniakowych nowotworów skóry.
Oporność
Zdolność populacji komórek nowotworowych do wytwarzania oporności na każdy dostępny lek przeciwnowotworowy jest poważną przeszkodą w wyleczeniu chorych na nowotwór. Wytwarzanie oporności jest związane z występowaniem losowych mutacji w materiale genetycznym komórek nowotworowych oraz z koniecznością dostosowania się przez komórki nowotworowe do nowych niekorzystnych warunków środowiska – cytostatyków. W wyniku skutecznego działania leków dochodzi do selekcji na komórki oporne na podane leki oraz na komórki, które są podatne na zastosowane leczenie i są w różnym stopniu eliminowane. Podobne mechanizmy działają w przypadku selekcji oporności bakterii na antybiotyki.
Rozróżnia się oporność naturalną (oporność samoistna), gdzie linie komórkowe wykazują wysoką odporność już od początku leczenia, bez selekcji linii komórkowych w konsekwencji działania leku oraz odporność nabytą na cytostatyki, która rozwija się w miarę leczenia, gdzie w rezultacie selekcji komórek przez leki dochodzi do powstawania nowych opornych linii komórkowych. Oporność nabyta prowadzi do braku pożądanej reakcji na zastosowane leczenie mimo początkowej odpowiedzi. Rzadko jest to oporność absolutna, częściej jest ona względna, gdzie wzrost komórek jest wciąż hamowany w wyższych stężeniach leku.
Oporność nie oznacza, że żadna komórka nowotworowa nie jest niszczona, oznacza tylko, że liczba komórek niszczonych jest niższa od wzrostu komórek i w rezultacie następuje stopniowy wzrost guza. Jeśli to działanie przynosi opóźnienie czasu podwojenia guza, to klinicznie może być to obserwowane jako przedłużenie średniego czasu przeżycia.
Wytwarzanie oporności jest związane z powstawaniem spontanicznych mutacji w materiale genetycznym komórki nowotworowej, które w przybliżeniu pojawiają się ze stałym prawdopodobieństwem (hipoteza Goldie-Coldman). Mutacja powodująca oporność na lek pojawia się już w bardzo niewielkiej populacji 105 komórek nowotworowych. Zgodnie z tym założeniem należy spodziewać się, że 1 cm guz, który zawiera około 109 komórek, będzie posiadał klon komórek opornych przynajmniej na jeden lek. Jednak liczba komórek opornych może być bardzo mała, dlatego guzy początkowo reagują częściową lub całkowitą remisją, ale komórki oporne mogą nawracać jako oporny klon, który stopniowo będzie stanowił coraz większy odsetek guza. Tłumaczy to większą skuteczność wielolekowych programów leczniczych, które mają potencjał do przełamania oporności na pojedyncze leki.
Zgodnie z modelem Luria-Delbrück, gdy losowa mutacja wystąpi we wczesnym etapie wzrostu populacji, to będzie to skutkować wysokim udziałem w populacji komórek opornych. W niektórych przypadkach mutacja spontaniczna zachodzi późno, czego konsekwencją będzie mały udział komórek opornych w guzie. Również jest możliwe, że mutacja powstaje późno i w momencie włączenia leczenia nie ma w niej komórek opornych.
Ryzyko wystąpienia mutacji powodującej oporność na lek jest bezpośrednio uzależnione od prawdopodobieństwa wystąpienia pojedynczej mutacji i liczby komórek nowotworowych. Im większy jest guz, tym większe jest ryzyko występowania losowych mutacji i spada prawdopodobieństwo wyleczenia.
W klasycznym modelu cytostatyki bezpośrednio powodują śmierć komórki w rezultacie interakcji działania leku i jego farmakologicznego punktu uchwytu (miejsca działania). Obecnie wiadomo, że taka interakcja jest tylko początkowym bodźcem, który uruchamia kaskadę enzymatyczną prowadzącą do apoptozy. Szlak ten jest bardzo skomplikowany i mocno zależy od mechanizmów działających w prawidłowych komórkach, z których wywodzi się nowotwór.
Ważnym mechanizmem oporności jest inaktywacja białka p53, które jest ważnym białkiem supresorowym, ma zdolność do zatrzymania cyklu komórkowego i jest silnym induktorem procesu zaprogramowanej śmierci komórki (apoptozy). Mutacja genu p53 jest obserwowana w co najmniej 50% przypadków nowotworów złośliwych. W rezultacie mutacji białka p53 dochodzi do zablokowania procesu niszczenia komórki nowotworowej, mimo potencjalnie letalnych zmian w komórce indukowanych chemioterapią lub radioterapią. Mutacje wpływające na układ białka p53 lub w jakimkolwiek innym elemencie układu apoptozy mogą powodować bardzo silną oporność na wiele grup leków przeciwnowotworowych i radioterapię. Bardzo wysoki stopień oporności na wiele leków wykazują mutanty z niedoborem przynajmniej jednej kaspazy (enzymy bezpośrednio kontrolujące apoptozę). Istnieją również inne mechanizmy generowania śmierci komórki niewymagającej aktywacji białka p53 lub kaspaz do skutecznego działania, jednak są one mało poznane. Prawdopodobnie bardzo wysokie dawki leków mogą powodować uruchomienie innych szlaków prowadzących do śmierci komórki, które są niezależne od p53. Również mechanizm katastrofy mitotycznej i martwicy nie zależy od p53.
Rozwój oporności jest w większym stopniu związany z niestabilnością genetyczną, deregulacją kluczowych genów zaangażowanych w cykl komórkowy i apoptozę, niż ze spontanicznymi specyficznymi mutacjami powodującymi konkretne biochemiczne mechanizmy oporności na leki.
Klinicznie oporność zwykle jest wieloczynnikowa. Istnieją trzy podstawowe mechanizmy oporności na leczenie: oporność kinetyczna (zależna od cyklu komórkowego), biochemiczna i farmakologiczna.
Oporność kinetyczna
Komórki mogą wykazywać obniżoną wrażliwość na lek swoisty dla fazy z powodu pozostawania w etapie cyklu komórkowego, w którym dany lek nie wykazuje działania. Przeważnie jest to zjawisko tymczasowe, jeśli stężenie leku pozostanie odpowiednio długo wysokie, to wiele komórek nowotworowych będzie w tym czasie ulegało podziałowi i wejdzie w fazę cyklu, w której będą wrażliwe na działanie cytostatyku.
W rzeczywistości jest to model dość uproszczony, ponieważ zniesienie mechanizmów punktu kontrolnego przejścia z fazy G0 do podziału jest jedną z podstawowych zmian, które występują w komórkach nowotworowych, dlatego koncepcja istnienia fazy G0 w komórkach nowotworowych jest kwestionowana. Komórki nowotworowe mogą się przestać dzielić w warunkach, w których są ograniczone składniki odżywcze i czynniki wzrostu, zostają one zatrzymane w różnych etapach cyklu komórkowego.
Oporność biochemiczna
Oporność uwarunkowana mechanizmami biochemicznymi obejmuje oporność spowodowaną brakiem możliwości aktywacji leku do postaci aktywnej, nasiloną inaktywację leku przez komórki nowotworowe poprzez zwiększoną ekspresję enzymów degradujących leki, oporność poprzez zmniejszenie wychwytu leku lub nasilenie usuwania leku (np. P-gp), wewnątrzkomórkową redystrybucję, nasiloną naprawę DNA oraz poprzez zmiany enzymów docelowych (np. zmiany topoizomerazy II).
Bardzo ważnym mechanizmem oporności wielolekowej (MDR) jest czynne usuwanie z komórki wielu rodzajów leków za pomocą P-gp (glikoproteina P).
W rezultacie tych mechanizmów dochodzi do zmniejszenia liczby cząsteczek aktywnej formy leku poniżej minimalnej wartości powodującej śmierć komórki. Opisano ogromną liczbę mechanizmów wytwarzanych przez komórki nowotworowe powodujących brak aktywności leków przeciwnowotworowych.
Oporność farmakologiczna
Oporność na leki może wynikać z niewystarczającego zaopatrzenia w krew guza, zmniejszonego wchłaniania leku, jego nasiloną degradację lub w efekcie interakcji lekowych. Skutkuje to zmniejszonym stężeniem leku we krwi, które naśladuje rzeczywistą oporność na lek. Nie jest to oporność w ścisłym rozumieniu tego pojęcia.
Działania niepożądane
Chemioterapia niesie ze sobą wiele możliwych działań niepożądanych, które zależą od zastosowanych leków. Cytostatyki działają głównie na szybko dzielące się komórki, jakimi są komórki nowotworowe, ale również wpływają niekorzystnie na szpik kostny, nabłonek jamy ustnej, żołądka i jelit. Toksyczność związana z chemioterapią może wystąpić natychmiast po podaniu, w ciągu kilku godzin, dni lub po dłuższym okresie od kilku tygodni do kilku lat. W związku z coraz lepszą diagnostyką i uleczalnością chorób nowotworowych oraz polepszeniem rokowania, znaczenia nabierają odległe powikłania leczenia.
Mielosupresja i immunosupresja
| Parametr (109/l) | Leukocyty | Neutrofile | Limfocyty |
| Stopień 0 | 4,0 | 2,0 | 2,0 |
| Stopień 1 | 3,9–3,0 | 1,9–1,5 | 1,9–1,5 |
| Stopień 2 | 2,9–2,0 | 1,4–1,0 | 1,4–1,0 |
| Stopień 3 | 1,9–1,0 | 0,9–0,5 | 0,9–0,5 |
| Stopień 4 | <1,0 | <0,5 | <0,5 |
Niemal wszystkie schematy chemioterapeutyczne mogą spowodować zahamowanie czynności szpiku kostnego (mielosupresja), prowadząc do zmniejszenia liczby leukocytów, erytrocytów i trombocytów. Najbardziej nasilony okres uszkodzenia szpiku kostnego (nadir), a tym samym obniżenie liczby elementów morfotycznych krwi, przypada na 6–14 dzień po podaniu, choć pochodne nitrozomocznika, melfalan i busulfan wywołują nadir 4–6 tygodni po podaniu. Po tym okresie zazwyczaj następuje samoistna regeneracja szpiku, a liczba elementów komórkowych krwi powraca do normy. W związku z tym stosuje się kursy chemioterapii co 14–28 dni, aby szpik miał czas się odnowić. Objawy kliniczne są uzależnione od nasilenia uszkodzenia konkretnej linii hematopoetycznej i liczby poszczególnych elementów morfotycznych we krwi.
Uszkodzenie układu białokrwinkowego występuje u 40–80% leczonych chemioterapią, a ryzyko neutropenii wynosi 25–40%. Neutropenię powodują niemal wszystkie cytostatyki z wyjątkiem bleomycyny i asparaginazy. Największe ryzyko jej wystąpienia pojawia się przy stosowaniu leków alkilujących. Neutropenia może objawiać się gorączką oraz zakażeniami bakteryjnymi lub grzybiczymi (gorączka neutropeniczna), które mogą być przyczyną zgonów leczonych. Ważna jest ścisła obserwacja chorych. Gorączka neutropeniczna wymaga hospitalizacji, szybkiej diagnostyki i empirycznej antybiotykoterapii. W leczeniu stosuje się również czynniki wzrostu granulocytów (G-CSF, GM-CSF) oraz przetoczenia koncentratu granulocytarnego (KG). W przypadkach stosowania agresywnego leczenia cytostatykami i przewidywanej nasilonej granulocytopenii z objawami klinicznymi profilaktycznie podaje się rekombinowane czynniki wzrostu granulocytów.
Małopłytkowość z objawami skazy krwotocznej jest wskazaniem do przetoczenia koncentratu krwinek płytkowych (KKP), zwykle 30 000 płytek/μl wystarcza do zapewnienia prawidłowej hemostazy. Najczęściej małopłytkowość powoduje busulfan, pochodne platyny, pochodne nitrozomocznika, taksany, doksorubicyna, gemcytabina, etopozyd i 5-fluorouracyl. Jednak niski poziom płytek może spowodować odroczenie chemioterapii, ze względu na ryzyko poważnych krwawień, w tym krwawienia wewnątrzczaszkowego lub do przewodu pokarmowego. Leczenie cytostatykami może powodować łatwą skłonność do krwawień, co może nasilać lub wywoływać anemię. Jest to spowodowane zmniejszeniem liczby trombocytów, co może prowadzić do siniaków i krwawienia. Bardzo niski poziom trombocytów może być leczony poprzez przetoczenie koncentratu krwinek płytkowych (KKP).
Niedokrwistość
Niedokrwistość jest to częste powikłanie leczenia przeciwnowotworowego, które znacznie pogarsza funkcjonowanie i jakość życia chorego. Nieleczona prowadzi do pogorszenia stanu ogólnego, co negatywnie przekłada się na rokowanie.
Ocenia się, że dotyczy ona 50% chorych leczonych chemioterapią, podczas gdy u nieleczonych występuje ona u 33%.
Może ona być spowodowana mielosupresją związaną z chemioterapią, krwawieniem z guza, hemolizą krwinek, niedokrwistością chorób przewlekłych (ACD) oraz niedoborami żywieniowymi. Leczenie polega na podaży suplementów żelaza, erytropoetyny lub transfuzji koncentratów krwinek czerwonych. Leczenie erytropoetyną może zmniejszyć zapotrzebowanie na transfuzje.
Neutropeniczne zapalenie jelit
Neutropeniczne zapalenie jelit jest to uszkodzenie błony śluzowej przewodu pokarmowego w przebiegu choroby nowotworowej lub leczenia przeciwnowotworowego z wtórnym jej zakażeniem w wyniku neutropenii. Szacunkowa częstość jej występowania w różnych badaniach waha się od 0,8 do 26%, znacznie częściej występuje u dzieci niż u dorosłych. Najczęściej dotyczy chorych z białaczką leczonych agresywną chemioterapią.
Do uszkodzenia błony śluzowej dochodzi na skutek zaburzeń immunologicznych, uszkodzeń błony śluzowej przez stosowaną chemioterapię, w wyniku niedokrwienia jelit oraz mikrokrwawienia. Najczęstszymi zakaźnymi czynnikami etiologicznym są bakterie Gram-ujemne. Obraz kliniczny jest niespecyficzny, odróżnienie neutropenicznego zapalenia jelit od uszkodzeń związanych z cytostatykami lub zajęcia przewodu pokarmowego przez chorobę rozrostową (szczególnie przez białaczki) może być trudne. Głównymi objawami są gorączka, ból brzucha i biegunka, możliwe są nudności, wymioty. Stwierdzenie pogrubienia ściany jelita grubego w USG lub tomografii komputerowej jest podstawą do rozpoznania.
Podstawową metodą leczenia jest antybiotykoterapia za pomocą leków o szerokim spektrum działania, żywienie pozajelitowe oraz zwalczanie neutropenii.
Uszkodzenie przewodu pokarmowego
Najczęstszym działaniem niepożądanym w obrębie przewodu pokarmowego jest zapalenie błony śluzowej, które może dotyczyć każdego jego odcinka, ale najczęściej jest to jama ustna i przełyk. Błona śluzowa jest zaczerwieniona, obrzęknięta, występują miejscowe nadżerki, owrzodzenia lub martwica. Występują trudności z połykaniem pokarmów, a czasem nawet połykania płynów. Zapobieganie polega na utrzymaniu właściwej higieny jamy ustnej i unikaniu drażniących substancji, w tym również alkoholu i nikotyny. Leczenie polega na regularnym płukaniu jamy 0,9% roztworem chlorku sodu i podawaniu lidokainy lub sukralfatu w formie zawiesiny.
W wyniku niedokrwienia indukowanego przez niektóre leki stosowane w leczeniu nowotworów (taksany oraz bewacizumab), działania czynników infekcyjnych (Candida, CMV), choroby przeszczep przeciw gospodarzowi, autoimmunologicznego zapalenia jelita grubego po leczeniu ipilimumabem, nadciśnienia wrotnego indukowanego oksaliplatyną oraz neutropenicznego zapalenia jelit może dojść do krwawienia do przewodu pokarmowego. Postępowanie jest właściwie takie samo jak w przypadku krwawienia do przewodu pokarmowego o innych przyczynach. Stosowane jest leczenie endoskopowe, choć w niektórych przypadkach może być ono ryzykowne.
Perforacja przewodu pokarmowego może być efektem samoistnej albo indukowanej leczeniem martwicy guza, może być również wynikiem progresji owrzodzenia spowodowanego chemioterapią, szczególnie stosowanej razem z kortykosteroidami lub NLPZ. Leczenie jest chirurgiczne.
Niedokrwienie i martwica jelita może być efektem stanu nadkrzepliwości związanej z lekami cytostatycznymi. Niedrożność jelit zwykle dotyczy jelita cienkiego lub esicy po radioterapii miednicy. Może być spowodowana przez zmiany w pasażu jelitowym, zrosty, zwłóknienia i zwężenia indukowane radioterapią oraz zwężenie spowodowane przez sam guz lub rakowatość otrzewnej. Również opiaty stosowane w leczeniu bólu mogą być powodem niedrożności porażennej.
Nudności i wymioty
Nudności i wymioty związane z chemioterapią (CINV) są to częste, uciążliwe i obniżające jakość życia oraz codzienne funkcjonowanie chorych działania niepożądane leczenia przeciwnowotworowego. Nudności i wymioty prowadzą do niedoborów żywieniowych, anoreksji i mogą skutkować przedwczesnym przerwaniem leczenia. Szacuje się, że około 60% leczonych chemioterapią doświadcza nudności, a 36% wymiotów. Wyróżnia się kilka podtypów CINV:
- ostry – pojawia się w ciągu 24 godzin od podania leków,
- opóźniony – występuje od 24 godzin od podania do 5–7 dni,
- wyprzedzający – wywołany przez smak, zapach, wspomnienie lub lęk związany z chemioterapią,
- oporny – nie odpowiada na optymalną terapię przeciwwymiotną,
- przełamujący – występuje mimo leczenia profilaktycznego.
W profilaktyce i leczeniu stosuje się inhibitory receptorów 5-HT3 (ondansetron, dolasetron, granisetron, tropisetron, tamosetron), aprepitant, deksametazon, metoklopramid i chlorpromazynę. W przypadku podawania chemioterapii złożonej z kilku cytostatyków stosuje się przeciwdziałanie adekwatne do cytostatyku o najsilniejszych właściwościach ematogennych w danym schemacie leczenia. W przypadku chemioterapii o niskim potencjale emetogennym w profilaktyce ostrego CINV stosuje się steroid (deksametazon) przez pierwsze 24 godziny. Niektóre wytyczne (ang. National Comprehensive Cancer Network, NCCN) rekomendują również chlorpromazynę oraz metoklopramid. W przypadku chemioterapii o umiarkowanym ryzyku wystąpienia nudności i wymiotów stosuje się inhibitory receptora 5-HT3, deksametazon z lub bez aprepitatem. Wytyczne MASCC (ang. Multinational Association of Supportive Care in Cancer) oraz ASCO (ang. American Society of Clinical Oncology) zalecają potrójne połączenie antagonistów receptora 5-HT3, deksametazonu i aprepitatu u chorych leczonych antracyklinami lub cyklofosfamidem. Z kolei wytyczne NCCN wskazują na stosowanie potrójnego połączenia również przy stosowaniu innych leków o umiarkowanym ryzyku CINV. W przypadku opóźnionego CIMV stosuje się deksametazon. Jeśli aprenpitat jest stosowany w profilaktyce ostrego CIMV, to powinien być stosowany w profilaktyce opóźnionego CIMV w monoterapii (wytyczne ASCO i MASCC). Połączenie aprenpitatu z deksametazonem w tej sytuacji jest sugerowane przez zalecenia NCCN. Antagonisty receptora 5-HT3 mogą być stosowane jako alternatywa. W profilaktyce CINV spowodowanych przez leki o dużym potencjale emetogennym stosuje się jednocześnie inhibitory receptora 5-HT3, deksametazon oraz aprepitant. W przypadku opóźnionego CINV, który występuje u 60–90% leczonych cisplatyną, stosuje się aprepitant w kombinacji z deksametazonem.
| Ryzyko wystąpienia nudności i wymiotów | Profilaktyka | |
| Wytyczne MASCC | ||
| Minimalne | Ostre | Bez rutynowej profilaktyki |
| Opóźnione | Bez rutynowej profilaktyki | |
| Niskie | Ostre | Deksametazon |
| Opóźnione | Bez rutynowej profilaktyki | |
| Pośrednie | Ostre | 5-HT3 + deksametazon + aprepitant albo 5-HT3 + deksametazon |
| Opóźnione | Aprepitant Deksametazon albo 5-HT3 + deksametazon |
|
| Wysokie | Ostre | 5-HT3 + deksametazon + aprepitant |
| Opóźnione | Deksametazon + aprepitant | |
| Wytyczne ASCO | ||
| Minimalne | Ostre | Bez rutynowej profilaktyki |
| Opóźnione | Bez rutynowej profilaktyki | |
| Niskie | Ostre | Deksametazon |
| Opóźnione | Bez rutynowej profilaktyki | |
| Pośrednie | Ostre | 5-HT3 + deksametazon + aprepitant albo 5-HT3 + deksametazon |
| Opóźnione | Aprepitant albo 5-HT3 + deksametazon |
|
| Wysokie | Ostre | 5-HT3 + deksametazon + aprepitant |
| Opóźnione | Deksametazon + aprepitant | |
| Wytyczne NCCN | ||
| Minimalne | Ostre | Bez rutynowej profilaktyki |
| Opóźnione | Bez rutynowej profilaktyki | |
| Niskie | Ostre | Deksametazon ± lorazepan Chlopropramid ± lorazepan |
| Opóźnione | Bez rutynowej profilaktyki | |
| Pośrednie | Ostre | 5-HT3 + deksametazon + aprepitant ± lorazepan albo 5-HT3 + deksametazon ± lorazepan |
| Opóźnione | Aprepitant ± deksametazon ± lorazepan albo 5-HT3 + deksametazon ± lorazepan |
|
| Wysokie | Ostre | 5-HT3 + deksametazon + aprepitant ± lorazepan |
| Opóźnione | Deksametazon + aprepitant ± lorazepan | |
Powikłania sercowo-naczyniowe
Powikłania sercowo-naczyniowe są jednym z najważniejszych działań niepożądanych chemioterapii, które prowadzą do istotnego zwiększenia zachorowalności i śmiertelności. Jest to związane z coraz dłuższą przeżywalnością chorych na nowotwór, dzięki czemu coraz ważniejsze stają się efekty odległe leczenia przeciwnowotworowego. Przyczyn uszkodzenia układu krążenia jest wiele, mogą być one związane z leczeniem, ale również mogą być one spowodowane uszkodzeniem spowodowanym przez samą chorobę nowotworową – zajęcie serca i osierdzia w badaniu pośmiertnym jest obserwowane u 15–30% chorych na nowotwory złośliwe. Nie bez znaczenia jest fakt starzenia się społeczeństw oraz występowanie wspólnych czynników ryzyka. Chorzy onkologicznie zwykle mają jeden lub więcej czynników ryzyka sercowo-naczyniowego (np. wiek, palenie tytoniu, nadciśnienie tętnicze, otyłość, hiperlipidemia). Chemioterapia ma bezpośredni wpływ toksyczny na serce, na powikłania zakrzepowo-zatorowe oraz hemodynamikę. Leczenie skojarzone zwiększa ryzyko kardiotoksyczności, szczególnie w połączeniu z radioterapią.
Wyróżnia się kardiotoksyczność ostrą (do 2 tygodni od podania), przewlekłą (do 12 miesięcy od ostatniej dawki leku) i opóźnioną (od 1 roku do 5 lat od leczenia).
Zaburzenia czynności serca mogą manifestować się na wiele sposobów. Kardiotoksyczność ostra objawia się zaburzeniami rytmu i przewodzenia oraz innymi zmianami w EKG (nieprawidłowości w repolaryzacji, wydłużeniem odstępu QT, nadkomorowe i komorowe zaburzenia rytmu serca), łagodnymi zmianami ciśnienia, dysfunkcją zastawek, indukowaniem niedokrwienia oraz ostrych zespołów wieńcowych, zapalenia osierdzia i mięśnia sercowego. Późniejsze formy manifestują się jako bezobjawowa dysfunkcja skurczowa lub rozkurczowa (kardiomiopatia) i zmniejszenie frakcji wyrzutowej (LVEF), co może prowadzić do przewlekłej niewydolności serca, co ostatecznie może doprowadzić do śmierci. Obserwuje się również zmiany w naczyniach wieńcowych z objawami choroby wieńcowej oraz zaburzenia rytmu i przewodzenia.
Do kardiotoksyczności może dojść w wielu mechanizmach:
- bezpośrednia toksyczność dla kardiomiocytów, która skutkuje zarówno skurczową, jak i rozkurczową niewydolnością mięśnia sercowego. Może być to związane z generowaniem wolnych rodników i w konsekwencji uszkodzeniem błony komórkowej, wzrostem jej przepuszczalności oraz zmianami w syntezie ATP, obniżeniem aktywności peroksydazy glutationowej oraz uszkodzeniem mitochondrialnego DNA.
- zaburzenia rytmu serca jako następstwo toksyczności komórkowej lub w efekcie zakłócania działania kanałów błonowych
- indukcja zapalenia mięśnia sercowego z albo bez zapalenia osierdzia z bezpośrednią dysfunkcją mięśnia sercowego lub dysfunkcją spowodowaną następstwami mechanicznymi wywołanymi przez wysięk
- indukcja niedokrwienia przez wazoaktywne działanie niepożądane leków, tworzenie zakrzepów lub toksyczność naczyniową leków.
Leczenie może zaburzać krzepliwość i prowadzić do zakrzepicy oraz powikłań zatorowych. Leki mogą powodować uszkodzenie śródbłonka i aktywować kaskadę krzepnięcia. Szczególnie cisplatyna może aktywować agregację płytek. Fluorouracyl i jego prolek kapecytabina powodują niedokrwienie mięśnia sercowego prawdopodobnie poprzez skurcz naczyń wieńcowych. Również paklitaksel i docetaksel rzadko powodują niedokrwienie.
Kardiotoksyczność niektórych leków jest rzadka, ale może dotyczyć ponad 20% leczonych doksorubicyną, daunorubicyną lub fluorouracylem. Powikłania sercowo-naczyniowe najczęściej dotyczą leków z grupy antacyklin, cyklofosfamidu (w wysokich dawkach), taksanów (paklitaksel, docetaksel), 5-fluorouracylu (szczególnie we wlewie ciągłym) oraz kapecytybiny, ifosfamidu, busulfanu, karmustyny, chlorometyny, mitomycyny, cisplatyny, winkrystyny i winblastyny, etopozydu, tenipozydu, fludarabiny, kladrybiny, cytarabiny, amsakryny, asparaginazy.
Szczególnie kardiotoksyczność antracyklin stanowi istotny problem kliniczny. Są to leki stosowane w najczęściej występujących nowotworach złośliwych w wielu schematach leczniczych. Uszkodzenie mięśnia sercowego dotyczy wszystkich obecnie stosowanych leków z tej grupy oraz mitoksantonu (pochodna antracyklin). Toksyczność tych leków zależy od podanej dawki, a ryzyko kardiotoksyczności przewlekłej rośnie po przekroczeniu dawki kumulacyjnej, która jest indywidualna dla każdego leku. Kardiotoksyczność ostra nie zależy od dawki i zwykle jest przemijająca, obejmuje przejściowe zaburzenia rytmu serca (zwykle tachykardia zatokowa), zapalenie mięśnia sercowego z lub bez zapalenia osierdzia. Możliwe są epizody niedokrwienia pod postacią ostrego zespołu wieńcowego oraz hipotensja. Najpoważniejszym skutkiem ubocznym jest kardiomiopatia poantracyklinowa o obrazie klinicznym przewlekłej niewydolności serca. W retrospektywnej analizie wykazano, że kliniczną niewydolność serca rozwinęło około 2,2% leczonych antacyklinami. Częstość występowania kardiomiopatii jest związana z wielkością otrzymanej dawki całkowitej. U chorych otrzymujących dawkę 600 mg/m² kardiomiopatia występowała u 1,5% leczonych, ale przy dawce ponad 1000 mg/m² występowała już u 11%. Prawdopodobnie stosowanie mniejszych dawek podzielonych zmniejsza to ryzyko. Czynnikami ryzyka rozwoju kardiomiopatii w terapii antracyklinami są podeszły wiek, radioterapia śródpiersia i chemioterapia skojarzona z cyklofosfamidem, taksanami i trastuzumabem. Kariotoksyczność zwykle występuje po zakończeniu leczenia i może być dostrzegalna dopiero wiele lat po leczeniu, co jest szczególnie widoczne u dorosłych wyleczonych jeszcze jako dzieci. Nawet do 65% leczonych w dzieciństwie może posiadać echokardiograficzne cechy nieprawidłowej czynności skurczowej lewej komory.
Wykazano, że karwedilol (β-bloker) chroni przed dysfunkcją lewej komory spowodowanej leczeniem antracyklinami w wyniku jego efektu przeciwutleniającego, ale nie antagonizmem receptorów β. Enalapril (inhibitor ACEI) u chorych z podwyższonym stężeniem troponiny zapobiega spadkowi frakcji wyrzutowej lewej komory. Pegylowana liposomalna doksorubicyna wykazuje znacznie mniejszą toksyczność. Mniejszą toksyczność wykazuje również podanie leków za pomocą wlewu niż za pomocą bolusu. Deksrazoksan może być stosowany jako środek kardioprotekcyjny w leczeniu antracyklinami, w kilku badaniach wykazano zmniejszenie ryzyka wystąpienia zastoinowej niewydolności serca i zmniejszenia frakcji wyrzutowej lewej komory. Jednak lek prawdopodobnie osłabia działanie doksorubicyny, dlatego zaleca się jego stosowanie przy dawce powyżej 300 mg/m².
Wczesne wykrycie toksyczności może ograniczyć krótko- i długoterminowe niekorzystne skutki dla funkcji serca poprzez zmianę dawki, modyfikację lub zmianę schematu leczenia. Niezwykle istotna jest ocena wyjściowa chorego, która pozwala na wykrycie już istniejących chorób układu krążenia oraz monitorowanie zmian. Jedną z najważniejszych metod diagnostycznych jest echokardiografia. Pozwala ona ocenić frakcję wyrzutową oraz frakcje skracania. Frakcja wyrzutowa może być oceniona również za pomocą angiokardiografii radioizotopowej. EKG powinno być wykonane przed włączeniem każdej kardiotoksycznej chemioterapii. Zalecane jest wyjściowe oznaczenia troponiny I oraz NT-proBNP (N-końcowy propeptyd natriuretyczny typu B), a następnie okresową ich kontrolę, a w przypadku wzrostu stężenia należy poszerzyć diagnostykę. Do oceny wczesnej kardiotoksyczności jest przydatny rezonans magnetyczny serca. Metoda ta pozwala ocenić tętnice wieńcowe, osierdzie, określić perfuzję i żywotność mięśnia poprzez ocenę efektu pierwszego przejścia kontrastu oraz późnego wzmocnienia kontrastowego. Jednak wysoki koszt tej metody ogranicza jej przydatność w rutynowej diagnostyce. Leczeni cytostatykami powinni być monitorowani pod kątem powikłań kardiologicznych wiele lat po leczeniu.
Hepatotoksyczność
Choć leki cytostatyczne są bardzo toksyczne dla szybko dzielących się komórek, to wolno dzielące się hepatocyty są stosunkowo niewrażliwe. Jednak bardzo wysoka aktywność metaboliczna komórek wątroby może powodować nagromadzenie toksycznych metabolitów leków, które w różnych mechanizmach uszkadzają ten narząd. W praktyce liczne leki wykazują działanie toksyczne na wątrobę, które mogą obejmować niemal każdy wzór uszkodzenia wątroby: martwicę, stłuszczenie, zwłóknienie, cholestazę oraz uszkodzenie naczyń. Przyczyną uszkodzenia wątroby oprócz cytostatyków i innych leków stosowanych w leczeniu (w tym również leków przeciwwymiotnych, przeciwbólowych i antybiotyków) może być sama choroba nowotworowa w formie przerzutów do wątroby lub pierwotnego guza wątroby, współwystępowanie procesu rozrostowego z pierwotną chorobą wątroby, immunosupresja i zakażenia (w tym wirusowe zapalenie wątroby), deficyty żywieniowe oraz żywienie pozajelitowe.
Neuropatia obwodowa indukowana chemioterapią
Wiele leków stosowanych w leczeniu wykazuje działanie neurotoksyczne, co może skutkować zaburzeniami świadomości, drgawkami, niedokrwieniem ośrodkowego układu nerwowego, zaburzeniami słuchu oraz neuropatią. Najczęściej neurotoksyczność objawia się pod postacią neuropatii obwodowej, co w dużym stopniu jest skutkiem trudności z pokonaniem bariery krew-mózg, znacząco zmniejszając ryzyko powikłań ze strony mózgowia. Neuropatia obwodowa indukowana chemioterapią (ang. chemotherapy-induced peripheral neuropathy, CIPN) jest jednym z najczęstszych powikłań leczenia chemioterapią i dotyczy około 40–50% leczonych, choć przy stosowaniu niektórych leków może być częstsza. Powikłanie może dotyczyć 85–95% przyjmujących oksaliplatynę, 45–98% cisplatynę i 57–98% winkrystynę. W badaniu przeglądowym CIPN, przy ogólnej częstości występowania 48% w pierwszym miesiącu, po zakończeniu leczenia występowała u 68%, w 3 miesiącu po zakończeniu leczenia u 60%, a po 6 miesiącach u 30%. Neuropatia obwodowa indukowana chemioterapią powoduje znaczne obniżenie sprawności oraz jakości życia chorych.
Neuropatia najczęściej jest spowodowana przez pochodne platyny (cisplatyna, oksaliplatyna), alkaloidy barwinka różyczkowego (winkrystyna, winblastyna, winorelbina), taksany (paklitaksel, docetaksel), talidomid, lenalidonid i bortezonib.
Chorzy doświadczają wielu objawów o różnym stopniu nasilenia. Najczęściej są to parestezje, przeczulica lub ból neuropatyczny obejmujący głównie obwodowe części kończyn, często o typie „skarpetek i rękawiczek”. Chorzy odczuwają drętwienie, mrowienie, swędzenie, kłucie lub ból oraz nadwrażliwość na zimno i ciepło. Neuropatia nerwów kończyny dolnej prowadzi do utraty stabilności i upadków, a w górnej do zmniejszenia sprawności. Związki platyny mogą wywoływać objaw Lhermitte’a. Zaburzenia ze strony układu autonomicznego są rzadkie, ale mogą prowadzić do niedrożności jelit. Tego typu powikłania mogą towarzyszyć stosowaniu alkaloidów barwinka różyczkowego, taksanów i związków platyny. Funkcja ruchowa zwykle nie jest upośledzona, ale podczas leczenia winkrystyną i winblastyną mogą występować mononeuropatie nerwów czaszkowych. Niektóre leki mogą powodować mialgie, kurcze mięśni lub ich osłabienie.
Nie wiadomo czy stosowanie kilku leków o działaniu neurotoksycznym wpływa na częstość występowania i nasilenia neuropatii związanej z chemioterapią. Częstość i stopień nasilenia neuropatii zależą od rodzaju stosowanego leku, jego dawki skumulowanej, czasu podawania i istniejącej neuropatii obwodowej. Zwykle pojawia się na początku leczenia, ale oksaliplatyna i taksany mogą ją wywołać już po pierwszej dawce. W przypadku pochodnych platyny nawet po zaprzestaniu podawania leku neuropatia może pojawić się i postępować, a poprawa jest opóźniona. Zespół neuropatii związanej z chemioterapią zwykle jest odwracalny, choć nie zawsze w pełni.
Rozpoznanie zespołu jest oparte na wywiadzie, analizie czynników ryzyka i badaniu fizykalnym. Kliniczna ocena objawów słabo koreluje z samooceną pacjenta. Badanie fizykalne i badania pomocnicze nie są specyficzne dla każdego typu neuropatii obwodowej i są bardziej przydatne w zaawansowanych przypadkach. Elektroneurografia i elektromiografia zwykle wykazują uszkodzenie aksonalne. Jednak te badania ogniskują się na większych włóknach nerwowych, podczas gdy istota choroby tkwi w zakresie cienkich włókien, dlatego nie dostarczają dokładnych informacji o obecności zespołu czy jego nasilenia, więc ich dokładność jest niewystarczająca. Biopsja nerwu nie jest zalecana, chyba że wymaga tego diagnostyka różnicowa zmian zapalnych, zapalenia naczyń i neuropatii amyloidowej. Biopsja skóry, choć jest minimalnie inwazyjną procedurą, to ukazuje zmiany na dużym stopniu zaawansowania.
Zespołowi CIPN zapobiega się poprzez zmniejszenie dawki leków neurotoksycznych, zmianę schematu leczenia lub jego przerwanie. Istnieje kilka potencjalnych substancji neuroprotekcyjnych: neurotropina, amifostyna, glutation, wapń i magnez, glutamina, kwas α-liponowy, kapsaicyna, erytropoetyna, witaminy grupy B, witamina E i acetylol-I-karnityna. Jednak prawdopodobnie nie zapobiegają one rozwojowi neuropatii i wytyczne American Society of Clinical Oncology nie zalecają ich stosowania. Wenlafaksyna może wykazywać skuteczność większą od placebo w zmniejszaniu ostrej neurotoksyczności związanej z oksaliplatyną, ale obecnie nie jest zalecana do rutynowego stosowania, ze względu na zbyt słabe dowody.
Duloksetyna jest lekiem, który w dużym randomizowanym badaniu wykazała skuteczność w leczeniu bolesnej CIPN i jest zalecana w leczeniu tego zespołu. 59% leczonych duloksetyną odnotowało zmniejszenie objawów bólowych, w porównaniu do 38% leczonych placebo.
Trójpierścieniowe leki przeciwdepresyjne (nortryptylina, dezypramina), gabapentynapregabalina oraz żel złożony z baklofenu, amitryptyliny oraz ketaminy mogą być stosowane u chorych z CIPN mimo ograniczonych dowodów naukowych na ich skuteczność. Jest to związane z brakiem innych opcji terapeutycznych, stosunkowym bezpieczeństwem tych leków oraz obawami metodologicznymi, co do jakości obecnie przeprowadzonych badań oceniających ich skuteczność.
Nefrotoksyczność
Nerki są jedną z głównych dróg wydalających leki, a niektóre leki są potencjalnie nefrotoksyczne. Dysfunkcja nerek oraz wielolekowe schematy leczenia zwiększają ryzyko wystąpienia nefrotoksyczności podczas leczenia.
Nefrotoksyczność często jest działaniem niepożądanym chemioterapeutyków, które ogranicza ich dawkę. Zaburzenie czynności nerek może prowadzić do zmniejszenia wydalania leków i nasilenia ich toksyczności dla ustroju. Zaburzenia czynności nerek komplikują opiekę nad pacjentem oraz pogarszają wyniki końcowe. Ocenia się, że zaburzenia czynności nerek mogą dotyczyć aż 60% chorych na nowotwór.
Uszkodzenie nerek może być spowodowane przez zaburzenia elektrolitowe (np. wapń), odkładanie się w nerkach kwasu moczowego, paraprotein, paraneolpastyczną glomerulopatię, zespół rozsianego wykrzepiania wewnątrznaczyniowego (DIC) czy uropatię zaporową. Choć wiele nowotworów może wiązać się z zajęciem nerek, to zwykle nie powoduje to klinicznie istotnego upośledzenia ich funkcji, a tylko sporadycznie (0,5% wszystkich przypadków chłoniaka nerki) naciek miąższu nerki przez chłoniak może powodować ostrą niewydolność nerek. Wiele leków stosowanych w onkologii może powodować uszkodzenie nerek, szczególnie przy ich uszkodzeniu. W niektórych nowotworach w wyniku leczenia lub samoistnie może dojść do zespołu rozpadu guza. Chemioterapia może niekorzystnie wpływać na nerki poprzez uszkodzenie drobnych naczyń, kłębuszków nerkowych lub kanalików nerkowych. Ostra nefrotoksyczność zwykle jest odwracalna, ale stosowanie niektórych chemioterapeutyków może prowadzić do przewlekłej choroby nerek.
Do najważniejszych leków nefrotoksycznych należą cisplatyna, karboplatyna, metotreksat, ifosfamid i mitomycyna C. Ważnym klinicznie lekiem nefrotoksycznym jest cisplatyna. U około 30% leczonych cisplatyną dochodzi do zaburzenia czynności nerek po pierwszej dawce leku. Lek powoduje martwicę kanalików proksymalnych, poprzez uszkodzenie DNA komórek przez jego toksyczne metabolity. Powoduje to niewydolność nerek z upośledzeniem zdolności do zagęszczania moczu oraz hipomagnezemię, która prawdopodobnie nasila toksyczność dla nerek. Możliwy jest cukromocz, aminoacyduria. Powtarzające się ekspozycje na toksyczne działanie cisplatyny mogą doprowadzić do przewlekłej niewydolności nerek. Toksyczności związanej z cisplatyną można zapobiegać poprzez odpowiednie nawodnienie chorego. W przypadku wcześniejszej niewydolności nerek redukuje się dawkę leku. Karboplatyna, oksaliplatyna, nedaplatyna są mniej nefrotoksyczne od cisplatyny i są potencjalną alternatywą dla chorych z wysokim ryzykiem niewydolności nerek.
Ifosfamid jest przyczyną klinicznej nefrotoksyczności u 30% leczonych, a subkliniczna toksyczność kanalikowa może być obecna niemal u wszystkich leczonych. Lek powoduje uszkodzenie kanalików proksymalnych, a uszkodzenie dystalnych jest rzadsze. Ifosfamid może wywoływać nabyty zespół Fanconiego oraz moczówkę prostą nerkową. Całkowita dawka leku jest największym czynnikiem ryzyka nefrotoksyczności. Nefrotoksyczność zwykle jest odwracalna, ale u niektórych chorych funkcja może nadal się pogarszać mimo zaprzestania podawania leku.
Stosowanie metotreksatu w dużych dawkach powoduje wytrącanie się jego metabolitu w kanalikach nerkowych. Rozpuszczalność metotreksatu zależy od pH moczu i jego objętości, dlatego mała objętość moczu i jego kwaśny odczyn zwiększają ryzyko uszkodzenia nerek. Konkurencyjne hamowanie wydzielania cewkowego przez niektóre leki może nasilić toksyczność metotreksatu. Niektóre badania sugerują jego bezpośredni efekt toksyczny dla kanalików proksymalnych oraz spadek filtracji kłębkowej.
Niektóre leki mogą powodować mikroangiopatię zakrzepową. Największym ryzykiem tego powikłania charakteryzuje się mitomycyna C (ryzyko 2–10%), po przekroczeniu dawki kumulacyjnej 40 mg/m², mniejsze ryzyko dotyczy ciplatyny, bleomycyny i 5-fluorouracylu. Również gemcytabina może powodować mikroangiopatię zakrzepową, której częstość szacuje się na 0,31%.
Uszkodzenie płuc
Uszkodzenie płuc (pneumotoksyczność) jest poważnym problemem diagnostycznym w onkologii, ponieważ poza chemioterapią może być spowodowane samą chorobą nowotworową (guzem pierwotnym lub przerzutami do płuc) oraz radioterapią (popromienne zapalenie płuc oraz zwłóknienie płuc). Wiele leków może powodować uszkodzenie miąższu płuc, opłucnej, dróg oddechowych oraz naczyń krążenia płucnego. Najczęściej uszkodzenie płuc powoduje bleomycyna (toksyczność u 3–5% leczonych), karmustyna (toksyczność dotyczy 20–30% leczonych wysokimi dawkami leku) i metotreksat (3,5–7,6%, choć istnieją badania sugerujące wielokrotnie mniejszą częstość tego powikłania), znacznie rzadziej w przypadku leków alkilujących – cyklofosfamid i busulfan (około 1% leczonych). Polekowa toksyczność płucna (ang. drug-induced pulmonary toxicity, DIPT) zwykle występuje pod postacią śródmiąższowej choroby płuc.
Częstość występowania powikłań płucnych związanych z chemioterapią jest stosunkowo niska. Czynnikami ryzyka wystąpienia powikłań płucnych są wiek chorego, palenie tytoniu, skumulowana dawka leków toksycznych, równoczesna radioterapia klatki piersiowej, zaburzenie czynności nerek, stosowanie tlenoterapii oraz wcześniejsze zwłóknienie płuc.
Histologicznie cechy uszkodzenia płuc związanego z chemioterapią nie są specyficzne i mogą występować w wielu formach jako niespecyficzne śródmiąższowe zapalenie płuc, organizujące się zapalenie płuc, rozlane uszkodzenie pęcherzyków płucnych, zapalenie ziarniniakowe płuc, eozynofilowe zapalenie płuc oraz obrzęk płuc. Obraz histopatologiczny może się przekładać na różny obraz kliniczny. Pneumotoksyczność może być podzielona na toksyczność o wczesnym początku, która charakteryzuje się śródmiąższowym zapaleniem płuc oraz późnym z włóknieniem płuc i jego następstwami.
Typowo początkowo objawia się jako duszność i nieproduktywny kaszel. Często, choć nie zawsze występuje gorączka. W badaniu fizykalnym stwierdza się trzeszczenia. Zajęcie płuc może szybko postępować aż do ostrej niewydolności oddechowej (ARDS). W badaniach laboratoryjnych stwierdza się podwyższone stężenie białka C-reaktywnego (CRP), podwyższone OB i zwiększoną liczbę leukocytów we krwi. BAL wykazuje zwiększoną liczbę komórek, zwykle neutrofilów, limfocytów, rzadziej neutrofilów. Zdjęcie RTG ukazuje zmiany siateczkowo-guzkowe, choć możliwy jest prawidłowy obraz RTG. W TK można stwierdzić obraz typu „matowej szyby”, słabo zaznaczonych obszarów konsolidacji oraz guzki wewnątrzzrazikowe. Często konieczna jest biopsja płuca w celu wykluczenia innych rozpoznań. Rozpoznanie uszkodzenia płuc związanego z chemioterapią ze względu na brak jasnych kryteriów rozpoznania zwykle jest diagnozą z wykluczenia, szczególnie zakażenia i przerzutów do płuc, pod uwagę brany jest związek czasowy między zaistniałym uszkodzeniem płuc a podanym lekiem.
Leczenie polega na wycofaniu toksycznego leku oraz podaniu metyloprednizolonu (glikokortykosteroid). W przypadku wystąpienia niewydolności oddechowej stosuje się wentylację mechaniczną i leki rozszerzające oskrzela.
Bleomycyna jest najlepiej przebadanym lekiem stosunkowo często powodującym pneumotoksyczność. Najczęstszą jej formą jest zapalenie płuc związane z bleomycyną (ang. bleomycin-induced pneumonitis, BIP). Choć toksyczność znacząco zwiększa się po otrzymaniu dawki powyżej 500 mg, to może występować już w mniejszych ilościach, szczególnie gdy są obecne czynniki ryzyka zwiększonej toksyczności. Prawdopodobnie infuzja leku wiąże się z mniejszą toksycznością niż bolus leku.
Powikłania wynaczynienia cytostatyku
Leki przeciwnowotworowe mogą być podawane doustnie, jednak znacznie częściej są podawane dożylnie. W związku z tym istnieje ryzyko powikłań związanych z samym podaniem leku do żyły. Wynaczynienie leku jest to sytuacja, w której lek zostaje przypadkowo podany podskórnie albo do tkanki podskórnej otaczającej miejsce podania lub bezpośrednie nacieczenie tkanek. Może być spowodowane nieprawidłową procedurą podania leku lub w wyniku pęknięcia naczynia. Szacunkowa częstość występowania tego powikłania znacznie różni się w poszczególnych publikacjach i waha się od 0,01 do 7% wszystkich iniekcji leków, ale tylko w 0,01–1% przypadków staje się to przyczyną poważnych komplikacji.
Wynaczynione leki mogą powodować uszkodzenie, a nasilenie reakcji może się wahać od rumienia, obrzęku i bólu do martwicy wymagającej opracowania chirurgicznego. Stopień uszkodzenia tkanek zależy od rodzaju i stężenia leku, lokalizacji wynaczynienia oraz czasu, jaki upłynął od wystąpienia tego powikłania do wdrożenia leczenia.
Wynaczynienie silnie uszkadzającego leku powoduje powstanie nacieku oraz intensywnego bólu. Następnie w ciągu kilku godzin miejsce wynaczynienia staje się zaczerwienione, a pęcherze mogą powstać w ciągu kilku dni. U 25% w przypadku wynaczynienia silnie uszkadzającego leku w ciągu 1–4 tygodni rozwija się martwica, która może sięgać do głębokich tkanek. Martwicy towarzyszy bardzo silny ból, gojenie samoistne jest rzadkie i konieczne jest leczenie chirurgiczne. Z kolei leki drażniące powodują obrzęk, zaczerwienienie, ból, pieczenie, świąd, ewentualnie zapalenie żyły; nie powodują odległych następstw. Niezwykle ważna jest profilaktyka wynaczynienia. Nie należy podawać leków w okolicy stawów, grzbietowej części dłoni, żył bezpośrednio kontaktujących się z tętnicami, nerwami i ścięgnami. Nie należy podawać leków do naczyń, w których do 48 godzin wcześniej były podawane leki. Unika się podawania do kończyn z upośledzonym krążeniem, w tym również po stronie niedowładu, obrzęku i limfadenektomii. Leki silnie uszkadzające powinny być podawane przez wkłucia centralne. Przed i po podaniu leku naczynia należy przepłukać roztworem 0,9% NaCl lub 5% glukozą.
| Działanie | Leki |
| Ulcerogenne | Chlorometyna, doksorubicyna, daunorubicyna, epirubicyna, idarubicyna, daktynomycyna, mitomycyna, winblastyna, winkrystyna, windezyna, winorelbina |
| Drażniące | Karmustyna, cyklofosfamid, ifosfamid, melfalan, dakarbazyna, etopozyd, fluorouracyl, mitoksantron, streptozocyna |
| Niedrażniące | Asparaginaza, bleomycyna, bortezomib, kladrybina, cytarabina, gemcytabina, metotreksat |
Wynaczynienie można podejrzewać w przypadku zgłaszania przez leczonych lub zaobserwowania objawów wynaczynienia – braku powrotu krwi, przerwy w swobodnym przepływie oraz oporu na tłok strzykawki podczas podawania leku w bolusie.
W przypadku podejrzenia wynaczynienia należy zatrzymać podaż leku, nie usuwając kaniuli (cewnika), ponieważ za jego pomocą należy podjąć próbę aspiracji możliwie największej ilości cytostatyku. W każdym przypadku podejmuje się próbę aspiracji leku z tkanek. Kaniulę odłącza się dopiero po aspiracji i zaznaczeniu obszaru wynaczynienia. Należy unikać nacisku na tkanki objęte wynaczynieniem. Kończynę należy unieruchomić i unieść. W przypadku substancji niedrażniących, dodatkowo stosuje się zimny okład, a w przypadku drażniących należy podejmować dalsze czynności. W wynaczynieniu alkaloidów barwinka różyczkowego, taksanów oraz cisplatyny stosuje się ciepłe okłady.
W przypadku niektórych leków opracowano swoiste metody postępowania. Dla większości leków nie ma wyników badań z randomizacją potwierdzających skuteczność takiego postępowania.
Dimetylosulfotlenek (DMSO) jest stosowany miejscowo w leczeniu wynaczynienia antracyklin, mitomycyny C oraz pochodnych platyny. Obecnie nie ma wielu badań potwierdzających jego skuteczność. W badaniu z 1995 roku 144 chorych z wynaczynieniem różnych leków leczonych za pomocą DMSO tylko jeden chory rozwinął owrzodzenia.
Hialuronidaza jest enzymem rozkładającym kwas hialuronowy i zwiększającym przepuszczalność tkanki łącznej, a tym samym absorpcję leku przeciwnowotworowego. Lek jest stosowany w leczeniu wynaczynienia alkaloidów barwinka różyczkowego oraz taksanów. W modelach zwierzęcych lek zmniejszał wielkość i częstość występowania owrzodzeń po wynaczynieniu alkaloidów barwinka różyczkowego. Niewielkie badanie wskazuje na skuteczność tego postępowania.
Deksrazoksan może być stosowany w leczeniu wynaczynienia antracyklin. Istnieją badania potwierdzające skuteczność tego leku.
Tiosiarczan sodu może być zastosowany w przypadku wynaczynienia cisplatyny i mustyny.
W części przypadków konieczna jest interwencja chirurgiczna. W przypadku występowania martwicy lub bólu trwającego powyżej 10 dni konieczne jest opracowanie chirurgiczne.
Zespół przewlekłego zmęczenia
Uczucie ciągłego zmęczenia czy osłabienia stosunkowo często towarzyszy chorobie nowotworowej lub jej leczeniu. Zespół przewlekłego zmęczenia związanego z nowotworem może być zdefiniowany jako przewlekłe subiektywne odczucie fizycznego, emocjonalnego lub poznawczego zmęczenia związanego z nowotworem albo jego leczeniem, które jest nieproporcjonalne do ostatniej aktywności i zakłóca zwykłe funkcjonowanie. Występuje przewlekłe zmęczenie, osłabienie, stała potrzeba odpoczynku, „brak energii”, szybkie męczenie się, niechęć do wysiłku fizycznego lub umysłowego, zaburzenia koncentracji oraz uczucie senności.
Zespół może występować u 80–96% leczonych cytostatykami i prowadzi do poważnego pogorszenia jakości życia. Objawy osiągają największe natężenie po 48–72 godzinach od podania leków i stopniowo redukują swoje nasilenie, aż do całkowitego ustąpienia po zakończeniu leczenia. Jednak 30% leczonych odczuwa osłabienie po 6 miesiącach od zakończenia leczenia, a objawy mogą się utrzymywać nawet kilka lat po leczeniu.
Dotąd nie opracowano kryteriów rozpoznawania tego zespołu. Rozpoznanie jest stawiane na podstawie wywiadu, pomocniczą rolę pełnią skale nasilenia dolegliwości. Leczenie zespołu jest wielokierunkowe. Należy ocenić czy zespół nie wynika z postępu choroby nowotworowej. Konieczna jest optymalizacja farmakoterapii. Jeśli jest to możliwe, zmniejsza się dawki lub odstawia się leki działające hamująco na OUN, w tym leki przeciwwymiotne, antyhistaminowe, przeciwlękowe i nasenne. Ważnym elementem leczenia jest wdrożenie skutecznej terapii przeciwbólowej, ale gdy ból jest dobrze kontrolowany, może być konieczna redukcja dawki leków przeciwbólowych. Ważnym elementem leczenia jest walka z niedokrwistością. Istotne jest leczenie chorób współistniejących oraz wyrównanie istniejących zaburzeń metabolicznych (w tym zaburzeń stężenia wapnia, odwodnienia, niedotlenienia). Wskazana jest modyfikacja stylu życia, poprzez ograniczenie czuwania nocnego i zwiększenie aktywności dziennej oraz ćwiczenia fizyczne odpowiednie do możliwości chorego. Z powodu braku dowodów klinicznych na skuteczność leczenia farmakologicznego nie określono jego standardów. Stosuje się glikokortykosteroidy (deksametazon lub prednizon) lub leki przeciwdepresyjne (selektywne inhibitory zwrotnego wychwytu serotoniny).
Wypadanie włosów
Wypadanie włosów związane z chemioterapią (ang. chemotherapy-induced alopecia) jest częstym efektem ubocznym leczenia przeciwnowotworowego. Jest to jedno z najczęściej występujących działań niepożądanych leczenia. Wypadanie włosów w przybliżeniu dotyczy około 65% leczonych. Często jest to uważane przez leczonych za jedno z najbardziej uciążliwych działań ubocznych i ma wyraźnie negatywny wpływ na jakość życia.
W przebiegu leczenia może wystąpić utrata włosów skóry głowy, owłosienia łonowego, pod pachami, również do utraty rzęs oraz brwi. Najczęściej dochodzi do tego 2–3 tygodnie po rozpoczęciu chemioterapii. Zwykle jest to proces odwracalny i po zaprzestaniu chemioterapii w ciągu 3–6 miesięcy włosy całkowicie odrastają. Często odrośnięte włosy mają zmieniony kolor i strukturę, czasem może pozostać zmniejszona gęstość włosów. W przypadku chemioterapii wysokodawkowej utrata włosów może być trwała.
| Działanie | Leki |
| Zwykle wypadają włosy | cyklofosfamid, doksorubicyna, daunorubicyna, docetaksel, paklitaksel, etopozyd, irynotekan, ifosfamid, windezyna, winorelbina, topoteksan |
| Czasem wypadają włosy | amsakryna, bleomycyna, busulfan, cytarabina, 5-fluorouracyl, gemcytabina, lomustyna, winkrystyna, winblastyna, tiotepa |
| Rzadko wypadają włosy | cisplatyna, fludarabina, kapecytybina, karboplatyna, karmustyna, 6-merkaptopuryna, metotreksat, mitomycyna C, mitoksanton, prokarbazyna, streptozocyna |
Oziębianie skóry głowy jest metodą, która ma zapobiegać temu powikłaniu. Założeniem tej metody jest skurcz naczyń, który zmniejsza dopływ krwi do mieszków włosowych, co ogranicza absorpcję cytostatyku, drugim mechanizmem jest obniżenie poziomu przemian metabolicznych. Rzeczywista skuteczność tej metody zapobiegania wypadania włosów jest zmienna i nieprzewidywalna, choć część randomizowanych badań wskazuje na jej skuteczność. Oziębianie skóry głowy jest podejrzane o sprzyjanie powstawania przerzutów do oziębianej skóry. Wiąże się to z mechanizmem działania metody, ponieważ zwężenie naczyń ograniczające dostarczanie cytostatyków do mieszka włosowego ogranicza również dopływ leku do ewentualnego przerzutu. Część badań wskazuje na to ryzyko, a część go nie potwierdza.
Nie istnieje uznane leczenie farmakologiczne wypadania włosów związanego z chemioterapią. Minoksydyl jest lekiem stosowanym zewnętrznie jako środek wspomagający wzrost włosów. Niektóre badania wskazują, że 2% roztwór minoksydylu może skracać czas trwania tego powikłania, jednak nie zapobiega on samemu wypadaniu włosów. Nie wykazano, by kalcytriol był skuteczny w zapobieganiu wypadania włosów związanego z chemioterapią.
Zespół lizy guza
Zespół lizy guza jest spowodowany naturalną lub spowodowaną leczeniem masową śmiercią komórek nowotworowych i uwolnieniem ich zawartości, co w efekcie może doprowadzić do zaburzeń metabolicznych i elektrolitowych oraz niewydolności nerek. Uwolnienie kwasów nukleinowych powoduje hiperurykemię, a fosforu hiperfosfatemię i hipokalcemię. Kwas moczowy krystalizuje się w cewkach nerkowych, powodując ostrą niewydolność nerek. Zespół występuje w przypadku skutecznego leczenia nowotworów o dużej wrażliwości na cytostatyki. Zespołowi lizy guza zapobiega się poprzez odpowiednie nawodnienie, stosowanie inhibitorów oksydazy ksantynowej (allopurynol) i alkalizację moczu.
Wtórne nowotwory
Wtórne nowotwory są poważnym, choć rzadkim działaniem niepożądanym leczenia przeciwnowotworowego. Mogą być one spowodowane radioterapią, chemioterapią lub hormonoterapią. Zwiększona częstość występowania kolejnych nowotworów u chorych leczonych onkologicznie nie jest wyłącznie związana z samym leczeniem, ponieważ ta zależy również od predyspozycji genetycznej do chorób rozrostowych oraz od środowiskowych czynników ryzyka chorób nowotworowych. Korzyści wynikające z leczenia zagrażającej życiu choroby nowotworowej wielokrotnie przewyższają ryzyko działania niepożądanego związanego z indukcją wtórnych chorób nowotworowych. Wtórne nowotwory definiuje się jako występowanie dwóch lub więcej niezależnych od siebie nowotworów z wyłączeniem wznowy i przerzutów.
Najczęstszym wtórnym nowotworem po chemioterapii jest ostra białaczka szpikowa (AML). Zwykle pojawia się ona po 5–10 latach od leczenia za pomocą leków alkilujących lub inhibitorów topoizomerazy. W przypadku leczenia lekami alkilującymi, w przeciwieństwie do inhibitorów topoizomerazy, białaczkę poprzedza zespół mielodysplastyczny. Najważniejszym czynnikiem ryzyka rozwoju wtórnych nowotworów jest dawka skumulowana leków przeciwnowotworowych. Innymi czynnikami ryzyka jest kombinacja chemioterapii z radioterapią i wiek powyżej 40 lat. Najwyższe ryzyko dotyczy leków alkilujących, inhibitorów topoizomerazy i antacyklin. Zwiększone ryzyko wtórnej białaczki jest związane z leczeniem chłoniaka Hodgkina, chłoniaków nieziarniczych, raka piersi, raka płuca i raka jajnika. Skumulowane 10-letnie ryzyko wystąpienia ostrej białaczki szpikowej po leczeniu raka piersi wynosi 0,7%, a po leczeniu chłoniaka Hodgkina wynosi 2–10%. Ryzyko wystąpienia guzów litych w wyniku chemioterapii jest znacznie niższe. Istnieje zwiększone ryzyko wystąpienia raka pęcherza moczowego u leczonych cyklofosfamidem. Ryzyko jest zależne od otrzymanej dawki. Chorzy, którzy otrzymali lek w łącznej dawce 20–45 g, mają 6-krotnie zwiększone ryzyko, a przy dawce powyżej 45 g jest ono 14-krotnie zwiększone. U chorych leczonych z powodu nowotworu złośliwego zaleca się nadzór onkologiczny przez całe życie.
Bezpłodność
Bezpłodność jest częstym powikłaniem leczenia przeciwnowotworowego, dotyczy zarówno leczenia chirurgicznego, radioterapii, chemioterapii, hormonoterapii, jak i leczenia celowanego. Może być ona trwała lub przemijająca, samoistnie ustępująca po pewnym okresie od leczenia. Należy do najczęstszych długoterminowych powikłań różnych metod terapeutycznych. Powikłanie to ma duże znaczenie dla młodych ludzi, którzy prócz samej niemożliwości posiadania dzieci, mogą doświadczać przedwczesnej menopauzy lub andropauzy, które wiążą się z odpowiednimi następstwami ogólnoustrojowymi.
| Częstość | Mężczyźni | Kobiety |
| Często | cyklofosfamid, pochodne nitrozomocznika, prokarbazyna, chlorambucyl | busulfan, melfalan, cyklofosfamid, pochodne nitrozomocznika, prokarbazyna |
| Możliwa bezpłodność | cisplatyna, winblastyna, ifosfamid, etopozyd | cisplatyna, chlorambucyl, hydroksymocznik, winblastyna, aktymomycyna D |
| Rzadka bezpłodność | doksorubicyna, 5-fluorouracyl, merkaptopuryna, metotreksat, winkrystyna | bleomycyna, dakarbazyna, 5-fluorouracyl, metotreksat, wikrystyna |
Toksyczność u mężczyzn
Przez pierwsze 2 miesiące leczenia cytotoksycznego liczba plemników jest prawidłowo lub nieznacznie zmniejszona. Dopiero po 3 miesiącach, czyli po czasie koniecznym do zróżnicowania się spermatogonii, dochodzi do znacznego zmniejszenia liczby plemników (oligospermia), a rzadziej całkowitego braku plemników w nasieniu przy bardziej toksycznych dla gonad lekach (azoospermia). Aplazja jest związana ze zmianami stężenia FSH i inhibiny B, po terapii cytotoksycznej zachodzi tendencja do wzrostu stężenia FSH i obniżenia stężenia testosteronu do dolnych granic normy. Opisano również zaburzenia w przepływie krwi w jądrach, w efekcie dochodzi do niewydolności komórek Leydiga i niedoboru testosteronu. Jeśli leczenie nie powoduje zniszczenia spermatogonii lub nie zaburza ich różnicowania, to normospermia powraca po około 3 miesiącach od zakończenia terapii. Niskie dawki leków niszczących lub zaburzających różnicowanie spermatogonii wymagają około 2–3 lat do powrotu normospermii, a w większych dawkach brak plemników może być jeszcze bardziej długotrwały lub nawet stały. Najczęściej długotrwała niepłodność jest spowodowana lekami alkilującymi i cisplatyną. Obserwuje się efekty addytywne leków w schematach wielolekowych oraz połączeniach chemioterapii i radioterapii.
Nie ma skutecznej metody zapobiegania wystąpienia trwałej niepłodności u mężczyzn. Analogi gonadoliberyny (GnRH) i steroidy androgenne nie mają wystarczająco udokumentowanej skuteczności, a nawet pojedyncze badania wskazują na wręcz szkodliwe skutki tego postępowania. Rozwiązaniem mogą być metody kriokonserwacji nasienia i zapłodnienia pozaustrojowego, szczególnie metodą ICSI.
Toksyczność u kobiet
Mimo że fizjologicznie u dorosłej kobiety oocyty nie ulegają dalszym podziałom, to oocyty są bezpośrednio niszczone w trakcie radioterapii. Prawdopodobnie cytostatyki również powodują ich uszkodzenie, co sugerują badania na myszach i na ludzkich tkankach. Cytostatyki uszkadzają jednak dojrzewające pęcherzyki jajnikowe oraz pomocnicze komórki podścieliska. Zniszczenie oocytów powoduje również utratę komórek ziarnistych produkujących estrogeny. W efekcie dochodzi do skąpych miesiączek lub czasowego braku miesiączki. Leczenie cytostatykami często powoduje czasowy brak miesiączki, który czasem może trwać kilka lat. Trwały brak miesiączki może wystąpić w trakcie chemioterapii lub później po kilku latach rzadkiej miesiączki. Ryzyko wystąpienia trwałej niewydolności jajników wzrasta wraz z wiekiem.
Gdy leki przeciwnowotworowe spowodują zmniejszenie puli pęcherzyków pierwotnych, przedwczesne wygaśnięcie funkcji jajników może wystąpić już u młodych kobiet, które miesiączkowały po terapii. U kobiet, które otrzymały jednocześnie chemioterapię lekami alkilującymi i radioterapię w wieku 13–19 lat, średni wiek pojawienia się menopauzy wynosił 32 lata, z kolei u kobiet, które otrzymały wyłącznie chemioterapię lekami alkilującymi lub radioterapię, średni wiek wystąpienia menopauzy wynosił 44 lata.
Przedwczesne wygaśnięcie czynności jajników i związane z tym zmniejszenie ilości estrogenów powodują typowe następstwa metaboliczne przekwitania, jakimi są obniżenie gęstości masy kostnej i osteoporoza. Jednak w przypadku zastosowania wyłącznie chemioterapii, która w mniejszy sposób negatywnie wpływa na funkcję gonad, pozostała resztkowa funkcja jajnika powoduje mniejszą szybkość obniżenia gęstości masy kostnej w porównaniu do radioterapii miednicy.
Nie wiadomo, czy zahamowanie czynności jajników za pomocą doustnej antykoncepcji lub analogów gonadoliberyny może chronić je przed uszkodzeniem związanym z chemioterapią czy radioterapią. Badania przynoszą sprzeczne wyniki, część z nich wskazuje na skuteczność takiego postępowania, z kolei inne nie wskazują różnicy między grupą leczoną a kontrolną. Rozwiązaniem mogą być techniki zapłodnienia pozaustrojowego, jednak metody te wymagają podawania estrogenów, co ze względu na występującą chorobę nowotworową nie zawsze jest akceptowalne.
Teratogenność i mutagenność
Teratogenność i mutagenność w ciąży
Choroby nowotworowe w trakcie ciąży nie są zjawiskiem bardzo rzadkim, występują z częstością 1 na 1000 ciąż. Najczęstszymi chorobami rozrostowymi wikłającymi ciążę są rak piersi, szyjki macicy, jajnika, czerniak, ziarnica złośliwa i rak tarczycy. Działanie teratogenne i mutagenne zostało stosunkowo dobrze poznane na modelach zwierzęcych, jednak te dane są trudne do przełożenia na działanie u ludzi ze względu na różnice w podatności u różnych gatunków. Brakuje danych o rzeczywistym wpływie leków przeciwnowotworowych na rozwijający się organizm ludzki.
W okresie aktywnego leczenia przeciwnowotworowego zaleca się unikanie poczęcia dziecka, zalecenie dotyczy zarówno kobiet, jak i mężczyzn. Ryzyko uszkodzenia płodu jest zależne od rodzaju leku, jego dawki, częstości podawania i wieku ciążowego. Największe zagrożenie występuje w pierwszym trymestrze ciąży, w kolejnych trymestrach jest znacznie mniejsze. Niewielkie badania wskazują, że prawdopodobnie ekspozycja na cytostatyki w drugim i trzecim trymestrze niesie minimalne ryzyko dla płodu, a późniejszy rozwój po porodzie jest prawidłowy.
W sytuacji występowania choroby rozrostowej w trakcie ciąży leczenie wymaga bardzo starannego zaplanowania z oceną korzyści i ryzyka, w celu optymalnego leczenia matki bez znaczących szkód dla płodu. Należy unikać chemioterapii i radioterapii, często optymalną metodą jest leczenie chirurgiczne. Jeśli leczenie chirurgiczne nie jest możliwe, ocenia się, czy jest możliwość bezpiecznego odsunięcia leczenia za pomocą cytostatyków przynajmniej do drugiego trymestru, a najlepiej do czasu zakończenia ciąży. Chemioterapia może być podawana w drugim i trzecim trymestrze ciąży po uwzględnieniu najmniej teratogennych leków i schematów leczniczych.
Antagonisty kwasu foliowego (metotreksat, aninoneptyna) stosowane w pierwszym trymestrze ciąży powodują powstawanie wad rozwojowych OUN oraz twarzoczaszki. Talidomid wykazuje bardzo silne działanie teratogenne i nigdy nie może być stosowany w ciąży, już pojedyncza dawka leku może wywoływać ciężkie wady wrodzone kończyn (embriopatia talidomidowa) lub śmierć płodu. Za teratogenny uważany jest również lenalidonid – pochodna talidomidu. Bardzo wysokie ryzyko wad wrodzonych jest związane z kwasem cis-retinowym, szczególnie z izotretynoiną. Lek wielokrotnie zwiększa ryzyko wystąpienia dużej wady wrodzonej, a ryzyko jest porównywalne ze stosowaniem talidomidu. Antracykliny mogą powodować u płodu martwicę mięśnia sercowego. 5-fluorouracyl podawany w pierwszym trymestrze ciąży powoduje dysplazję kości promieniowej, adaktylię, hipolazję narządów klatki piersiowej i jamy brzusznej. Chlorambucyl jest związany z aplazją nerek, rozszczepem podniebienia oraz innymi wadami. Wady rozwojowe stwierdzono również w przypadku busulfanu, cisplatyny, winblastyny, winkrystyny, etopozydu.
Teratogenność i mutagenność po zakończonym leczeniu cytostatykami
Istotnym zagadnieniem jest wpływ chemioterapii na mutagenność i teratogenność u wyleczonych chorych z zachowaną płodnością. Wiele badań wskazuje, że po zakończonym leczeniu chemioterapia nie ma wpływu na występowanie wad wrodzonych u dzieci. W badanej populacji częstość występowania wad wrodzonych nie różniła się z populacją ogólną. Dotyczy to zarówno leczonych kobiet, jak i mężczyzn. Chemioterapia może jednak wpływać na masę urodzeniową i zwiększać ryzyko przedwczesnego porodu. Duże badanie ze Szwecji z 2005 roku wskazuje, że dzieci urodzone przez matki leczone cytostatykami miały mniejszą masę urodzeniową o średnio 130 g i urodziły się średnio 6 dni wcześniej w porównaniu do populacji ogólnej. Jednocześnie nie stwierdzono różnicy w masie i terminie porodu u dzieci leczonych ojców. Sugeruje to uszkadzający wpływ leczenia na samą macicę, a nie na działanie mutagenne. Nie zaobserwowano późniejszych zaburzeń wzrostu, rozwoju fizycznego i intelektualnego.
Zaburzenia poznawcze
Chemioterapia może powodować upośledzenie funkcji poznawczych. Najczęściej dolegliwości obejmują kłopoty z pamięcią, koncentracją, uwagą i szybkością przetwarzania informacji. Chorzy mogą mieć kłopoty z uczeniem się nowych informacji, gubieniem przedmiotów, trudnościami ze znalezieniem słów podczas rozmowy.
Jest bardzo niewiele badań porównujących stan funkcji poznawczych przed i po leczeniu cytostatykami. W małym prospektywnym badaniu stwierdzono obniżenie funkcji poznawczych po leczeniu chemioterapią u 60% leczonych, jednak te zaburzenia występowały jeszcze przed leczeniem u 33% chorych. U około połowy leczonych z obniżeniem funkcji poznawczych powróciły one do stanu sprzed leczenia w ciągu roku.
Skuteczność
Skuteczność chemioterapii zależy od typu histologicznego nowotworu, stopnia jego zaawansowania oraz innych czynników rokowniczych wpływających na skuteczność leczenia. Pewne nowotwory są potencjalnie uleczalne za pomocą samej chemioterapii, do tych nowotworów można zaliczyć raka kosmówki, ostrą białaczkę limfoblastyczną, ostrą białaczkę szpikową, niektóre typy chłoniaków nieziarniczych, chłoniak Hodgkina, rak jądra, rak jajnika oraz raka drobnokomórkowego płuca.
Narażenie zawodowe na leki przeciwnowotworowe
Leki przeciwnowotworowe stosunkowo często wykazują działania niekorzystne dla zdrowia. U chorych na chorobę nowotworową, która jest zagrożeniem ich życia, te niekorzystne działania są akceptowalne. Jednak w przypadku personelu medycznego narażenie zawodowe na cytostatyki należy redukować. Krótkoterminowe efekty ekspozycji na cytostatyki obejmują reakcje alergiczne, wysypki skórne, wypadanie włosów i bóle głowy. Odległymi efektami ekspozycji jest głównie niekorzystny wpływ na płodność. Metaanaliza 14 badań nie wykazała związku między ekspozycją a występowaniem wad wrodzonych, jednak stwierdzono związek między ekspozycją u kobiet a poronieniami. Istnieją pewne przesłanki, że istnieje związek między ekspozycją zawodową na cytostatyki a zwiększonym ryzykiem występowania nowotworów, głównie białaczki. W większości są to badania sprzed wprowadzenia wytycznych bezpiecznej pracy z tymi lekami.
Uwagi
Bibliografia
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Michael J. Perry: The Chemotherapy source book. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2008. ISBN 978-1451101454.
- Radzisław Kordek: Onkologia. Podręcznik dla studentów i lekarzy. Gdańsk: VIA MEDICA, 2007. ISBN 978-83-7555-016-0.
- Rachel Airley: Cancer chemotherapy. Wiley-Blackwell, 2009. ISBN 978-0-470-09254-5.
- LouiseL. Hanna LouiseL., TomT. Crosby TomT., FergusF. Macbeth FergusF. (red.), Practical Clinical Oncology, wyd. 1, Cambridge University Press, 2008, ISBN 978-0-521-61816-8 .
- Roland T. Skeel, Samir N. Khleif: Handbook of Cancer Chemotherapy. Lippincott Williams & Wilkins, 2011. ISBN 978-1-60831-782-0.
- B. Chabner, D.L. Longo: Cancer Chemotherapy and Biotherapy: Principles and Practice. Wyd. 4. Philadelphia: Lippincott Willians & Wilkins, 2011. ISBN 978-1-60547-431-1.
- Alfred E. Chang, Patricia A. Ganz, F. Hayes Daniel, Timothy Kinsella, Harvey I. Pass, Joan H. Schiller, Richard M. Stone, Victor Strecher: Oncology: An Evidence-Based Approach (Chang, Oncology). Springer, 2006. ISBN 978-0387242910.
- Franco Cavalli, Stan B. Kaye, Heine H. Hansen, James O. Armitage, Martine J. Piccart-Gebhart: Textbook of Medical Oncology. 2009. ISBN 978-0-415-47748-2.
- Edward Chu, Vincent T. DeVita Jr: Physicians’ Cancer Chemotherapy Drug Manual 2014. Jones & Bartlett Learning; 14 edition, 2014. ISBN 978-1284026856.
- Ernst Mutschler, Gerd Geisslinger, Heyo K. Kroemer, Peter Ruth, Monika Schäfer-Korting: Farmakologia i toksykologia. Wrocław: MedPharm Polska, 2010. ISBN 978-83-60466-81-0.
- Miriam Wood, David Brighton: The Royal Marsden Hospital handbook of cancer chemotherapy: a guide for the multidisciplinary team. St. Louis, Mo: Elsevier Churchill Livingstone, 2005. ISBN 978-0443071010.