Glukoza
| |||||||||||||||||||||||
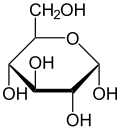
 α-D-glukopiranoza (projekcja stereochemiczna) | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
C6H12O6 |
||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
180,16 g/mol |
||||||||||||||||||||||
| Wygląd |
bezwonne, bezbarwne, drobne kryształki o słodkim smaku |
||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS |
50-99-7 |
||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||
| ATC | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
Glukoza, D-glukoza – organiczny związek chemiczny, monosacharyd (cukier prosty) z grupy aldoheksoz. Jest białym, drobnokrystalicznym ciałem stałym, z roztworów wodnych łatwo krystalizuje jako monohydrat. Jest bardzo dobrze rozpuszczalna w wodzie (nie zmienia pH roztworu). Ma słodki smak, nieco mniej intensywny od sacharozy.
Enancjomerem D-glukozy jest L-glukoza, niewystępująca w organizmach wyższych.
Występowanie
Glukoza powstaje w organizmach roślinnych podczas fotosyntezy:
Występuje w znacznych ilościach w owocach (szczególnie w winogronach, stąd nazywana jest czasem cukrem gronowym) i miodzie. W organizmach jest składowana w postaci dwóch polimerów: skrobi u roślin i glikogenu u zwierząt.
Budowa cząsteczki
Krystaliczna glukoza ma budowę cykliczną. Sześcioczłonowy pierścień hemiacetalu powstaje w wyniku reakcji grupy aldehydowej przy atomie węgla C1 z grupą hydroksylową przy atomie węgla C5 w łańcuchu. Możliwe są zatem dwa anomery – α oraz β w zależności od położenia grupy OH przy pierwszym atomie węgla formy cyklicznej.
W roztworze wodnym oba anomery mogą ulegać reakcji otwarcia pierścienia i ponownego zamknięcia z utworzeniem ponownie takiego samego lub przeciwnego anomeru. Proces taki nazywa się mutarotacją. Forma otwartołańcuchowa występuje wyłącznie w roztworze wodnym, a jej termodynamiczna stabilność jest znacznie mniejsza od formy cyklicznej, dlatego równowaga procesu mutarotacji przesunięta jest silnie w kierunku formy cyklicznej, która występuje w przewadze.
W łańcuchowej formie glukozy znajdują się cztery asymetryczne atomy węgla (tj. C2, C3, C4 i C5), podczas gdy w formie cyklicznej występuje pięć takich atomów (dodatkowo asymetryczny jest węgiel anomeryczny, C1). W zależności od położenia grupy karbonylowej w łańcuchu i konfiguracji asymetrycznych atomów węgla, możliwych jest kilkadziesiąt izomerów glukozy (zob. heksozy). Jednym z często występujących naturalnie izomerów glukozy jest fruktoza, różniąca się położeniem grupy karbonylowej.
Właściwości
Właściwości chemiczne
Naturalna glukoza jest jednym z wielu izomerów optycznych tego związku – α-D-glukopiranozą (dekstrozą). Jest ona czynna optycznie – w temperaturze pokojowej skręca płaszczyznę spolaryzowanego światła białego w prawo. Skręcalność właściwa anomeru α wynosi +112°, natomiast anomeru β +19°. W roztworze wodnym w wyniku mutarotacji ustala się stan równowagi obu anomerów w stosunku 36:64, o skręcalności właściwej +52,6°.
Glukoza w przeciwieństwie do fruktozy odbarwia wodę bromową w obecności kwaśnego węglanu sodu (następuje utlenienie grupy aldehydowej do grupy karboksylowej, w wyniku czego powstaje kwas glukonowy):
- CH
2OH−(CHOH)
4−CHO + Br
2 + 2NaHCO
3 → CH
2OH−(CHOH)
4−COOH + 2NaBr + H
2O + 2CO
2↑
Pod wpływem kwasu azotowego grupa aldehydowa oraz atom węgla C6 są utleniane do grup karboksylowych, w wyniku czego powstaje kwas glukarowy (który w gorącej wodzie przechodzi w lakton).
W temperaturze powyżej 150 °C topi się i brunatnieje, tworząc (podobnie jak sacharoza) karmel.
Właściwości biologiczne
D-Glukoza jest podstawowym związkiem energetycznym dla większości organizmów, przechowywanym pod postacią polimerów – skrobi i glikogenu. Stanowi cukier najłatwiej przyswajalny przez człowieka. W procesie glikolizy jest rozkładana na kwas pirogronowy. Jest także substratem wielu procesów zachodzących w komórce, a u roślin, jako celuloza, podstawowym budulcem ściany komórkowej.
Wykrywanie glukozy w roztworach
Glukozę, podobnie jak inne cukry redukujące, można wykryć m.in. za pomocą prób Trommera i Tollensa. W obydwu próbach glukoza jest przeprowadzana w kwas glukonowy.
Próba Trommera
Do świeżo strąconego osadu wodorotlenku miedzi(II) dodaje się badany roztwór i ogrzewa. W obecności glukozy niebieski osad Cu(OH)2 zmienia barwę na ceglastoczerwoną, wskutek redukcji do Cu
2O:
- 2Cu(OH)
2 + C
6H
12O
6 → Cu
2O + C
6H
12O
7 + 2H
2O
Próba Tollensa
Do probówki napełnionej niewielką ilością roztworu azotanu srebra należy dodać kilka kropli stężonego roztworu wodorotlenku sodu (NaOH), a następnie dolewać kroplami roztworu amoniaku (NH
3), aż do rozpuszczenia się powstałego wcześniej osadu.
- 1. AgNO
3 + NaOH → AgOH + NaNO
3 - 2a. 2AgOH → Ag
2O + H
2O - 2b. Ag
2O + CH
2(OH)(CHOH)
4CHO → 2 Ag + CH
2(OH)(CHOH)
4COOH
Tak przygotowaną probówkę należy umieścić w zlewce z gorącą wodą (na łaźni wodnej). Na koniec do probówki dodaje się badany roztwór. Podczas ogrzewania substancji o barwie brunatnej – Ag
2O (powstałej z reakcji AgNO
3 z NaOH) – na ściankach probówki osadza się warstewka metalicznego srebra – lustro srebrowe (z tej przyczyny próba Tollensa zwana jest także próbą lustra srebrnego).
- 3. Ag
2O + glukoza → 2 Ag + kwas organiczny (kwas glukonowy) - Ag
2O + C
6H
12O
6 → 2 Ag + C
6H
12O
7
Zastosowanie
W medycynie (np. kroplówki), a także w przemyśle spożywczym (np. syrop glukozowy, syrop glukozowo-fruktozowy) oraz farmaceutycznym. Stosowana jest również jako dodatek o właściwościach nawilżających do kosmetyków, np. przeznaczonych do makijażu, pielęgnacji skóry i włosów.
Uwagi
Bibliografia
CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
| B05A – Krew i preparaty krwiopochodne |
|
||||||
|---|---|---|---|---|---|---|---|
| B05B – Roztwory do wlewów dożylnych |
|
||||||
| B05C – Roztwory do płukania |
|
||||||
| B05X – Dożylne roztwory uzupełniające |
|
| C05A – Leki stosowane zewnętrznie w leczeniu hemoroidów |
|
||||||||
|---|---|---|---|---|---|---|---|---|---|
| C05B – Leki stosowane w leczeniu żylaków |
|
||||||||
| C05C – Leki wpływające na elastyczność naczyń |
|
| V04C – Inne preparaty diagnostyczne |
|
|---|