Tritlenek siarki
| |||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
SO3 |
||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
80,06 g/mol |
||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna, lotna ciecz |
||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
Tritlenek siarki (nazwa Stocka: tlenek siarki(VI)), SO
3 – nieorganiczny związek chemiczny z grupy tlenków kwasowych, w którym siarka występuje na VI stopniu utlenienia.
Budowa cząsteczki
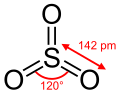
Monomeryczna cząsteczka tritlenku siarki w stanie gazowym ma płaską budowę trójkąta równobocznego. Długość wiązań S−O wynosi 142 pm, a kąty pomiędzy wiązaniami O−S−O wynoszą po 120°.
Otrzymywanie
Tritlenek siarki powstaje jako produkt pośredni w procesie otrzymywania kwasu siarkowego metodą kontaktową poprzez katalityczne utlenianie SO
2 (z uwagi na małą szybkość reakcji pomiędzy SO
2 i tlenem stosuje się katalizator w postaci V
2O
5, który zastąpił używaną wcześniej platynę). SO
3 nie jest jednak zazwyczaj izolowany, a dalej wykorzystywany do otrzymania pożądanego kwasu.
Laboratoryjne metody otrzymywania tego tlenku obejmują odwadnianie kwasu siarkowego przy użyciu P
4O
10:
- 2H
2SO
4 + P
4O
10 → 4HPO
3 + 2SO
3
oraz ogrzewanie disiarczanu potasu:
- K
2S
2O
7 → K
2SO
4 + SO
3
a także utlenianie SO
2 przy użyciu SeO
2:
- 2SO
2 + SeO
2 → 2SO
3 + Se
Właściwości
Tritlenek siarki jest w warunkach pokojowych bezbarwną cieczą. Może występować w trzech formach: α-SO
3, β-SO
3, γ-SO
3. Poniżej temperatury 16,86 °C tworzy się forma γ jako rombowe kryształy przypominające lód, w których cząsteczki tritlenku siarki występują jedynie w postaci cyklicznych trimerów (SO
3)
3. Pod wpływem niewielkich ilości wilgoci forma γ przekształca się do formy β będąca w rzeczywistości mieszaniną kwasów polisiarkowych HO(SO
2O)
xH (gdzie x jest bardzo duże, około 105). Do wytworzenia się formy α (bardziej usieciowanej i przypominającej azbest) także potrzebna jest obecność wilgoci. W stanie gazowym monomeryczne cząsteczki SO
3 występują w równowadze z trimerami.
Skłonność do polimeryzacji powoduje, że sprzedawany tritlenek siarki wzbogacany jest o dodatki hamujące tę reakcję. Są to zazwyczaj m.in. związki boru lub krzemu (w ilościach ok. 0,03–1,5%).
Tritlenek siarki jest bardzo reaktywny. Reaguje gwałtownie i egzotermicznie z wodą tworząc kwas siarkowy. Ma właściwości utleniające (utlenia m.in. fosfor do P
4O
10) i jest silnym kwasem Lewisa. Z halogenowodorami daje odpowiednie kwasy halogenosiarkowe (HSO
3X).
Stały SO
3 ma dość dużą lotność, przez co jego pary mogą tworzyć z wilgocią H
2SO
4.
Zastosowanie
Tritlenek siarki stosuje się do otrzymywania kwasu siarkowego oraz innych związków (m.in. poprzez sulfonowanie związków organicznych, np. alkilobenzenów do kwasów alkilobenzenosulfonowych). Znajduje zastosowanie także przy produkcji materiałów wybuchowych.
Linki zewnętrzne
- Tritlenek siarki, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy (pol. • ang.).
|