Randomizowane kontrolowane badania kliniczne

Faza 1: Rejestracja do badań (Enrollment), połączona z oceną kwalifikowalności i randomizacją
Faza 2: Przydział do grup uczestników RCT (Allocation)
Faza 3: Interwencja medyczna (Intervention)
Faza 4: Obserwacja i analiza danych (Follows-Up)
Szczegółowe raporty z badań są opracowywane zgodnie z instrukcją CONSORT 2010. Obejmują m.in. informacje o przyczynach każdego z wyłączeń z badań (excluded).
Randomizowane kontrolowane badania kliniczne (ang. Randomized controlled trial, RCT) – „złoty standard” eksperymentów klinicznych, rodzaj badań eksperymentalnych z udziałem ludzi, wykonywanych zgodnie z zasadami dobrej praktyki klinicznej, których celem jest np. porównanie bezpieczeństwa i skuteczności leków, wyrobów i technik medycznych lub innych rodzajów terapeutycznej lub zapobiegawczej interwencji medycznej.
W czasie badań duża grupa ich uczestników jest losowo (randomizacja) przydzielana do dwóch lub więcej podgrup, np. do podgrupy poddawanej ocenianej nowej procedurze (grupa eksperymentalna) i podgrupy porównawczej (grupa kontrolna), poddawanej interwencji alternatywnej (np. standardowej) lub pozorowanej (np. podawanie placebo lub brak działania). Różnice między wynikami uzyskiwanymi w podgrupach są oceniane metodami statystycznymi.
Randomizowane kontrolowane badania kliniczne są jedną z podstaw medycyny opartej na faktach (EBM), obok badań obserwacyjnych. Analogiczne metody są również stosowane poza medycyną, w różnych obszarach badań naukowych, w psychologii, pedagogice i innych naukach społecznych.
Historia

Do narodzin medycyny doszło prawdopodobnie kilka tysięcy lat temu w starożytnym Egipcie (papirus Edwina Smitha pochodzi z ok. 1550 roku p.n.e.) i niewiele później w Mezopotamii, Grecji i w Rzymie. Ówczesna medycyna miała częściowo charakter magiczno-religijny, a częściowo empiryczno-racjonalny. Pierwsze procedury medyczne i leki opracowano na podstawie wyników obserwacji i eksperymentów, przypominających późniejsze badania obserwacyjne i eksperymentalne badania naukowe.
Za pioniera eksperymentów klinicznych naszej ery jest uważany James Lind (1716–1794), szkocki lekarz, służący m.in. na okręcie Royal Navy HMS „Salisbury”. W 1747 roku, poszukując sposobu przeciwdziałania powszechnemu wśród marynarzy szkorbutowi, Lind podzielił dwunastu chorych członków załogi na sześć par i każdej z nich dodawał inne składniki do podstawowej diety. Dwie z tych par, które otrzymywały pomarańcze i cytryny, odzyskały zdrowie, co było bezpośrednim i jednoznacznym potwierdzeniem opinii o skuteczności owoców cytrusowych (cytrusy bywały stosowane już na statkach da Gamy w XV wieku i Cabrala na początku XVI wieku). Dalszy rozwój medycyny był związany z kolejnymi „rewolucjami przemysłowymi” (pierwszą, drugą i trzecią). Wzrosły możliwości identyfikacji chorób lub zespołów chorobowych na podstawie oceny objawów subiektywnych (stwierdzonych w badaniu podmiotowym i przedmiotowym) oraz wyników diagnostycznych badań laboratoryjnych i obrazowych (zob. historia i kliniczne znaczenie obrazowania medycznego). Towarzyszył temu postęp farmacji i dyscyplin z nią związanych, a równocześnie wzrost świadomości błędów pomiarów, np. wykonywanych w czasie ocen skuteczności licznych nowych leków. Za przełomowe bywają uznawane badania Selmana Waksmana, laureata Nagrody Nobla (1952) za izolację streptomycyny, pierwszego antybiotyku skutecznego w leczeniu gruźlicy płuc. Statystyczną analizę skuteczności terapii prowadzili zasłużeni dla tej dyscypliny:
- Ronald Fisher (1890–1962), autor m.in. Statistical Methods for Research Workers (w tym History of Statistics)
- Austin Bradford Hill (1897–1991), epidemiolog i statystyk, najlepiej znany jako autor zestawu 9 kryteriów, wskazujących na występowanie zależności przyczynowej pomiędzy zjawiskami medycznymi (The Environment and Disease: Association or Causation? 1965); „kryteria Hilla” są wciąż przedmiotem dyskusji naukowych.
Statystyczne podstawy RCT budowali również Charles Sanders Peirce, Joseph Jastrow, Jerzy Spława-Neyman i in. (wprowadzenie pojęć przedział ufności, odchylenie standardowe i in.; zob. przegląd zagadnień z zakresu statystycznej analizy wyników pomiarów).
Liderami międzynarodowych starań o zwiększenie wiarygodności wyników eksperymentów klinicznych byli:
- Archibald Cochrane, student Austina Bradforda Hilla, autor książki pt. Effectiveness and Efficiency: Random Reflections on Health Services nazywany „ojcem medycyny opartej na dowodach (EBM)”
- Douglas Altman, autor opublikowanego w 1994 roku alarmującego artykułu pt. The scandal of poor medical research, współtwórca Cochrane Collaboration
W końcu XX wieku i w pierwszych dziesięcioleciach kolejnego tysiąclecia metodyka RCT była intensywnie rozwijana jako „złoty standard” eksperymentów klinicznych, stosowany powszechnie, lecz nie bez ograniczeń.
Etyczne i prawne aspekty współczesnych eksperymentów klinicznych
Doświadczenia XX wieku
Na kierunki rozwoju współczesnej medycyny znacząco wpłynęły wydarzenia historyczne XX wieku, takie jak wojny światowe (w czasie pierwszej poległo 8,5 mln żołnierzy, w czasie drugiej 60 mln ludzi) oraz groźne dla ludzkości epidemie i pandemie (dżuma, gruźlica, grypa, choroba Heinego-Medina, ospa, odra i inne). Do historii medycyny weszły nie tylko działania oddziałów wojskowej służby zdrowia na polach bitew (np. pod Monte Cassino) lub jednostek Czerwonego Krzyża walczących z epidemiami. Ciemna część historii medycyny zawiera wiedzę o zbrodniczych eksperymentach na ludziach w Auschwitz, w japońskiej Jednostce 731 i innych. Rodzajem badań na ludziach jest określanie wartości dopuszczalnej dawki promieniowania (jej przekroczenie było np. przyczyną śmierci Luisa Slotina w czasie realizacji Projektu Manhattan), wartości najwyższych dopuszczalnych stężeń i natężeń w warunkach pracy, wielkości dawek leczniczych itp.
Rezolucje międzynarodowe 1945–1964
Wkrótce po kapitulacji III Rzeszy utworzono Organizację Narodów Zjednoczonych (Nowy Jork 1945), za której cele uznano zapewnienie pokoju i bezpieczeństwa międzynarodowego, rozwój współpracy między narodami oraz popieranie przestrzegania praw człowieka, w tym prawa do opieki zdrowotnej. Już w 1946 roku na zwołanej przez ONZ Międzynarodowej Konferencji Zdrowia ratyfikowano konstytucję Światowej Organizacji Zdrowia (ang. World Health Organization, WHO, Genewa), a w 1947 roku utworzono współpracujące z WHO Światowe Towarzystwo Medyczne (ang. World Medical Association, WMA).
Działania WHO i WMA zmierzają konsekwentnie do jednoznacznego sprecyzowania warunków prowadzenia badań klinicznych. W 1964 roku przyjęto dotyczącą tych zagadnień deklarację helsińską. W następnych latach wchodziły w życie jej kolejne wersje.
Jawność badań klinicznych jako powinność naukowa i etyczna
Na ministerialnym spotkaniu, zorganizowanym w Meksyku w 2004 roku przedstawiciele 58 krajów przyjęli rezolucję określającą obowiązki państw w zakresie organizacji badań medycznych o wysokiej jakości. Stwierdzono, że naukową, etyczną i moralną powinnością prowadzących testy kliniczne jest jawność planów badań i osiągniętych wyników.
Opracowano zasady dokumentowania projektów w powszechnie dostępnych na poziomie międzynarodowym rejestrach i archiwach czasopism, co miało na celu nie tylko usprawnienie wymiany wiedzy między naukowcami, ale również zwiększenie zaufania opinii publicznej do nauki (np. chorych do lekarzy) oraz ułatwienie podejmowania decyzji administracyjnych w sprawach dotyczących finansowania nowych badań itp. Międzynarodowy Komitet Redaktorów Czasopism Medycznych (ang. International Committee of Medical Journal Editors) wydał oświadczenie, że warunkiem publikacji prac dot. zakresu i wyników badań klinicznych w rekomendowanych czasopismach medycznych będzie wcześniejsza, zgodna z wytycznymi rejestracja ich zgłoszenia w jednym z ogólnodostępnych rejestrów, zarządzanych przez organizację non-profit (zob. prerejestracja badania). WHO stworzyła platformę internetową, umożliwiającą przeglądy różnych rejestrów.
W 2015 roku uzgodniono, że rejestry badań klinicznych będą obejmowały również opisy wcześniejszych, dotychczas nieopublikowanych wyników badań na ludziach (w tym pozytywnych, negatywnych i niejednoznacznych). W tymże roku ponowiono stwierdzenie, że rejestracja wszystkich badań, dotyczących interwencji medycznych jest naukowym, etycznym i moralnym obowiązkiem
The registration of all interventional trials is a scientific, ethical and moral responsibility.
Raporty z badań powinny być opracowywane zgodnie ze stale aktualizowanymi wytycznymi CONSORT.
Statystyczny charakter badań medycznych
James Lind opierał wnioski dotyczące możliwości przeciwdziałania szkorbutowi na obserwacji 12 chorych członków załogi HMS „Salisbury”, podzielonych na 6 par, które korzystały z różnej diety. Od czasu tego eksperymentu (1747 rok) liczba ludności Ziemi wzrosła ok. dziesięciokrotnie. W przybliżeniu wykładniczy, terytorialnie zróżnicowany dalszy wzrost tej liczby (zob. przeludnienie) oraz rozwój gospodarczy i demograficzny zmieniły charakter wyzwań, które stoją przed medycyną.
Za współczesną analogię badań Linda uważa się eksperymentalne badania kliniczne. W czasie eksperymentów jest wykorzystywana gromadzona przez tysiąclecia doświadczeń medyczna wiedza o zdrowiu i chorobach człowieka i zdrowiu populacji, sposobach diagnostyki, profilaktyki i leczenia. Stan zdrowia pacjentów i skuteczność terapii ocenia się stosując liczne metody diagnostyki laboratoryjnej i obrazowej, analizy czasu przeżycia np. do nawrotu choroby lub do śmierci, wywiady dot. odczuwania bólu, wyniki ankiet dot. subiektywnie odczuwanej jakości życiai wiele innych technik.
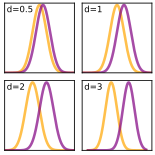
Postęp wiedzy umożliwił wykazanie wielkiego zróżnicowania ludzkich reakcji na patogeny, będącego skutkiem wpływu czynników genetycznych, immunologicznych (np. przebyte infekcje i szczepienia) lub ekonomicznych i organizacyjnych (np. zróżnicowanie sprawności systemów opieki zdrowotnej i innych wskaźników jakości życia). Podejmowane są próby określenia rozmiarów utraty zdrowia z różnych powodów według wieku, płci, rozmieszczenia w przestrzeni i w czasie (zob. np. globalne obciążenie chorobami). Istotnym czynnikiem zróżnicowania reakcji ludzi na oddziaływania chorobotwórcze lub na stosowane terapie jest częste występowanie w populacji chorób przewlekłych i wielochorobowości. W warunkach bardzo wysokiego zróżnicowania indywidualnych reakcji na interwencje medyczne uzyskanie wiarygodnych wyników porównań skuteczności dotychczasowych i nowych terapii wymaga zaangażowania licznych uczestników – próby reprezentatywnej dla populacji – i stosowania technik wnioskowania statystycznego (np. wnioskowanie częstościowe lub bayesowskie). W czasie obliczeń efektu często stosuje się wartości d Cohena (różnica między średnimi podzielona przez odchylenie standardowe w próbie). Im mniejsza jest wielkość efektu, tym liczniejsza próba jest potrzebna do osiągnięcia oczekiwanej mocy testu statystycznego. W czasie standardowej procedury weryfikacji hipotez statystycznych porównuje się statystyki testowe w hipotezie zerowej i alternatywnej, określając prawdopodobieństwo popełnienia błędu I rodzaju (zob. próba statystyczna, poziom istotności α, wartość p).
A. Wykresy Gaussa ilustrujące różne wartości d Cohena
B. Statystyki testowe w hipotezie zerowej i alternatywnej w teście t dla dwóch grup niezależnych (N=100, d=0,5, moc testu ok. 70%)
Eksperymenty kliniczne
Fazy eksperymentów (0, 1, 2, 3, 4)
Fazy 0, 1 i 2
W początkowym okresie eksperymentów klinicznych badania zmierzają do wstępnego potwierdzenie celowości ich rozpoczęcia oraz opracowania racjonalnego, bezpiecznego dla pacjentów programu badań fazy trzeciej, początkowo przewidywanej głównie na podstawie przeglądów pierwotnych i wtórnych źródeł wiedzy – publikacji (zob. PRISMA) zgromadzonych w bogatych medycznych bibliotekach, takich jak baza NLM (zob. też PubMed) lub biblioteki Cochrane Collaboration. Publikacje dotyczą często prac wykonywanych bez udziału ludzi, np. mikrobiologicznych badań posiewów lub testowania leków na zwierzętach. Eksperymenty wykonywane z udziałem ludzi nie wymagają rekrutacji licznych grup uczestników (populacja statystyczna). W fazach 1 i 2 w skład tych grup wchodzi zwykle od kilkunastu do trzystu osób.
Faza 3 i kontynuacja badań (faza 4)
W wyniku fazy 3 spodziewane jest ostateczne potwierdzenie skuteczności i bezpieczeństwa nowej terapii, które jest uznawane za podstawę urzędowych decyzji (np. rejestracja leku).
Po wprowadzeniu nowych leków lub technik do praktyki badania bywają kontynuowane (faza 4), m.in. w celu sprawdzenia ewentualnych interakcji z innymi lekami, skutków terapii długotrwałych itp. W fazie 4 są też prowadzone obserwacje dotyczące zdrowia publicznego, np. porównania okresów przed i po wprowadzeniu szczepień lub badania możliwości zapobiegania chorobom zakaźnym i niepożądanym odczynom poszczepiennym.
Otrzymanie wiarygodnych wyników trzeciej fazy eksperymentu wymaga rekrutacji licznych grup uczestników (często wielu setek lub tysięcy) oraz przestrzegania procedur badawczych i jawności raportów, publikowanych w dostępnych czasopismach naukowych o potwierdzonej wiarygodności (zob. NLM, PubMed, WHO ICTRP).
Stosowane są m.in. eksperymentalne badania porównawcze (zob. rodzaje badań epidemiologicznych):
- – równoległe
- – podział uczestników badania na grupy podobne w chwili rozpoczęcia eksperymentu; w grupach są równolegle stosowane porównywane interwencje medyczne (np. badany produkt leczniczy w grupie badanej i lek standardowy w grupie kontrolnej lub badana interwencja w grupie badanej, chemioterapia w grupie badanej i radioterapia w grupie kontrolnej)
- – naprzemienne (krzyżowe)
- – stosowanie w obu grupach obu porównywanych terapii, wymienianych zgodnie z harmonogramem opisanym w protokole eksperymentu; procedura umożliwiająca skontrolowanie skuteczności obu metod w indywidualnych przypadkach, nie stosowana, gdy mierzalne parametry skuteczności są zmienne oraz gdy pojawiają się i zanikają ze znacznym opóźnieniem, a preparaty mają długi czas półtrwania (pomiędzy oboma seriami stosuje się „fazę wypłukania”),
- – z zastosowaniem klasteryzacji (ang. data clustering, cluster randomised controlled trial)
- – losowe przydzielanie różnych interwencji nie poszczególnym osobom, lecz niezależnie utworzonym grupom ludzi, np. mieszkańcy wsi lub lokatorzy budynku, uczniowie szkoły, pacjenci kliniki (zob. też analiza skupień z użyciem centroidów i metody k-średnich, Stepped wedge cluster randomized controlled trial designs); zmienność wielkości klastrów wymaga stosowania specjalnych metod obliczeń wyników
- – z zastosowaniem analizy czynnikowej (ang. factorial experiment)
- – korzystanie ze schematów eksperymentalnych nazywanych ang. factorial design, tworzonych w celu jednoczesnego badania wpływu więcej niż jednej interwencji. W najprostszym przypadku 2×2 uczestnicy, tworzący cztery grupy, mogą otrzymywać np. :
- – aktywny lek A + aktywny lek B
- – aktywny lek A + placebo B
- – placebo A + aktywny lek B
- – placebo A + placebo B
- Złożone metody analizy wieloczynnikowej pozwalają porównać skuteczności stosowania różnych sposobów terapii, charakterystyczne dla grupy uczestników, a dodatkowo wykryć interakcje między równocześnie stosowanymi interwencjami, problemy wynikające z występowania w grupie przypadków wielochorobowości itp.
Spośród stosowanych metod wyróżniane są procedury RCT (ang. Randomized controlled trial, „złoty standard”badań klinicznych), najczęściej realizowane metodą dwóch grup równoległych. Stwierdzono, że w 2000 roku (przed aktualizacją wytycznych CONSORT) w ten sposób wykonywano badania w 383-ciu na 519 publikacji indeksowanych w PubMed (74%), a w 2006 roku (po aktualizacji) w 477-miu na 616 publikacji (78%).
W czasie badań dotyczących zwalczania ostrych chorób epidemicznych są stosowane adaptacyjne badania kliniczne (ang. outcome-adaptive trials), charakteryzujące się częstymi analizami okresowymi i dostosowywaniem przebiegu badania do ich wyników (przyspieszenie badań leku). Były stosowane m.in. w czasie realizacji projektu An Adaptive Randomized Trial Comparing Multiple Treatments for Ebola Virus (EBOV) Infected Children and Adults (wirus Ebola). W styczniu 2020 rozpoczęto badania dotyczące leczenia COVID-19: A Multicenter, Adaptive, Randomized Blinded Controlled Trial of the Safety and Efficacy of Investigational Therapeutics for the Treatment of COVID-19 in Hospitalized Adults.
Badania wykonywane w fazie 3 eksperymentu są rozpoczynane po jednoznacznym sformułowaniu hipotezy badawczej, opracowaniu programu badań, określeniu niezbędnej liczebności właściwej grupy badawczej oraz obowiązkowej rejestracji przedsięwzięcia. Jednym z kluczowych wstępnych zadań wykonawców jest ustalenie zależności między danymi, określanymi jako wynik ocenianej terapii, a wybranymi kryteriami oceny zmian stanu zdrowia pod wpływem tej terapii.
Poprawność RCT jest oceniana na podstawie opisu celu i metodyki, przedstawianego w czasie rejestracji wstępnej, oraz tekstu raportu z wykonania badań. Opisy powinny być przygotowane zgodnie z wytycznymi CONSORT i zawierać szczegółowe informacje o zastosowanych procedurach randomizacji, „zaślepiania” i in., umożliwiające zastosowanie skali Jadada („oksfordzkiego systemu oceny jakości” klinicznych badań eksperymentalnych).
Rekrutacja uczestników badań i zmiany w grupach
Istotnym warunkiem poprawności wyników badania efektów zmiany sposobu terapii jest prawidłowy dobór próby statystycznej – grupy ludzi nazywanej uczestnikami. Osiągnięcie celu wymaga:
- zapewnienia udziału odpowiednio licznej grupy osób, tym liczniejszej im mniejsza jest wielkość spodziewanego efektu
- spełnienia kryteriów włączenia/wyłączenia – zmian składu grup uczestników, zachodzących często (z różnych powodów) przed, w czasie i po zakończeniu badań.
Zgodnie z zasadami lekarskiej etyki zawodowej (Kodeks Etyki Lekarskiej) każdy kandydat do grupy musi wyrażać świadomą zgodę na udział w realizacji programu. Zgłoszenia bywają odrzucane, co sprawia, że cechy grupy często nie odpowiadają populacji generalnej.
Kryteria włączania/wyłączania są zależne od bardzo zróżnicowanych celów i technik badań. W licznych rodzajach badań ze względów etycznych nie jest akceptowany udział dzieci, seniorów, kobiet w okresie ciąży lub laktacji, osób z niepełnosprawnościami i innych, które mogą nie być w pełni zdolne do wyrażenia świadomej zgody. Kryteria wykluczeń chronią też uczestników, którzy mogliby być szczególnie podatni na ewentualne zagrożenia, związane z udziałem w eksperymencie (wszystkie uzasadnienia powinny być opisane w raporcie; zob. schemat blokowy RCT według CONSORT 2010).
Randomizacja
Randomizacja jest metodą losowego przydzielania uczestników badania (pacjentów) do grupy eksperymentalnej i grupy kontrolnej lub większej liczby podgrup. Idealna metoda powinna gwarantować, że losowy charakter doboru nie będzie źródłem wstępnego zróżnicowania podgrup w zakresie wszystkich (znanych i nieznanych) cech uczestników, które mogą wpływać na wynik badania.
Wśród metod losowych wyróżnia się m.in.:
- randomizację prostą („czystą”) – metody w pełni losowe, w których każde włączenie chorego jest dziełem przypadku, jest niezależne od cech klinicznych, demograficznych itd. Przykładem takich metod jest rzut monetą (np. awers – grupa A, rewers – grupa B) lub stosowanie list, uszeregowanych według liczb losowych (zob. generator liczb losowych)
- randomizację blokową (ang. random permuted blocks) – przydzielanie do grup nie jako wynik losowania osób, lecz losowania bloków, czyli równolicznych grup (bloków) o określonej sekwencji przydziału kolejnych chorych do każdej z badanych grup (np. bloki czterocyfrowe: AABB, ABBA, BBAA, ABAB, BAAB, BABA, w których A – grupa eksperymentalna, B – grupa kontrolna)
- randomizację parami – po podziale kandydatów na pary, na podstawie podobieństwa określonych cech, jedna z osób każdej z par jest czysto losowo przydzielana do grupy A lub B, a druga – bez losowania – do grupy drugiej
- randomizację typu biased-coin (B. Efron)
Dążenie do przyspieszenia weryfikacji skuteczności nowych terapii prowadzi do wzrostu popularności badań wieloośrodkowych z udziałem tysięcy uczestników. W tych przypadkach niezbędna jest dobra koordynacja wszystkich działań, w tym bieżące monitorowania przebiegu naboru pacjentów i randomizacji. Stosowane są centralne systemy rejestracji, randomizacji i zarządzania danymi, które sprzyjają wiarygodności wyników badań – korzystają z zaawansowanych metod regresji, umożliwiających m.in. porównanie i minimalizację początkowych różnic między podgrupami i korektę wyników końcowych o wpływ tych różnic. Systemy ułatwiają też pracę naukowców pracujących w poszczególnych ośrodkach (np. w klinikach), nie opracowujących końcowych raportów, przekazujących do systemu wypełnione formularze kart obserwacji klinicznej. Zapobiegają występowaniu pomyłek lub celowych zafałszowań.
Zaślepianie (utajnianie)
Uczestniczący w badaniach pacjenci nie są informowani, do której z wymienionych grup zostali zakwalifikowani (utajnienie alokacji, ang. allocation concealment), co zapobiega błędom wynikającym z subiektywizmu. Na istnienie takich błędów może np. wskazywać obserwacja, że korzystniejsze subiektywne miary skuteczności terapii są zamieszczane w tych publikowanych raportach, które nie zawierają opisów sposobu utajniania przydziałów do grup lub nie są one poprawne.
Bywa też stosowane:
- – „zaślepienie podwójne” – nie mają dostępu do informacji o alokacji również lekarze uczestniczący w badaniach, co gwarantuje ich obiektywizm, lecz w niektórych przypadkach utrudnia podejmowanie decyzji zgodnych z zasadami etyki lekarskiej (np. wykluczenie z grupy eksperymentalnej pacjenta, u którego wystąpiły niepokojące objawy); niekiedy dokonywane są etapowe oceny postępów leczenia w obu odkodowanych grupach po ich odkodowaniu przez grono niezależnych ekspertów, którzy mogą rekomendować przerwania realizacji programu, jeżeli w jednej z grup uzyskano zdecydowanie lepsze wyniki (za nieetyczne uważa się narażanie drugiej grupy na niepotrzebne ryzyko)
- – „zaślepienie potrójne” – utajnienie informacji przed ośrodkiem kierującym badaniem.
Całkowite utajnienie umożliwiają systemy centralnej randomizacji, niezależne od ośrodków wykonujących badania, wykorzystujące np. numery opakowań leków, na których nie znajdują się żadne informacje o zawartości.
Efektywne utajnienie wylosowanej terapii bywa niemożliwe, np. z powodu występowania zauważalnych i rozpoznawalnych przez pacjenta oddziaływań specyficznych dla leku.
Ostatnio zwiększa się popularność badań typu PROBE (ang. Prospective Randomized Open Blinded End-point), w których zaślepieniu poddaje się wyłącznie specjalistów, uczestniczących w badaniu tylko w ramach ocen punktów końcowych (oceniają wyniki bez wiedzy o alokacji).
Raporty z badań
| Stopień skali | A (N) | A % | B (N) | B (%) |
| 1 | 21 | 7,6 | 44 | 26,7 |
| 2 | 32 | 26,9 | 63 | 38,2 |
| 3 | 40 | 33,6 | 37 | 2,4 |
| 4 | 15 | 12,6 | 16 | 9,7 |
| 5 | 11 | 9,2 | 5 | 3,0 |
Programy badań są realizowane zgodnie z wcześniej zatwierdzonym protokółem. Są nadzorowane przez monitora badań klinicznych CRA (ang. clinical research associate). Dane dotyczące każdego z uczestników (dane pochodzące z historii choroby i innych dokumentów medycznych, np. wyniki badań laboratoryjnych, diagnostyki obrazowej i in.) są wprowadzane do kart obserwacji klinicznej CRF (ang. c::ase report form) i przekazywane do analizy w formie papierowej lub elektronicznej (zob. schemat elektronicznego obiegu danych).
Wyniki wykonywanych na całym świecie badań są podstawą artykułów naukowych, publikowanych w wielu czasopismach medycznych (poświęconych medycynie ogólnej i zagadnieniom specjalistycznym). Stwierdzono, że w latach 1995–2010 nawet w czasopismach najwyższej rangi (najwyższe IF), zwłaszcza należących do specjalistycznych, są zamieszczane niepełne lub niejednoznaczne opisy zastosowanych procedur badawczych. W takich sytuacjach publikowane wyniki są mało wiarygodne (mogą też sugerować czytelnikowi mylne wnioski). Spostrzeżenie stało się bodźcem do nieustających starań o udoskonalenie dokumentu CONSORT (Consolidated Standards of Reporting Trials). Wytyczne są poprawiane i uzgadniane na szczeblu międzynarodowym. Mimo ich ogólnej dostępności liczne spośród publikowanych opisów badań wciąż budzą zastrzeżenia (są przedmiotem naukowych debat i polemik).
Liczba i tematyka randomizowanych kontrolowanych badań klinicznych
| Rok | Liczba rejestracji |
| 2000 | 2190 |
| 2002 | 1960 |
| 2004 | 4010 |
| 2006 | 19170 |
| 2008 | 27320 |
| 2010 | 32460 |
| 2012 | 37040 |
| 2014 | 42260 |
| 2016 | 51210 |
| 2018 | 60690 |
Oszacowanie liczby wszystkich badań klinicznych, wykonywanych na świecie od końca XX wieku, umożliwiają biblioteki publikacji naukowych, np. NLM z wyszukiwarką PubMed, Biblioteki Cochrane lub, od 2005 roku, International Clinical Trials Registry Platform. ITCRP gromadzi informacje o eksperymentach klinicznych od chwili ich zgłoszenia do rejestru do zakończenia. Pierwsza rejestracja (przesłanie „raportu próbnego”) oznacza wstępną deklarację jakości zgodnej z CONSORT oraz jawności.

– AFRO (Brazzaville): 8807
– AMRO (Waszyngton): 157700
– EMRO (Kair): 30099
– EURO (Kopenhaga): 154558
– SEARO (New Delhi): 31219
– WPRO (Manila): 125935
Od czasu podjęcia prac, zmierzających do opracowania wytycznych CONSORT (Douglas Altman i wsp., przełom XX/XXI w.) liczba rejestracji badań klinicznych wzrosła od ok. 2 tys. rocznie do ponad 60 tys. Nie wszystkie badania zrealizowane spełniają wymagania dla „złotego standardu” (zob. tabela w poprzedniej sekcji), a duża ich część nie jest rejestrowana (sugeruje się, że rejestracja powinna być obowiązkowa).
Wśród ponad 660 tysięcy odpowiedzi PubMed na zapytanie „randomized controlled trial” znajdują się tytuły licznych artykułów (w latach 2013–2018 ponad 38 tys. rocznie), dotyczących procedur różnych badań klinicznych oraz wyników realizacji poszczególnych programów. Według Eun-Kyoung Choi i wsp. (2016) do najczęściej badanych kategorii chorób (ICD-10) należą: choroby układu trawiennego (13,1%), układu nerwowego (9,4%) i układu kostno-mięśniowego (9,1%).
EORTC (European Organisation for Research and Treatment of Cancer) zajmuje się od wielu lat problemami nowotworów, należących do najczęstszych przyczyn zgonów. Badania kliniczne dotyczą m.in. jakości życia pacjentów onkologicznych (HRQoL, dobrostan subiektywny) ocenianej z użyciem kwestionariusza QLQ-C30 (Quality of Life Questionnaire Core 30).
Od czasu wybuchu epidemii COVID-19 prowadzone są międzynarodowe adaptacyjne badania kliniczne zmierzające do opracowania leku (zob. leczenie eksperymentalne COVID-19): temat Muticenter, Adaptive, Randomized Blinded Controlled Trial of the Safety and Efficacy of Investigational Therapeutics for the Treatment of COVID-19 in Hospitalized Adults, data rozpoczęcia: 21 stycznia 2020, przewidywana data zakończenia: 1 kwietnia 2023.
Randomizowane kontrolowane badania są wykonywane poza medycyną w wielu dziedzinach nauki, np. w edukacji, kryminologii i innych.
Programy RCT realizują liczni specjaliści polscy, m.in. uczestniczący w międzynarodowych badaniach wieloośrodkowych (np. prace zespołów Uniwersyteckiego Centrum Klinicznego im. prof. K. Gibińskiego w Katowicach, Uniwersytetu Medycznego w Łodzi, Wojskowego Instytutu Medycznego w Warszawie).
Popularyzacja RCT
Prawidłowe wykonywanie eksperymentów klinicznych (m.in. RCT) oraz poprawne wykorzystanie ich wyników wymaga opanowania wiedzy wykraczającej poza ramy specjalności medycznych. Przygotowanie kadry wykonawców projektów badawczych odbywa się m.in. w ramach podyplomowych studiów o charakterze interdyscyplinarnym (medycyna, mikrobiologia, farmakologia, statystyka, socjologia, etyka, systemy opieki zdrowotnej, zarządzanie projektami i in.). Są powadzone przez specjalistów z wykorzystaniem bogatego piśmiennictwa. Wysoko ocenianą pozycją jest książka A.R. Jadada pt. Randomised Controlled Trials: A User’s Guide (wyd. 2. Randomised Controlled Trials: Questions, Answers and Musings, A.R. Jadad i M.W. Enkin).
Przebieg badań i ich wyniki żywo interesują wielu ludzi spoza środowiska medycznego: pacjentów-uczestników badań i ich rodziny, innych chorych, oczekujących na skuteczniejsze kuracje, przedstawicieli firm farmaceutycznych, osoby zarządzające systemami ochrony zdrowia i innych, którym brakuje fachowej wiedzy. Powszechny brak zrozumienia istoty statystyki sprawia, że informacje o jednostkowych przypadkach szkodliwości testowanej terapii wywołują niewspółmierne reakcje, np. wycofywanie się z udziału w badaniach lub kwestionowanie ich wyników. Bywa to źródłem takich zjawisk, jak „kontrowersja szczepionkowa” (zob. też „antyszczepionkowcy”). Metodą przeciwdziałania podobnym zjawiskom jest powszechna edukacja, m.in. pogłębianie świadomości, że testy nie zawsze dostarczają zupełnie jednoznacznych dowodów skuteczności i bezpieczeństwa nowej terapii dla poszczególnych osób tworzących grupę uczestników, np. z powodu występowania obok głównej choroby trudnych do rozpoznania chorób współistniejących i innych nieprzewidywalnych czynników.
Starania o szeroką popularyzację podstawowej wiedzy nt. badań klinicznych prowadzi w Polsce Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych (zob. GCP, ang. Good clinical practice). Europejskie Centrum Informacji ds. Konieczności Rozwoju Świadomości Badań (European Communication on Research Awareness Needs) zabiega o wprowadzenie tematyki badań klinicznych do programów edukacji w szkołach państw Unii Europejskiej. W trzech krajach przeprowadzono m.in. próbne szkolenia, polegające na udziale w fikcyjnym teście RCT (sprawdzeniu hipotezy, że czerwone cukierki (grupa eksperymentalna) dają więcej szczęścia niż żółte (grupa porównawcza) i na opracowaniu zgromadzonych danych. Na internetowej platformie ECRAN-u są dostępne materiały, opracowane w różnych językach europejskich i w formie przystępnej dla dzieci i młodzieży, m.in. materiały audio, wideo, kreskówki i in.) oraz książka Testing Treatments (wyd. 2006 i 2011, opracowanie James Lind Initiative, nadzór Iain Chalmers), udostępniana na Testing Treatments interactive.